A Microbial Biorealm page on the genus Enterococcus faecalis
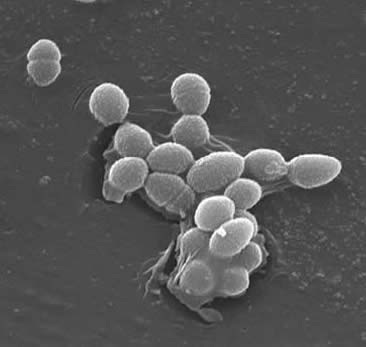
Classification
Higher order taxa
Bacteria; Firmicutes; Bacilli; Lactobacillales; Enterococcaceae; Enterococcus
Arter
Enterococcus faecalis
Beskrivelse og betydning
Enterokokker Er Gram-positive kokker som kan overleve tøffe forhold i naturen. De kan finnes i jord, vann og planter. Noen stammer brukes til fremstilling av matvarer, mens andre er årsaken til alvorlige infeksjoner hos mennesker og dyr(f. eks. De er forbundet med både samfunns-og sykehusoppkjøpte infeksjoner. Enterokokker kan vokse ved et temperaturområde på 10 til 42°C og i miljøer med brede pH-verdier. Noen er kjent for å være motile. Mens Det er over 15 arter Av Enterococcus slekten, 80-90% av kliniske isolater Er E. faecalis (8). Enterokokker danner vanligvis korte kjeder eller er ordnet i par. Imidlertid, under visse vekstforhold, forlenger de og virker kokobacillære. Generelt Er Enterokokker alfa-hemolytiske. Noen har Lancefield-antigenet gruppe D og kan påvises ved bruk av monoklonale antistoffbaserte agglutineringstester.Enterokokker er vanligvis katalase negative, og er anaerobe. De er i stand til å vokse i 6,5% NaCl, kan hydrolysere esculin i nærvær av 40% gallsalter og er pyrrolidonylarylamidase og leucin arylamidase positive (8). Enterokokker har vist seg å presentere en terapeutisk utfordring på grunn av deres motstand mot mange antimikrobielle stoffer, «inkludert celleveggaktive midler; aminoglykosider, penicillin og ampicillin og vancomycin» (1). Enterokokker har kapasitet til å tilegne seg et bredt spekter av antimikrobielle resistensfaktorer, som gir alvorlige problemer ved behandling av pasienter med enterokokkinfeksjoner (8). Generelt kan enterokokkisolater med nedsatt følsomhet for vancomycin kategoriseres som vanA, vanB og vanC. vanA og vanB utgjør den største trusselen fordi de er mest resistente og motstandsgener bæres på et plasmid. Siden resistensgener bæres på et plasmid, er De lett overførbare, E. faecalis kan overføre disse plasmidene ved konjugering (2). E. faecalis er også resistente mot teicoplanin. Enterokokkstammer som er vankomycinavhengige er funnet, men er sjeldne og mindre vanlige enn vankomycinresistente stammer (referert til som «vankomycinresistente Enterokokker» eller «VRE») (1).
Genomstruktur

På grunn av mange helsemessige farer var genomsekvensdataene fra En Stamme Av Enterokokker nødvendig. Stammen valgt for genom DNA-sekvensering var E. faecalis V583, det første vancomycin-resistente isolatet i Usa. Genomet av stamme V583 ble sekvensert av Institute For Genome Research (TIGR). Enterokokkgenomet viser At e. faecalis er metabolsk mangfoldig og inneholder et bredt spekter av reguleringssystemer. Stamme V583 inneholder fire DNA-molekyler: de viktigste 3.218.030 basepar bakteriekromosom og tre sirkulære plasmider. Kromosomet inneholder ca 3500 åpne leserammer( ORFs), ca 1/3 av Disse ORFs har ingen overdras funksjon (8). De tre plasmidene er sirkulære dna-molekyler identifisert Som Plasmid-1, Plasmid-2 og Plasmid-3. Plasmid-1 inneholder 66 320 bp, Plasmid-2 inneholder 17 963 bp, Og Plasmid-3 inneholder 57 660 bp. Plasmidene koder en rekke gener, inkludert transposaser, multi-drug resistance proteiner og en ppGpp-regulert veksthemmer (8). Den gjennomsnittlige g + C-sammensetningen Av e. faecalis-kromosomet er 37,38%. SIDEN DNA-molekylet er så stort, oppstår regionale avvik fra gjennomsnittet. En av disse stedene er det store segmentet forbundet med «vancomycin resistance gene cluster plassert nær 2.22 Mb», som viser en stor økning I Prosent G + C innhold (8). Disse forskjellene knyttet til antibiotikaresistens eller virulens foreslo oppkjøpet av genetisk materiale fra en fremmed art gjennom horisontal overføring. Det er fortsatt ukjent om overføringene er ansvarlige for variasjonene i DNA-sminke. Informasjonen i genomet Av E. faecalis V583 vil i stor grad hjelpe forståelsen av hvordan organismen har tilpasset seg til å være et allsidig humant patogen. Ved hjelp av komparativ genomikk vil de ulike reguleringselementenes rolle bli bedre forstått i hvordan de reagerer på ulike miljøbelastninger og i uttrykk for potensielle virulensfaktorer (8). Flere studier som disse vil foreslå nye medisiner mot bakterielle infeksjoner forårsaket Av Enterokokker.Genomet inneholder også 3 Kbp (encoding for endocarditis biofilm-associated pili) operoner som er viktige for biofilmproduksjon Av e. faecalis stamme OG1RF. Denne stammen bruker disse operonene til å produsere overflate pili. . Overflaten pili brukes til «vedlegg til vertsflatene og er antigene hos mennesker under endokarditt» (9).
TIGR inneholder en komplett liste over gener For e. faecalis kromosomer.
Cellestruktur og metabolisme
Cellemetabolisme
Enterokokker lever i tøffe miljøer, som tarmkanaler hos mennesker og dyr. Vekst under disse fiendtlige forholdene krever At e. faecalis har en metabolisme som er fleksibel. E. faecalis er i stand til ikke bare gjæring for å produsere melkesyre, men kan også «katabolisere et spekter av energikilder fra karbohydrater, glyserol, laktat, malat, citrat, diaminosyrer og manya-keto syrer» (3). Det har vist seg At Under utvalgte vekstforhold Kan e. faecalis øke veksten gjennom oksidativ fosforylering ved hjelp av en protonmotivkraft etablert ved elektrontransport. En konsekvens av «begynnende respirasjon er produksjon av potente oksidanter» (f. eks superoksid og hydrogenperoksid), oksidativt stress E. faecalis kan tolerere (3). Toleransen av dette stresset, kombinert med andre alvorlige vekstforhold, gjør At E. faecalis kan vokse ved 10 til 45°C, i gallsalter og ved ekstremt lav og høy pHs. I Tillegg kan e. faecalis motstå azid, vaskemidler, tungmetaller og etanol. Siden e. faecalis kan bruke varierte sukkerkilder, kan det leve i ulike miljøer, spesielt i tarmen der næringsstoffer er begrenset (2). I tarmen får E. faecalis mesteparten av sin energi fra gjæring av ikke-absorberte sukkerarter. E. faecalis kan også få energi ved å nedbryte muciner,et karbohydrat som er sterkt glykosylert og produsert av tarmbobelceller (2).E. faecalis bruker et «fosfoenolypyruvatfosfotransferasesystem (PTS) for å fornemme sukker utenfor cellen og paropptak av sukker med fosforylering» (2). DERMED blir MINDRE energi (ATP) bortkastet i forhold til hvordan sukker akkumuleres av ikke-PTS-systemer. Sukker metabolisert Av e. faecalis er: d-glukose, d-fruktose, laktose, maltose (ALLE pts-substrater). I Enterokokker regulerer PTS også glycerolmetabolisme, induktorutvisning og katabolittundertrykkelse (8). E. faecalis er en Av få Gram-positive bakterier med Lavt G+C-Innhold som utviser sukker under vekst på glukose, et fenomen kjent som inducerutvisning (8). E. faecalis kan også gjære glyserol under aerobe og mikroaerophillic forhold. E. faecalis kan også vokse på glyserol under anaerobe forhold fordi det «uttrykker et gen FOR NAD+ – bundet anaerob glyseroldehydrogenaseaktivitet» (8). Glyserol kan krysse cellemembranen ved hjelp av et protein kalt glycerol diffusjon facilitator (GlpF). GlpF gjør konsentrasjonen av glyserol i og utenfor cellen lik, proteinet hemmes av glykolyse. E. faecalis er i stand til å leve i ekstrem alkalisk pH og høy saltkonsentrasjon. Disse egenskapene krever kationtransport for å opprettholde den konstante cytosoliske ionkomposisjonen som er avgjørende for homeostase. Alle celler må utvise overflødig natrium for å opprettholde cytosoliske konsentrasjoner i området som favoriserer homeostase. E. faecalis uttrykker Både En Na + / H + antiporter og en vacuolar-Type ATPase (2). Kalium er en stor intracellulær kation. Kaliumkonsentrasjonen i E. faecalis på 0,4 til 0,6 M er avgjørende for normal cellulær metabolisme, den «nøytraliserer intracellulære anioner, aktiverer forskjellige enzymer og regulerer cytosolisk pH» (8). E. faecalis uttrykker minst to kaliumtransportører for å utføre reguleringen, KtrI og KtrII sammen Med kep-systemet For k + ekstrudering (8). Selv om Det er kjent At KtrI og KtrII Er k + opptakssystemer (de Er K+/H+ symporters), er lite mer kjent proteinene.
Cellestruktur
Enterokokker Er Gram-positive kokker som vanligvis danner korte kjeder eller er ordnet i par (3). Under visse vekstforhold kan de forlenge og virke coccobacillary. Celleveggen Til e. faecalis er 20 til 38% av tørrcellevekten (i eksponentielle og stasjonære faseceller). Gitt At E. faecalis er En Gram-positiv bakterie, er det tre hovedkomponenter som utgjør celleveggen: peptidoglykan, teichosyre og polysakkarid. 40% av celleveggen består av peptidoglykan, mens resten av celleveggen består av en «rhamnoseholdig polysakkarid og en ribitolholdig teichosyre» (3). Peptidioglykanen fungerer (som i De Fleste Gram-positive celler) for å motstå sprengning indusert av høyt cytoplasmatisk osmotisk trykk. E. faecalis anses generelt som en ikke-innkapslet organisme, vist ved «mangel på en detekterbar mucoid fenotype» (3). Imidlertid har undergrupper Av e. faecalis-isolater et kapselpolysakkarid. E. faecalis kan utveksle genetisk materiale (plasmider) ved konjugeringsprosesser indusert av små peptidferomoner (2). Overflateprotein «aggregeringsstoffer som gjenkjenner en bestemt ligand på mottakerceller» sikrer vellykkede forbindelser for konjugering (2).E. faecalis har også evnen til å lage overflate pili som kan føre til dannelse av en biofilm. E. faecalis stammer som forårsaker endokarditt inneholder store mengder av disse pili. Pili tillater vedlegg til vertsflater (f.eks. hjertevevet). Stammer Av E. faecalis som forårsaker endokarditt produserer «biofilmen betydelig oftere og også i større grad enn ikke-endokarditt isolerer» (9).
Økologi
E. faecalis er en svært variert art Av Enterokokker. Det samhandler med mange andre organismer og har effekter på miljøet. Enterokokker er medlemmer av bakteriesamfunnet som bor i tykktarmen hos mennesker. De er også en naturlig del av tarmfloraen hos de fleste andre pattedyr og fugler (8). Enterokokker finnes også i jord, planter og vann. Når de er funnet i vann er det vanligvis fordi vannet hadde blitt forurenset med avføring. Selv Om E. faecalis ikke forekommer for ofte i planter, har Andre stammer Av Enterokokker blitt funnet blant planter og er mest sannsynlig å gjøre for en forurenset vannkilde (8).Økologien av antibiotikaresistens og virulensgenoverføring i miljøet er fortsatt ikke godt forstått. Insekter, som husfly (hf), som utvikler seg i forfallende organisk materiale, kan overføre antibiotikaresistente bakterier fra gjødsel av dyr og andre forfallende organiske underlag til boliginnstillinger (7). HF er perfekte sendere på grunn av de levende mikrobielle samfunnene som er tilstede i habitatene der de utvikler seg (f.eks. avføring). Legge til de gode overføringskvaliteter er måten HF mate sine unge (oppstøt) og deres tiltrekning til menneskelig mat. SIDEN HF kan fly lange avstander, er dette insektet veldig bra for spredning av fekale bakterier, inkludert humane og animalske patogener, og muligens antibiotikaresistente stammer Av Enterokokker (7). En nylig studie screenet for antibiotikaresistens og virulensgener i Enterokokker FRA HF i fastfood-restauranter i Kanasas. Denne studien viste at «husfly i matbehandlings-og serveringsanlegg kan bære antibiotikaresistente Og potensielt virulente Enterokokker som har kapasitet til horisontal overføring av antibiotikaresistensgener til andre bakterier» (7).Effektene Som E. faecalis har på miljøet en tendens til å være mer negativ. De forurenser vanligvis vannforsyninger som kan føre til infiserte planter samt infeksjoner hos mennesker (8). Antibiotikafaktorene kan også transporteres av ulike insekter (f. eks. husfluer) og dyr, noe som fører til økende antall virulente E. faecalis.
Patologi
Enterokokker har oppstått som en viktig årsak til nosokomiale infeksjoner, og I Denne gruppen Forårsaker Enterococcus faecalis majoriteten av humane enterokokkinfeksjoner. Disse infeksjonene kan være lokale eller systematiske og inkluderer urinveis-og mageinfeksjoner, sårinfeksjoner, bakteriemi og endokarditt (2). Siden e. faecalis er i stand til å overleve mange miljøutfordringer (som temperatur ekstremer og tilstedeværelse av gallsalter) og fordi De kan skaffe seg motstand mot flere antibiotika, har disse bakteriene blitt et stort helseproblem. National Nosocomial Infection Surveillance (NNIS) system har rapportert økning i forekomsten av infeksjoner på grunn av vancomycin-resistente Enterokokker (VRE) siden 1989 (1). Dette kan bety alvorlige helseproblemer, som inkluderer mangel på tilgjengelig antibiotikabehandling for VRE-infeksjoner, fordi de fleste VRE-stammer har motstand mot flere antibiotika i tillegg til vancomycin(f. eks. Overføringen av vanocmycin resistente gener FRA VRE til Andre Gram-positive patogener er et alvorlig folkehelseproblem. Den vanligste måten e. faecalis forårsaker infeksjon på sykehus / langtidspleie er overføring Av e. faecalis mellom pasienter (8). Enterokokker kan bæres i hendene på helsepersonell og bæres (overføres) fra en pasient til en annen. DET har vist SEG AT VRE på hendene kan vare i opptil 60 minutter (8). Overføringen fra en helsepersonell hender til pasienten kan skje ved kontakt med pasientens intravenøse eller urinkateter. Rektale termometre, som ikke er ordentlig rengjort etter bruk, kan også overføre VRE fra pasient til pasient. Noen ganger kan overføringen resultere i kolonisering av pasientens GI-kanal med den oppkjøpte stammen. Den nye stammen blir da en del av pasientens endogene flora (8). Den oppkjøpte stammen, som bærer antibiotikaresistensgener, er i stand til å leve i GI-kanalen. Infeksjoner oppstår da fra disse nyoppkjøpte e. faecalis-stammene.E. faecalis kan forårsake mange infeksjoner i menneskekroppen. Den vanligste infeksjonen forårsaket Av Enterokokker er infeksjon i urinveiene. E. faecalis kan forårsake lavere urinveisinfeksjoner( UTI), som cystisis, prostatitt og epididymitt (8). E. faecalis finnes også i intra-abdominal, bekken og bløtvev infeksjoner. E. faecalis kan forårsake nosokomial bakteriemi. Kilden til bakteriemi er oftest urinveiene, som forekommer fra et infisert intravenøst kateter. Endokarditt er den mest alvorlige enterokokkinfeksjonen, da det forårsaker betennelse i hjerteventilene. I mange tilfeller av endokarditt mislykkes antibiotikabehandling og kirurgi for å fjerne den infiserte ventilen er nødvendig (8). Mindre vanlige infeksjoner forårsaket Av e. faecalis inkluderer meningitt, hematogenous, osteomyelitt, septisk artritt, og (svært sjelden) lungebetennelse. På Grunn Av resistens Av Enterokokker til mange antibiotika er behandling av disse infeksjonene vanskelig.
Anvendelse På Bioteknologi
Enterokokker har blitt studert for mulig bruk som et probiotisk (et kosttilskudd som inneholder levende ikke-virulente mikrobielle celler som ved inntak antas å ha gunstig innvirkning på sammensetningen av tarmmikrofloraen). Administrasjon Av e. faecalis-stammen er vist å redusere diare. E. faecalis probiotika brukes i kylling / gris / storfe for å senke diare hos dyrene (8).på grunn Av De høye sykdomsfremkallende egenskapene Til e. faecalis har det blitt utført mye mer forskning på hvordan å stoppe virulensen Av E. faecalis enn den gunstige bruken Av E. faecalis.
Nåværende Forskning
1.) Håp for infeksjoner forårsaket Av Enterococcus faecalis (4)
det er kjent at vancomycin-resistente bakterier (F. eks e. faecalis) utgjør mange problemer for samfunnet, forårsaker bakterielle infeksjoner hos mennesker som er vanskelig å behandle. Enterokokkinfeksjonene er utfordrende fordi organismene har evne til raskt å skaffe seg og spre resistensgener. Ceftobiprole (BPR) ble brukt som en undersøkende cefalosporin mot Gram-positive kokker. BPR er et bredspektret parenteralt cefalosporin med høy slektskap fra Gram-positive og Gram-negative penicillinbindende proteiner. Det viser også stabilitet mot hydrolyse av β-laktamaser.Denne studien undersøkte AKTIVITETEN AV BRP mot en stor samling Av E. faecalis, ser PÅ bpr bakteriedrepende aktivitet mot vancomycin-resistente isolater. Studien fant at mottakelig FOR BPR i E. faecalis ikke påvirkes av tilstedeværelse av vankomycinresistens eller ved produksjon av β-laktamase. I Stammer Av E. faecalis som viste enten vankomycinresistens (VanA-og VanB-fenotyper) eller ampiciliinresistens, var BPR bakteriedrepende. Forskerne viste AT BPR viste bakteriedrepende aktivitet mot e. faecalis i en dose på 750 mg, og hemmet 100% Av e. faecalis-aktiviteten. Selv Om forekomsten av enzymet β-laktamase er sjelden i E. faecalis, kompromitterer tilstedeværelsen bruken av de mest effektive anti-enterokokk-laktamene (f.eks. ampicillin). BPR er et dårlig substrat for hryvnias-laktamase-enzym, som forklarer dets utmerkede aktivitet mot hryvnias-laktamase-produserende E. faecalis.Denne forskningen viste AT BPR har potent aktivitet mot en meget stor samling Av E. faecalis. AKTIVITETEN TIL BPR ble ikke påvirket av vankomycinresistens eller produksjon av β-laktamase. DERFOR er BPR et håpefullt middel til bruk for å behandle β-laktamaseproduserende og vankomycinresistente e. faecalis-infeksjoner hos mennesker.
2.) Undersøke Hvordan Enterococcus faecalis blir resistente mot stoffet linezolid (5)
når antibiotika brukes i behandling av en bakteriell infeksjon, kan de ha en innvirkning på tarmfloraen. Resistente bakterier kan velges under behandling, Som Enterokokker, og er potensielt patogene. Fremveksten av resistens er et problem for nye antibiotika fordi det kan risikere bruken av antibiotika.Denne studien undersøkte fremveksten Av resistens mot antibiotika Av e. faecalis. Nærmere bestemt så forskerne på resistens mot linezolid(den første av en ny klasse antibiotika kjent som «oksazolidinoner»). Linezolid kan brukes mot Multiresistente Gram-positive kokker, inkludert VRE. Det hemmer bakteriell proteinsyntese ved å binde seg spesifikt til et domene I 50s ribosomal subenhet og påvirkes ikke av resistensmekanismer som påvirker andre antibiotika. Denne studien så på forekomsten av linezolid-resistente e. faecalis mutanter i fordøyelseskanalen hos gnotobiotiske mus. Do av linezolid ble matet i vann med doser som varierte fra 0,5, 0,005 til 0,005 g / L. mutantene var alle avhengige av linezolid gitt, nivåene av resistens økte med eksponeringsvarigheten. Ingen mutanter ble isolert i fravær av linezolid, noe som tyder på at de novo resistens overfor linezolid var uvanlig hos Enterokokker.Forskningen fant at en mutasjon i et ENKELT 23s rRNA-gen var det kritiske trinnet i fremveksten av linezolid-resistens. Primær kolonisering med enkeltmutasjoner ble observert så tidlig som 5 dager etter behandlingsstart hos mus.Disse forsøkene med mus bidrar til å forklare mønsteret for fremvekst av resistens mot linezolid observert i kliniske isolater. Forskerteamet viste at dose er kritisk for resistensdynamikken. Disse funnene skal bidra til å definere de beste terapeutiske strategiene for å minimere fremveksten av motstand i klinisk setting, muligens redde mange liv.
3.) En Ser/Thr kinase I Enterococcus faecalis er funnet å mediere antimikrobiell resistens (6)
Enterococcus faecalis forårsaker Mange av antibiotikaresistente infeksjoner i sykehus, en konsekvens av dens iboende resistens mot visse antibiotika og dens evne til å overleve og spre seg i tarmkanalen.Det genetiske grunnlaget for resistens sett I E. faecalis er ikke kjent, denne forskningen forsøker å identifisere en årsak til motstanden. Forskerne viste At PrkC, Et komponentsignalprotein som inneholder et eukaryotisk Type Ser/Thr-kinase-domene, tillot iboende antimikrobiell resistens og intestinal utholdenhet Av E. faecalis. De fant at En E. faecalis mutant mangler PrkC vokste på en vill-type hastighet i fravær av antimikrobiell stress, men viste økt følsomhet for celle-konvolutt-aktive forbindelser, inkludert antibiotika som målrettet celle-vegg biogenese og galle vaskemidler.PrkC regulerer fysiologiske prosesser I E. faecalis som er nøkkelen til suksess som et nosokomialt patogen. Forskernes forutsagte struktur Av PrkC var et cytoplasmisk kinase-domene separert av et transmembran segment som antas å binde uncross-linked peptidoglykan. Dette antydet At PrkC var en transmembranreseptor som overvåker integriteten Til e. faecalis cellevegg og medierer adaptive responser for å opprettholde den intergriteten. PrKC er viktig For E. faecalis å forårsake nosokomiale infeksjoner, noe som tyder på at signalproteinet er et mål for utvikling av terapier for å forhindre infeksjoner av antibiotikaresistente Enterokokker.
1.) I. T. Paulsen, L. Banerjei, G. S. A. Myers, K. E. Nelson, R. Seshadri, T. D. Read, D. E. Fouts, J. A. Eisen, S. R. Gill, J. F. Heidelberg, H. Tettelin, R. J. Dodson, L. Umayam, L. Brinkac, M. Beanan, S. Daugherty, R. T. DeBoy, S. Durkin, J. Kolonay, R. Madupu, W. Nelson, J. Vamathevan, B. Tran, J. Upton, T. Hansen, J. Shetty, H. Khouri, T. Utterback, D. Radune, K. A. Ketchum, B. A. Dougherty, C. M. Fraser. «Rolle Av Mobilt DNA I Utviklingen Av Vancomycin-Resistent Enterococcus faecalis.» Science. Mars 2003. Vol. 299, Nr. 5615. s. 2071-2074
2.) Murrary VÆRE. Mai 1998. «Mangfold blant multiresistente enterokokker.»Emerging Smittsomme Sykdommer. Vol. 4, nr. 1. s. 46-65.
3. De la Maza, Luis M., Marie T. Pezzlo og Janet T. Shigei. Farge Atlas Av Medisinsk Bakteriologi. Washington, DC: American Society For Microbiology Press, 2004.
4.) A. s., A. S., A. S., A. S., a. S., A. S., A. S.. «Time-Kill Og Synergisme Studier Av Ceftobiprol mot Enterococcus faecalis, Inkludert ß-Laktamase-Produserende Og Vancomycin-Resistente Isolater.»Antimikrobielle Midler Og Kjemoterapi. Juni 2007. Vol. 51, nr.6. s. 2043-2047.
5.) Bourgeois-Nicolaos N., Massias L., Couson B., Butel MJ, Andremont A., Doucet-Populaire F. » Doseavhengighet Av Fremveksten Av Resistens Mot Linezolid I Enterococcus faecalis In Vivo.»Journal Of Infectious Diseases. 2007. Vol. 195. s. 1480-1488.
6.) Kristich C., Wells C., Dunny G. «En eukaryotisk Ser / Thr-kinase i Enterococcus faecalis medierer antimikrobiell resistens og intestinal persistens.»Proceedings Av National Academy Of Sciences I Usa. Februar 2007. Vol. 104, nr.9. s. 3508-3513.
7.) Macovei, L., Zurek, L. » Økologi Av Antibiotikaresistensgener: Karakterisering Av Enterokokker Fra Husfly Samlet I Matinnstillinger .»Anvendt Og Miljømessig Mikrobiologi. Juni 2006. Vol. 72, nr.6. s. 4028-4035.
8.) Gilmore, Michael. Enterokokker: Patogenese, Molekylærbiologi og Antibiotikaresistens. Washington, DC: American Society For Microbiology Press, 2002.
9.) Nallapareddy SR, Singh KV, Sillanpää J, Garsin Da, Höö M, ERLANDSEN Sl, MURRAY be.. «Endokarditt og biofilm-assosiert pili Av Enterococcus faecalis.»Journal Of Clinical Investigation. Oktober 2006. Nr. 116. s.2799-2807.Redigert Av Richard A. Martinez FRA UC San Diego, Student Av Rachel Larsen.