Hva er Ionisk Binding?
Kjemiske bindinger dannes når den totale energien til de bundne atomer er lavere enn den totale energien til de separate atomer.Formen bindingen tar, bestemmes av elektronarrangementet som minimerer energien.
i noen tilfeller deles elektroner mellom atomer – dette kalles kovalent binding.
i andre tilfeller er det en fullstendig overføring av en eller flere elektroner fra ett atom til et annet.Atomet som mister elektroner blir et positivt ladet ion.Atomet som mottar elektroner blir et negativt ladet ion.
dette fører til ionisk binding – gjensidig elektrostatisk tiltrekning av positiv og negativ charges.In dens reneste form, ionisk binding er ikke retningsbestemt. Det kan betraktes som enkel Coulombic attraksjon mellom punkt kostnader.Dette er forskjellig fra kovalent binding, hvor deling av elektroner resulterer i retningsbindinger.
Elektronoverføring
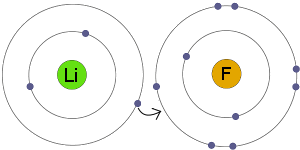
li overfører et elektron Til F. resultatet er at både den resulterende ioner blir elektrisk ladet og har komplette, stabile elektronskall.
Elektrostatisk Tiltrekning
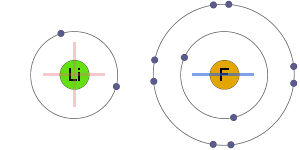
de positive og negative ioner er elektrostatisk tiltrukket av hverandre, noe som resulterer i en ionisk binding.
den coulombiske kraften har ingen foretrukket retning, med det resultat at ioniske forbindelser har en tendens til å eksistere som gigantiske krystallgitterstrukturer av ioner pakket sammen.
En Prøve Av Litiumfluoridets Krystallgitter

Elektronegativitet og Ionisk Binding
To elementer vil ha en tendens til å binde ionisk når de varierer mye i elektronegativitet.
Periodisk Tabell Av Elektronegativitet
jo lysere skyggen av grønt, desto høyere er elektronegativiteten. Grå betyr at ingen verdi er kjent. (Klikk på bildet for større visning.)

Kovalent Binding Karakter
Helt rene ionisk bundet forbindelser ikke virkelig eksisterer, fordi den positivt ladede ion polariserer den negative ion elektron sky.Dette er spesielt merkbart når det gjelder små, høyt ladede metallioner Som Al3+, selv om polariseringseffekten til en viss grad er tilstede i alle ioniske forbindelser.Polarisering er effektivt en retningsbestemt elektrondelingseffekt, derfor introduserer den en liten mengde kovalens i ioniske forbindelser.andelen ionisk / kovalent oppførsel i en binding kan meget grovt vurderes ved Hjelp Av pauling-skalaen av elektronegativitet.Linus Pauling anslått at en elektronegativitetsforskjell på 1,7 mellom elementer fører til binding som er 50 prosent ionisk.
Verdier under 1 tilsvarer kovalent binding dominerende og verdier over 2 til ionisk binding dominerende.
Electronegativity of Selected Elements (Pauling Scale)
| Element | Electronegativity |
|---|---|
| hydrogen | 2.20 |
| lithium | 0.98 |
| sodium | 0.93 |
| aluminum | 1.61 |
| carbon | 2.55 |
| oxygen | 3.44 |
| chlorine | 3.16 |
| iodine | 2.66 |
C-h-bindingen med en forskjell på 0,35 vil være kovalent, Mens nacl-binding ved 2,23 vil være ionisk.HCl-binding ved 0,96 vil være polar kovalent, Og LiI-binding ved 1,68 vil være 50/50 ionisk / kovalent.den største elektronegativitetsforskjellen er 3,19, mellom cesium (0,79) og fluor (3,98). Den resulterende bindingen er omtrent 95 prosent ionisk karakter.
