Antiaromatiske Forbindelser Er Uvanlig Ustabile
Hva er de viktigste faktorene som avgjør om et molekyl er antiaromatisk?
i våre tidligere innlegg i vår serie på aromaticity,, vi så at aromatiske molekyler er uvanlig stabil. De har spesielt store resonansenergier, har en tendens til å gjennomgå substitusjon i stedet for addisjonsreaksjoner, og har delokaliserte pi-elektroner (alle C-c-bindingslengder i benzen er like, for eksempel).
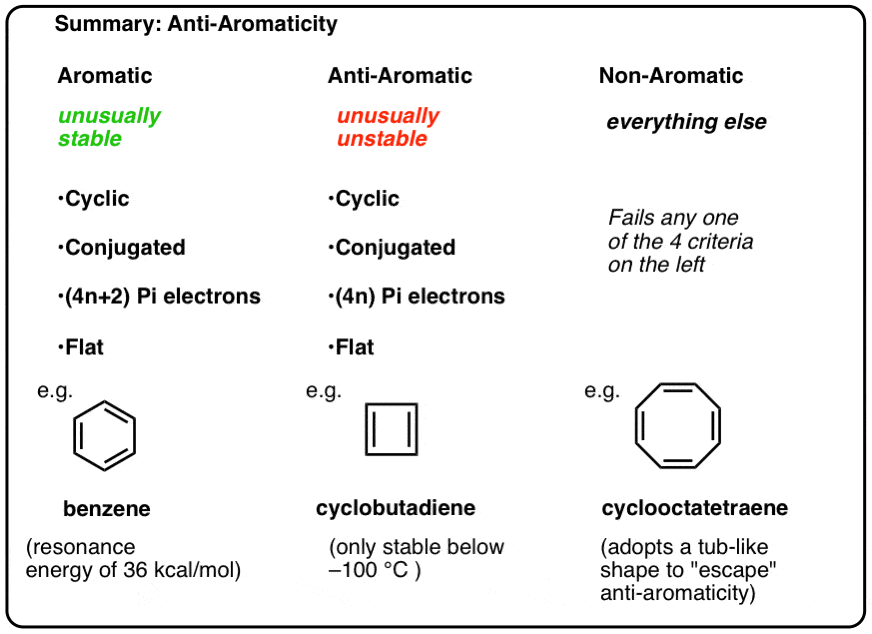
for å være aromatisk må et molekyl ha følgende fire strukturelle egenskaper:
- syklisk
- konjugert rundt ringen
- har pi elektroner
- flat (plan)
hvis disse fire betingelsene er oppfylt, er molekylet aromatisk.
hvis det flunker enda et spørsmål på testen, er det ikke-aromatisk.
det ser ut til å være ganske klart. Eller er det?
Du kan gjette fra måten jeg rammer dette spørsmålet på at svaret er «ikke helt». : – )
Innholdsfortegnelse
- Noen Molekyler Er Så Spektakulært Og Uvanlig Ustabile Og Vanskelig Å Isolere At De Fortjener Sin Egen Kategori:Antiaromatisk
- Cyclopentadienylkation: Den «Resonansstabiliserte» Karbokasjonen Som Ikke Er Stabil
- Antiaromatiske Tredelte Ringer: Oksiren, 1h-Aziren, Tiiren
- Cyclobutadien Er Antiaromatisk
- et 8 pi-elektron Eksempel på en antiaromatisk forbindelse: Pentalene
- hva Gjør Et Molekyl Anti-Aromatisk?
- Cyclooctatetraene «Unnslipper» Anti-Aromaticity Gjennom Å Vri Ut Av Flathet
- Konklusjon: Antiaromatiske Forbindelser
- Notater
- Avansert: Referanser og Videre Lesing
li>
1. Spektakulært Ustabile Molekyler Som Danner En Kategori For Seg Selv:»Anti-Aromatisk»
Her er tingen. Det er et lite antall molekyler som flunk aromaticitetstesten som ikke bare er ikke-aromatisk: de har egenskapen til å være så spektakulært og uvanlig ustabil og vanskelig å isolere at de fortjener et annet navn.
vi kaller disse molekylene «anti-aromatiske».det som er interessant er at molekylene i mange tilfeller ikke ser ut til å være spesielt ustabile fra første prinsipper, i motsetning til for eksempel kuban. Morsomt nok, du kan kjøpe cuban (mer eller mindre) Fra Aldrich, men de fleste av de anti-aromatiske molekylene vi diskuterer nedenfor, er bare stabile ved ekstremt lave temperaturer – hvis de kan isoleres i det hele tatt!
2. Cyclopentadienyl Kation: Den «Resonansstabiliserte» Karbokasjonen som Ikke Er Stabil
La oss starte vår reise ned i kaninhullet med et enkelt eksempel som burde virke kjent fra første semester organisk kjemi.
Husk SN1-reaksjonen? Katten som forlater den komfortable stolen først?
Hurtig gjennomgang: Start med et alkylhalogenid. Leaving gruppe blader, danner en carbocation. Nukleofil angrep. DET kalles SN1 fordi det hastighetsbestemmende trinnet (karbokasjonsformasjon) er unimolekylært. Bunnlinjen: jo mer stabil karbokasjonen, desto raskere fortsetter reaksjonen. Derfor er reaksjonshastigheten for alkylhalogenider tertiær> sekundær> primær, og karbokasjonen får spesielle bonuspoeng hvis den stabiliseres av resonans.
Se på DISSE TO SN1-reaksjonene. HVILKEN tror du ville skje raskere – SN1-reaksjonen som går gjennom en sekundær karbokasjon (A), ELLER SN1-reaksjonen som går gjennom en sekundær karbokasjon og kan danne flere resonansformer (B)?
fra alt du har lært så langt, forventer du at svaret Skal Være B).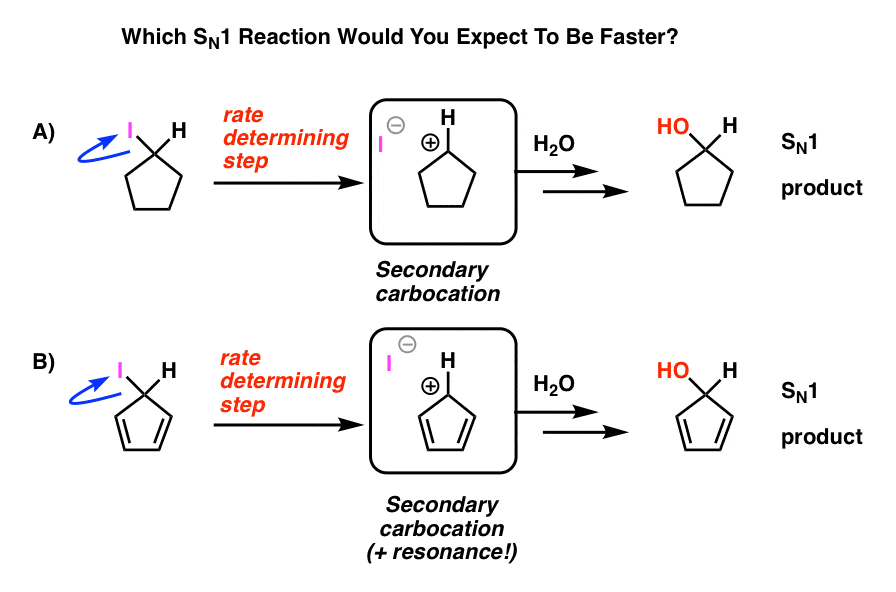
Det er ikke.
svaret Er at reaksjonen A) skjer raskere. Reaksjon B skjer ikke i det hele tatt.
Dette burde slå deg så dypt rart.
Det er!
Hvordan er det at denne tilsynelatende resonansstabiliserte karbokasjonen er mindre stabil enn en sekundær karbokasjon?
tross alt, Hvor mange ganger er det boret inn i hodet ditt som resonans stabiliserer molekyler, spesielt karbokasjoner?
Men her ser det ut til å være destabiliserende. Det er…det er …

men ustabil det er! Cyclopentadienylkation er utrolig ustabil og vanskelig å lage – og det er ikke mangel på å prøve. Det er noe veldig rart om strukturen av cyklopentadienylkation som gir den uvanlig ustabilitet.

Syklisk, konjugert, flat…. og har 4 pi elektroner. Interessant!
3. Antiaromatiske Tredelte Ringer: Oksiren, 1h-Aziren, Tiiren
En annen klasse av» unnvikende » molekyler er en familie av tredelte ringer. Du kan kanskje huske Fra Org 1 at det er enkelt å lage epoksider fra alkener ved hjelp av en oksidant som m-CPBA.Har du noen gang lurt på hvorfor vi aldri dekket den samme reaksjonen for alkyner?
Vel, det er ikke for mangel på å prøve. Kjemikere har prøvd alle slags metoder for epoksiderende alkyner, og vet du hva? Reaksjonen bare ikke frickin ‘ arbeid.for eksempel vil epoksydasjon av acetylen gi molekylet nedenfor (oksiren).
Oxirene selv har aldri blitt observert, selv om det er tantalizing spor av sin flyktige eksistens. Og forresten, har heller ikke nitrogenanalogen, 1H-aziren eller tiiren.
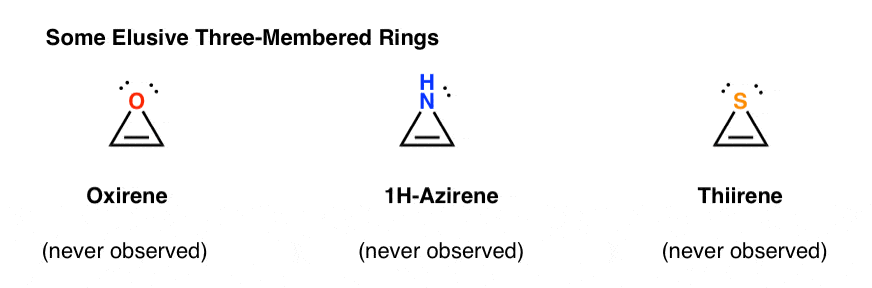
Hvorfor ikke? Hva er spesielt med hvert av disse tilfellene?Du kan legge merke til at disse molekylene, som cyklopentadienylkation, er sykliske, konjugerte, flate og har 4 pi-elektroner (to i pi-bindingen og to fra et ensomt par).
OK. Hva annet kan være syklisk, konjugert, flat og har 4 pi elektroner?
4. Cyclobutadien Er Antiaromatisk
Cyclobutadien ser ut som et enkelt nok molekyl, men det ble faktisk ikke syntetisert til 1965. Og selv da ble det funnet at det ikke er stabilt ved temperaturer over 35 Kelvin.
spørsmålet er, hvorfor?

Jada, Det er en fire-leddet ring, og ja, det har mye ring belastning, men mer anstrengt molekyler har blitt gjort som faktisk er stabil ved romtemperatur.du kan også merke deg at som eksemplene ovenfor er cyklobutadien et annet eksempel på et molekyl som er syklisk, konjugert, har 4 pi-elektroner og er flatt.
det som er enda mer interessant er det som ble lært om geometrien av cyclobutadien. I stedet for å være et molekyl med identiske bindingslengder (som benzen), ble cyklobutadien funnet å ha en rektangulær form, noe som indikerer at elektronene ikke ble delokalisert.
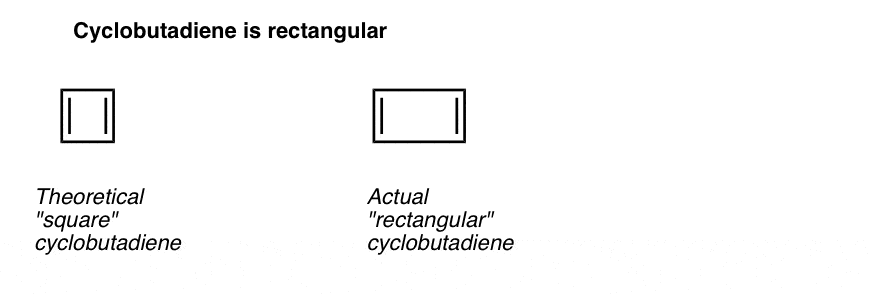
Hva dette forteller oss er at selv når et molekyl oppfyller alle betingelsene (sykliske, konjugerte, flate, 4 pi elektroner), er den symmetriske geometrien spesielt ustabil. . Veldig interessant!
Et 8 Pi-Elektron Eksempel På En Antiaromatisk Forbindelse: Pentalen
så langt har alle eksemplene vi har sett så langt hatt 4 pi elektroner. Du lurer kanskje på: er det noen eksempler på anti-aromatiske molekyler som har mer enn 4 pi elektroner? Hvorfor, ja.
molekylet nedenfor kalles «Pentalene». Den har blitt syntetisert, men er bare stabil under -100 °C. Over denne temperaturen kombinerer den med et annet molekyl i seg selv (referanse). Et annet eksempel på spektakulær ustabilitet.

Pentalen har 8 pi elektroner. Dette kan sette av noen alarmklokker av anerkjennelse. Husk hvordan antall pi-elektroner i aromatiske molekyler fulgte sekvensen (2, 6, 10, 14….) ?
dette eksemplet antyder at antall pi-elektroner i anti-aromatiske molekyler følger sekvensen (4, 8, 12…)
Hva Gjør Et Molekyl Anti-Aromatisk?
så hva har alle disse molekylene i dette rogues-galleriet til felles?
Hver av dem er syklisk, konjugert og flat – og når du teller antall pi-elektroner, er det multipler av 4. Så mens aromatiske molekyler har (4n+2) pi elektroner, er «regelen» for anti-aromatiske molekyler (4n). (en annen måte å se på det: antall pi-elektroner vil være to ganger et jevnt tall).
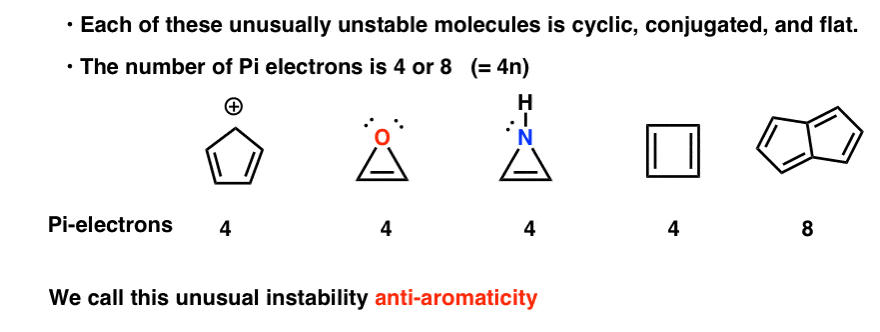
Denne uvanlige ustabilitet kalles «anti-aromaticity».
Dette betyr at vi nå kan trekke opp tre kategorier for molekyler i henhold til følgende kriterier:
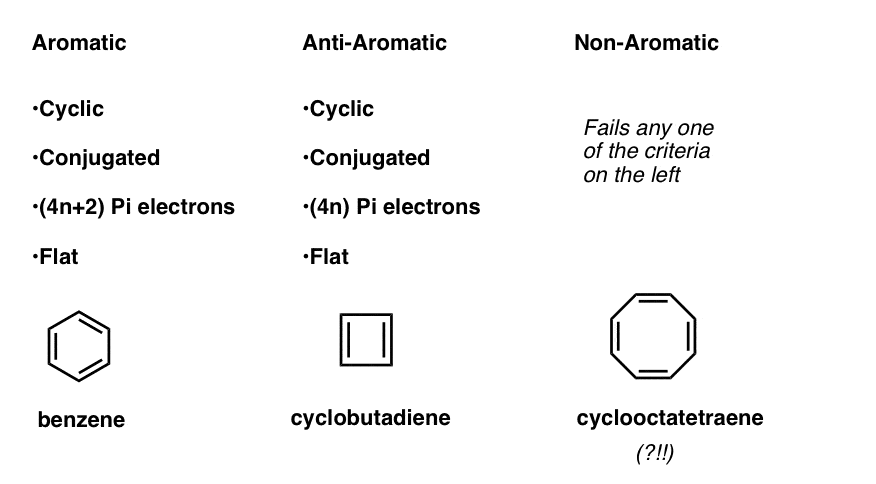
- Aromatiske molekyler er sykliske, konjugerte, har (4n+2) pi elektroner, og er flate.Antiaromatiske molekyler er sykliske, konjugerte, har (4n) pi-elektroner og er flate.
- Ikke-aromatiske molekyler er alle andre molekyler som feiler en av disse forholdene.
Vent litt-du lurer kanskje på hvorfor cyclooctatetraene er klassifisert som «ikke-aromatisk». Med 8 pi elektroner (to ganger et jevnt tall) bør det ikke være «anti-aromatisk»?
Cyclooctatetraene «Rømmer» Anti-Aromaticity Gjennom Å Vri Ut Av Flathet
Tenk på å oppfylle betingelsene for «anti-aromaticity» som litt som å kvalifisere for en ekstremt straffe inntektsskatt. Gitt muligheten til å finne et smutthull for å komme seg ut av skatten, ville du gjøre det? Sannsynligvis.
Cyclooctatetraene er antiaromatisk bare hvis den er flat. Den relativt «floppy» strukturen av cyclooctatetraene gir imidlertid litt fleksibilitet. Bindingene kan rotere vekk fra flathet slik at molekylet vedtar en «kar-lignende» form, og dermed unngår «antiaromaticitetsskatten» på 18 12 kcal / mol som ville bli betalt dersom alle p-orbitaler på molekylet ble konjugert med hverandre.
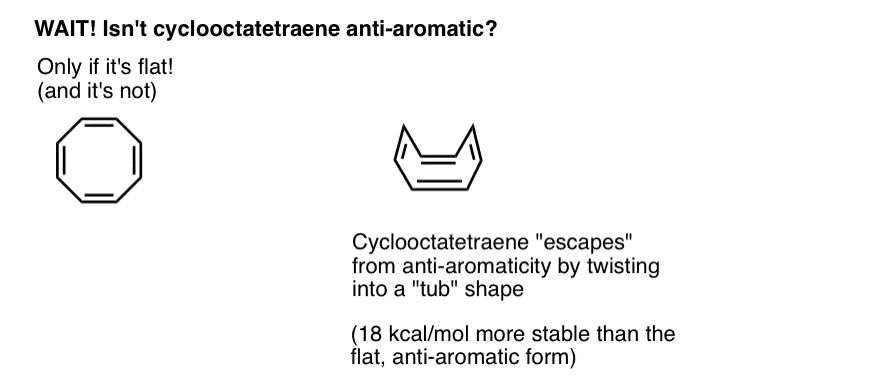
Det viser seg at cyclooctatetraene har blitt syntetisert, er stabil (du kan kjøpe den her, for eksempel) og oppfører seg som en «normal» alken, som gjennomgår tilleggsreaksjoner, hydrogenering og så videre.Pentalen (over) som også har 8 pi-elektroner, har en veldig stiv bicyklisk struktur som forhindrer bindingsrotasjon bort fra flathet. Derfor er det fast i sin anti-aromatiske konformasjon.Anti-aromaticitet for molekyler med mer enn 8 pi elektroner er kjent, men svært uvanlig. (Her er et morsomt eksempel på en annen «flukt» fra aromaticitet for et molekyl med 18 pi elektroner.)
Konklusjon: Antiaromatiske Forbindelser
Så langt har vår behandling av aromaticity og anti-aromaticity vært rent beskrivende og empirisk. Vi har vist mange eksempler, og gitt mange regler, men mangler fra diskusjonen har vært en dyp forklaring på «hvorfor».
Hva er så spesielt med benzenringen som gjør den så stabil? Hvorfor er det stabilt?
Hva er så spesielt med cyclobutadien-systemet som gjør det så ustabilt. Hvorfor er det ustabilt?for å kunne svare på disse dypere spørsmålene, må vi gå tilbake og undersøke molekylorbitalene til disse to molekylene, og deretter komme til en dypere forståelse av aromaticitet og anti-aromaticitet.
det er det vi skal gjøre i vårt neste innlegg.
Takk Til Matthew Knowe for hjelp til å forberede dette innlegget.
Notater
Fotnote 1. For enkelhets skyld er bildet vist i hovedartikkelen fudges på de faktiske reaksjonsbetingelsene. De faktiske eksperimentelle forholdene er vist nedenfor. Løsningsmidlet er propionsyre, Og Lewis syre sølv perklorat tilsettes for å bistå med å trekke av jod. .
selv under disse forholdene dannes ikke cyklopentadienylkarbokalisering, noe som er et bevis på ekstrem ustabilitet.
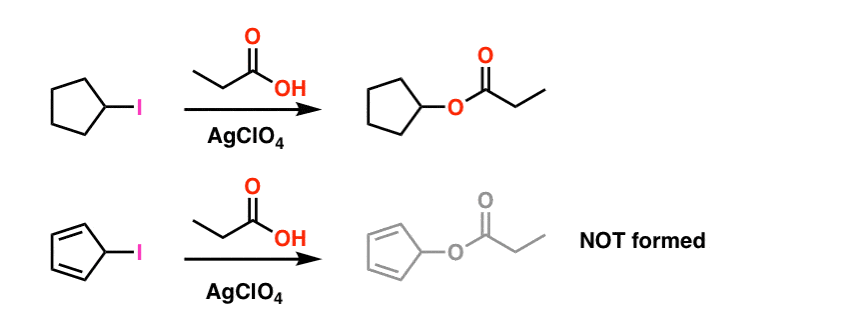
Fotnote 2. Epoksydasjon på eten (aka etylen) gjøres til melodi av 15 millioner tonn, årlig. Epoksydasjon av acetylen for å danne oksiren er ukjent.
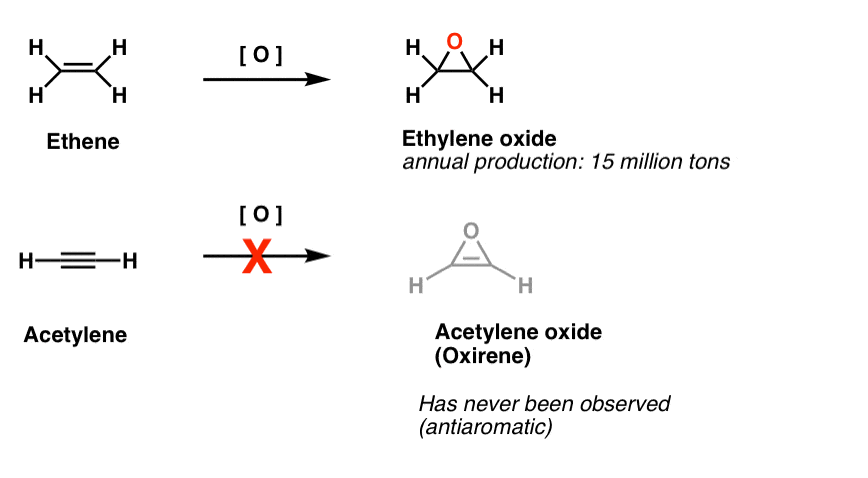
Flyktig bevis på eksistensen av oksirener er funnet. Det er gode bevis fra isotop merking studier som oksirener er flyktige mellomprodukter i visse Wolff rearrangements. Det er også to eksempler på oksirener som har blitt fanget ved ekstremt lav temperatur, men dekomponert over 35 Kelvin.
den flyktige eksistensen AV ET 1h-azirin har blitt postulert ved tilsetning av et nitren til et acetylen, som raskt omarrangeres til en (stabil) 2h-aziren(under).
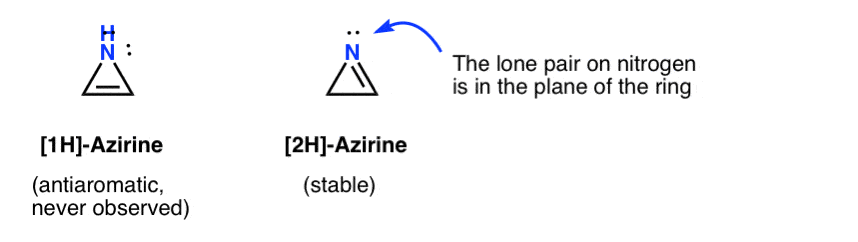
Merk at I 2H-azirene er det ensomme paret på nitrogenet rett vinkel mot pi-systemet, så dette systemet er ikke-aromatisk i motsetning til anti-aromatisk.
For mer diskusjon, se Mars Advanced Organic Chemistry. Jeg har jobbet av 5th-utgaven, sidene 62-63.
. Fotnote 3. Et veldig smart eksperiment fastslått at 1,2-dideutero cyclobutadien har to isomerer, ikke en (se nedenfor). Dette indikerer at dobbeltbindingene i cyklobutadien ikke delokaliseres som de er i benzen, men er mer som dobbeltbindinger i en konvensjonell dien.
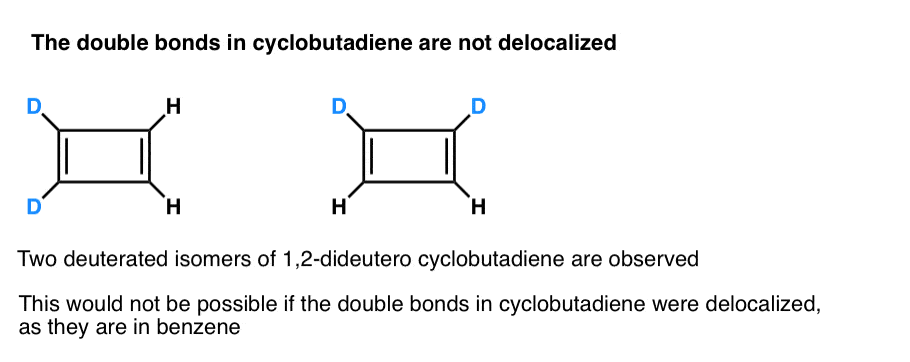
Cyklobutadien reagerer med seg selv ved 35 K for å danne en «dimer», i et eksempel på en diels-Alderreaksjon.
Fotnote 4. Ja, det er sant at det ensomme paret i azirene kan settes inn i en sp3 hybrid orbital (under). Dette reduserer sannsynligvis den anti-aromatiske «straffen» noe, men molekylet er fortsatt utrolig ustabilt. Anti-aromaticity er den enkleste måten å redegjøre for dette.

Fotnote 5. Den rektangulære geometrien skyldes en effekt kjent Som Jahn-Teller-effekten. Husk paulis eksklusjonsprinsipp, hvor elektroner ikke kan ha samme kvantetall? Vel, som vi ser når vi ser på molekylorbitediagrammet for cyclobutadien, har» square «cyclobutadien to» degenererte » elektroner, dvs. de har samme energier og kvante tall. Dette fører til et fenomen kjent som «Pauli repulsion», hvor forlengelse av bindingene oppstår til energinivåene til de to elektronene er differensiert. Definitivt et avansert tema.
(Avansert) Referanser og Videre Lesing
- Overgang-Tilstand Spektroskopi Av Cyclooctatetraene
Paul G. Wenthold, David A. Hrovat, Weston T. Borden, W. C. Lineberger.
Vitenskap, 1996, 272, 1456-1459.
DOI: 10.1126 / vitenskap.272.5267.1456
denne studien er grunnlaget for uttalelsen om at den ikke-aromatiske grunntilstanden til cyclooctatetraene er 12 kcal / mol under den» antiaromatiske » konformasjonen. - Temming Av Cyclobutadiene
Donald J. Cram, Martin E. Tanner, Robert Thomas
Chem. Int. Ed. 1991, 30 (8), 1024-1027
DOI: 10.1002 / anie.199110241
denne artikkelen Av Nobelprisvinner Prof. Donald J. Cram (UCLA) beskriver den første spektroskopiske karakterisering av cyklobutadien. Dette oppnås ved å omslutte forløperen i en hemicarcerand( burkompleks), og deretter bestråle DEN MED UV-lys, og dermed skape cyclobutadien, som ikke klarer å gjøre noe siden det er fanget. - Cyclobutadiene
Thomas Bally, Satoru Masamune
Tetraeder 1980, 36 (3), 343-370
DOI: 1016/0040-4020 (80)87003-7
dette papiret fra 1980 vurderinger arbeid gjort på cyclobutadiene opp til den tiden. Dette er delt inn i 2 deler-eksperimentell syntetisk innsats og teoretiske beregninger. - Tetrahedran og Cyclobutadien
G Hryvnther Maier
Chem. Int. Ed. 1988, 27 (3), 309-332
DOI: 10.1002 / anie.198803093
denne artikkelen vurderinger syntetisk innsats mot tetraeder og cyklobutadien – begge molekylene har en formel PÅ C4H4. Bare substituerte (tetra t-butyl og tetra trimetylsilyl) tetraeder har blitt syntetisert og isolert til dags dato. - Cyclobutadien – Og Benzocyclobutadien-Jern Tricarbonyl Komplekser
F. Emerson, L. Watts, Og R. Pettit
Journal Of American Chemical Society 1965, 87 (1), 131-133
DOI: 10.1021/ja01079a032 - Cyclobutadieneiron Tricarbonyl. Et Nytt Aromatisk System
D. Fitzpatrick, L. Watts, Gf Emerson, Og R. Pettit
Journal Of American Chemical Society 1965, 87 (14), 3254-3255
DOI: 10.1021 / ja01092a050
et bonusemne: cyclobutadien kan stabiliseres med metaller – det organometalliske komplekset cyclobutadien jern tricarbonyl er et stabilt, krystallinsk fast stoff. Som forfatterne nevner, er det usannsynlig at fri cyklobutadien genereres i syntesen. - https://www.asu.edu/courses/chm233/notes/aromatic/aromaticRL1/antiaromatic.html
den antipsykotiske olanzapin vedtar en» sommerfugl » form for å unngå antiaromatiske effekter, ligner på cyclooctatetraene. Dette er tilsynelatende kritisk for sin funksjon. - Antiaromaticity
Ronald Breslow
Kontoer Av Kjemisk Forskning 1973, 6 (12), 393-398
DOI: 1021 / ar50072a001
Interessant, Prof. Breslow (Columbia) sier i denne kontoen at han var den personen til å først foreslå begrepet «antiaromatic» for spesielt destabilisert sykliske forbindelser med 4n p elektroner. Han siterer også andre arbeider Av Professor Mjs Dewar og andre der antiaromatisk destabilisering av cyklobutadien beregnes å være mellom 18-33 kcal / mol i forhold til lineær butadien. - Eksperimentell Bestemmelse Av Antiaromaticity Av Cyclobutadien
Ashok A. Deniz, Kevin S. Peters, Gary J. Snyder
Vitenskap 1999, 286 (5442), 1119-1122
DOI: 1126/vitenskap.286.5442.1119
Dette er en svært streng papir som bruker nye spektroskopiske teknikker for å bestemme antiaromatisk destabilisering av cyklobutadien. I forhold til en hypotetisk stamme-mindre, konjugert dien referanse, er cyklobutadien destabilisert med totalt 87 kcal / mol, 32 kcal / mol som kan tilskrives ring stamme og 55 kcal/mol til antiaromaticity (sammenlignet med 21 kcal / mol for aromatisk stabilisering av benzen). - Unsubstituted cyclopentadienyl kation, a ground-state triplet
Saunders, R. Berger, A. Jaffe, J. M. McBride, J. O ‘ Neill, R. Breslow, J. M. Hoffmann, C. Perchonock, E. Wasserman, R. S. Hutton, V. J. Kuck
Journal of American Chemical Society 1973, 95 (9), 3017-3018
doi: 10.1021 / ja00790a049
cyclopentadienylkation kan bare fremstilles med vanskeligheter, som dette papiret beskriver. Når den er dannet, har den en triplett elektronisk grunntilstand (med 2 uparede elektroner), og kan karakteriseres AV EPR (elektronparamagnetisk resonans) spektroskopi. - Oxirenes
Errol G. Lewars
Kjemiske Anmeldelser 1983, 83 (5), 519-534
DOI: 10.1021 / cr00057a002