Periodiske trender og løsemiddeleffekter i nukleofilitet
det er forutsigbare periodiske trender i nukleofilitet. Flytte horisontalt over den andre raden av tabellen, trenden i nucleophilicity paralleller trenden i basicity:
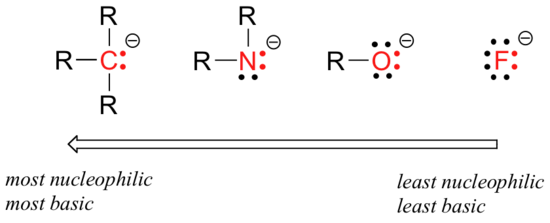
begrunnelsen bak den horisontale nucleophilicity trend er den samme som begrunnelsen bak basicity trend: flere elektronegative elementer holder sine elektroner tettere, og er mindre i stand til å donere dem for å danne et nytt bånd.
denne horisontale trenden forteller oss også at aminer er mer nukleofile enn alkoholer, selv om begge gruppene ofte fungerer som nukleofiler i både laboratorie – og biokjemiske reaksjoner.
Husk at basiciteten av atomer avtar når vi beveger oss vertikalt ned i en kolonne i det periodiske bordet: tiolationer er mindre basiske enn alkoksidioner, for eksempel, og bromidion er mindre basisk enn kloridion, som igjen er mindre basisk enn fluoridion. Husk også at denne trenden kan forklares ved å vurdere den økende størrelsen på elektronskyen rundt de større ionene: elektrontettheten som er iboende i den negative ladningen, er spredt rundt et større område, noe som har en tendens til å øke stabiliteten (og dermed redusere basiciteten).
den vertikale periodiske trenden for nukleofilitet er noe mer komplisert enn det for basicitet: avhengig av løsningsmidlet som reaksjonen finner sted i, nucleophilicity trenden kan gå i begge retninger. La oss ta det enkle eksemplet PÅ SN2-reaksjonen nedenfor:
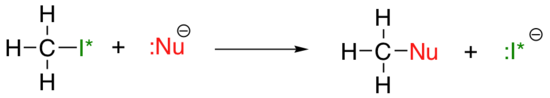
. . .hvor Nu – er en av halogenidioner: fluor, klorid, bromid eller jodid, og avgangsgruppen i* er en radioaktiv isotop av jod(som gjør at vi kan skille avgangsgruppen fra nukleofilen i det tilfellet hvor begge er jodid). Hvis denne reaksjonen forekommer i et protisk løsningsmiddel (det vil si et løsningsmiddel som har et hydrogen bundet til et oksygen – eller nitrogen-vann, metanol og etanol er de viktigste eksemplene), vil reaksjonen gå raskest når jodid er nukleofilen, og sakte når fluor er nukleofilen, noe som reflekterer den relative styrken til nukleofilen.

Relativ nukleofilitet i et protisk løsningsmiddel
dette er selvfølgelig motsatt av den vertikale periodiske trenden for basisitet, hvor jodid er minst grunnleggende. Hva er det som foregår her? Skal ikke den sterkere basen, med sine mer reaktive ubundne valenselektroner, også være den sterkere nukleofilen?
som nevnt ovenfor har alt å gjøre med løsningsmidlet. Husk at vi snakker nå om reaksjonen som kjører i et protisk løsningsmiddel som etanol. Protiske løsemiddelmolekyler danner meget sterke ion-dipol-interaksjoner med den negativt ladede nukleofilen, og skaper i hovedsak et løsemiddelbur rundt nukleofilen:

for at nukleofilen skal angripe elektrofilen, må den bryte fri, i det minste delvis, fra løsningsmiddelburet. De ensomme parelektronene på det større, mindre grunnleggende jodidionet samhandler mindre tett med protonene på de protiske løsningsmiddelmolekylene – dermed er jodidnukleofilen bedre i stand til å bryte seg fri fra løsningsmiddelburet sammenlignet med det mindre, mer grunnleggende fluoridionet, hvis ensomme parelektroner er bundet tettere til protonene i buret. bildet endres hvis vi bytter til et polar aprotisk løsningsmiddel, som aceton, der det er en molekylær dipol, men ingen hydrogen bundet til oksygen eller nitrogen. Nå er fluor den beste nukleofilen, og jodid den svakeste.
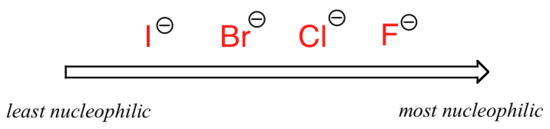
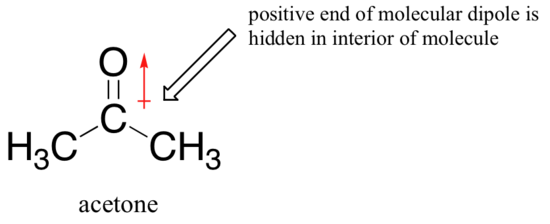
en svakere løsemiddel-nukleofil interaksjon betyr et svakere løsemiddelbur for nukleofilen å bryte gjennom, så løsemiddeleffekten er mye mindre viktig, og jo mer grunnleggende fluoridion er også den bedre nukleofilen.
hvorfor ikke bruke et helt ikke-polært løsningsmiddel, som heksan, for denne reaksjonen, slik at løsningsmiddelburet elimineres helt? Svaret på dette er enkelt – nukleofilen må være i oppløsning for å reagere med en merkbar hastighet med elektrofilen, og et løsningsmiddel som heksan vil ikke solvere en a-ladet (eller svært polar) nukleofil i det hele tatt. Derfor bruker kjemikere polare aprotiske løsningsmidler for nukleofile substitusjonsreaksjoner i laboratoriet: de er polare nok til å solvate nukleofilen, men ikke så polar som å låse den bort i et ugjennomtrengelig løsningsmiddelbur. I tillegg til aceton er tre andre vanlige polare aprotiske løsningsmidler acetonitril, dimetylformamid (DMF) og dimetylsulfoksid (DMSO).
i biologisk kjemi, hvor løsningsmidlet er protisk (vann), er den viktigste implikasjonen av periodiske trender i nukleofilitet at tioler er kraftigere nukleofiler enn alkoholer. Tiolgruppen i en cysteinaminosyre er for eksempel en kraftig nukleofil og virker ofte som en nukleofil i enzymatiske reaksjoner, og selvfølgelig negativt ladede tiolater (RS -) er enda mer nukleofile. Dette er ikke å si at hydroksylgruppene på serin, treonin og tyrosin ikke også virker som nukleofiler – de gjør det.