Mål
- Kjente Og ukjente løsninger av metallioner \(\ce{Ag^{+}}\), \(\ce{Fe^{3+}}\), \(\ce{Co^{2+}}\), \(\ce{Cu^{2+}}\) og \(\ce{Hg^{2+}}\) vil bli analysert ved hjelp av papirkromatografi.
- en ukjent løsning som inneholder noen av disse kationene vil bli identifisert ved sammenligning Med Rf-verdiene og fargene til de fargede flekkene av kjente løsninger.
de fleste kjemikere og mange andre forskere må rutinemessig skille blandinger og identifisere deres komponenter. Evnen til å kvalitativt identifisere stoffene som finnes i en prøve kan være kritisk. For eksempel vil en miljøkjemiker som undersøker prøver av forurenset grunnvann, ønske å vite hvilke giftige ioner som kan være tilstede i en prøve.
Kromatografi er et av de første verktøyene som brukes i slike situasjoner. I denne teknikken kan mange typer blandinger separeres i komponentets rene stoffer; ved sammenligning med en standardprøve kan hver komponentsubstans også identifiseres forsiktig.
mange varianter av kromatografi eksisterer, hver designet for å skille bestemte typer blandinger. Det vanlige ved hver type kromatografi er at en mobil fase (en væske eller gass) skyves gjennom en stasjonær fase (et fast stoff). Tabell 1 viser flere varianter av kromatografi og typiske identiteter av fasene. Papirkromatografi vil bli brukt i dette eksperimentet.
|
Type of Chromatography |
Mobile Phase |
Stationary Phase |
|---|---|---|
|
Gas (GC) |
inert gas (helium) |
waxy liquid or silicone inside narrow tubing |
|
Liquid |
solvent/solvent Mixture (organic or aqueous) |
solid packing (silica, alumina) |
|
Paper |
solvent/solvent Mixture (organic or aqueous) |
paper |
|
Thin-Layer (TLC) |
solvent/solvent Mixture (organic or aqueous) |
silica/alumina coated glass, plastic or metal |
eksemplet på kolonnekromatografi (Figur 1) demonstrerer de typiske funksjonene som finnes i denne analytiske teknikken. Diagrammet viser et eksperiment hvor en to-komponentblanding underkastes kolonnekromatografi. Kolonnen er pakket med et fast materiale kalt den stasjonære fasen. En flytende løsningsmiddel eller elueringsløsning helles i kolonnen og tetter det faste pakningsmaterialet helt. Deretter lastes blandingen på toppen av den våte kolonnen og mer eluent tilsettes. Gravity trekker mobilfasen ned gjennom den stasjonære fasen, og komponentene i blandingen begynner å bevege seg gjennom kolonnen med forskjellige hastigheter. I diagrammet beveger komponent a seg raskere enn komponent B; dermed blir komponent B beholdt på kolonnen i lengre tid enn komponent A. Vanligvis skyldes Dette en forskjell i løselighet av de to forbindelsene i løsningsmidlet og/eller til en forskjell i tiltrekning til det faste emballasjematerialet. Som mer eluent legges til toppen av kolonnen, vil komponentene til slutt gå ut av kolonnen separat. Tiden det tar å gå ut av kolonnen, kalt retensjonstid, vil være reproduserbar for hver komponent under de gitte angitte forholdene—mobil og stasjonær faseidentitet, temperatur og kolonnebredde. Når komponentene går ut av kolonnen, kan løsningsmidlet fjernes ved fordampning, og de rene komponentene kan analyseres eller identifiseres ytterligere.
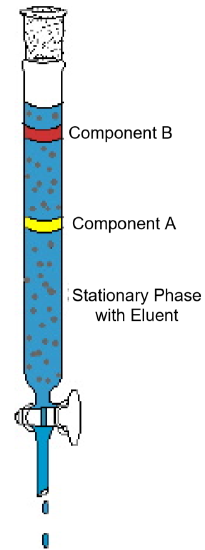
Figur 1: et typisk kolonnekromatografieksperiment demonstrerer separasjonen av en to-komponentblanding.Tentativ identifikasjon av komponentene kan oppnås ved å sammenligne den ukjente blandingen en nøye forberedt kjent blanding: hvis en kjent komponent har samme retensjonstid som en ukjent komponent under de samme forholdene, er det sannsynlig-men ikke avgjørende-at de to komponentene er de samme. Ytterligere analyser kan være nødvendig for å bekrefte denne hypotesen. Hvis det kjente og det ukjente har forskjellige oppbevaringstider, er det ikke sannsynlig at de to komponentene er identiske.
andre variasjoner av kromatografi bruker kapillærvirkning-tiltrengningen av en væske til en fast overflate – for å trekke et løsningsmiddel gjennom fast materiale. En uformell versjon av papirkromatografi kan observeres når en blekkskrevet side kommer i kontakt med vann eller andre væsker. Blekket går og flere farger er atskilt i blekk strek.
diagrammet nedenfor (Figur 2) viser resultatet av et tynnlagskromatografiforsøk. To svarte blekkflekker på den faste overflaten har hatt et løsemiddel passert gjennom dem. Løsningsmidlet er vann eller annen væske som trekkes gjennom den stasjonære fasen ved kapillærvirkning. I dette eksemplet brukes et stykke plast belagt med et pulverisert fast stoff som den stasjonære fasen. Alternativt kan et stykke filterpapir brukes som stasjonær fase. Forsøket viser at den svarte blekk er en blanding som inneholder flere forskjellige fargede stoffer. Hver komponent har en litt annen oppløselighet i mobilfasen, så når væsken trekkes gjennom den stasjonære fasen, beveger hver komponent seg med en annen hastighet, og separerer blekket i flekker av forskjellige farger.

Figur 2: Tynnlagskromatografi av svart blekk etter utvikling. Dette bildet viser et vanlig problem hvor flekkene utvides når de beveger seg opp platen, og til slutt smelter sammen på toppen av platen.
i dette eksperimentet brukes lignende prinsipper for å skille flere metallkationer ved hjelp av en papirkromatografiprosedyre. Metallioner-\(\ce{Ag^{+}}\), \(\ce{Fe^{3+}}\),\(\ce{Co^{2+}}\), \(\ce{Cu^{2+}}\), og \(\ce{Hg^{2+}}\) – har ulik oppløselighet i mobilfasen-vandig \(\ce{HCl}\) med etyl-og butylalkohol – og vil bevege seg med forskjellige hastigheter opp papiret. De forskjellige metallionoppløsningene skyldes sannsynligvis dannelsen av forskjellige forbindelser med kloridionet og deres varierende evne til å oppløse i det organiske løsningsmidlet.
et diagram som viser hvordan du klargjør papiret, er vist nedenfor. Standardløsninger som inneholder hver av disse ionene vil bli oppdaget på papiret ved hjelp av et kapillarrør, sammen med en standardløsning som inneholder alle fem ioner. En ukjent vil også bli oppdaget på papiret. Når papiret er forberedt, vil det bli utviklet ved å plassere papiret i eluenten. Etter 75-90 minutter visualiseres papiret ved å fukte det med en vandig løsning som inneholder kaliumjodid, \(\ce{KI}\) og kaliumferrocyanid, \(\ce{K4}\). Den unike fargen som observeres for hver ion, produseres ved en kjemisk reaksjon med visualiseringsløsningen. Dette er en nyttig måte å identifisere hvilke ioner som er tilstede i en ukjent blanding.
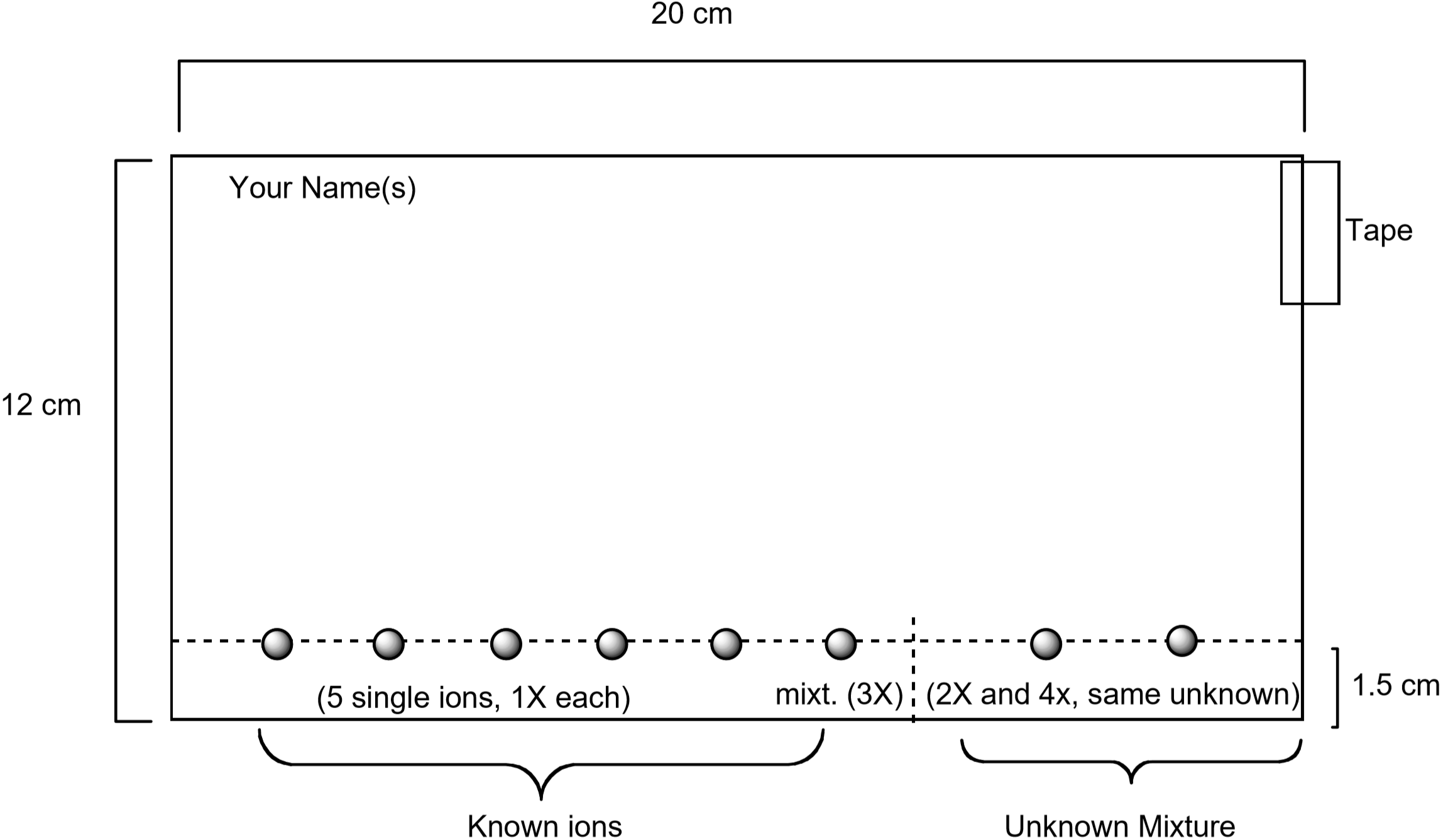
Figur 3: Diagram som viser hvordan du klargjør papiret for kromatografieksperimentet
avstanden ion beveger seg opp i papiret, kan også brukes til å identifisere ion. Men siden studentene skal utvikle sine kromatografiforsøk for forskjellige tidsmengder og under litt forskjellige forhold, vil hver student ha noe forskjellig målt avstand for en gitt ion. Forholdet mellom avstanden flyttet av en ion (\(D\)) til avstanden flyttet av løsningsmidlet (\(F\), løsemiddelfronten) er karakteristisk og bør være nesten det samme for alle studenter. Dette forholdet kalles Rf, eller «retensjonsfaktor.»
\
Prosedyre
Materialer og Utstyr
Kjemikalier: 0.1 M vandige løsninger av \(\ce{AgNO3}\), \(\ce{Hg(NO3)2}\), \(\ce{Fe(NO3)3}\), \(\ce{Co(NO3)2}\), og \(\ce{Cu(NO3)2}\), hver med dedikerte kapillærrør; elueringsløsning (vandig \(\ce{HCl}\) med etyl-og butylalkohol); visualiseringsløsning (vandig løsning av \(\ce{KI}\) og \(\ce{k4}\)).
Utstyr: Rent stykke kromatografipapir; engangs Latekshansker (nitrilhansker er vailable på lageret for personer med allergi Mot Latex); 600 mL beger; plastfolie; tang eller beger tang; linjal*
* Elementer hentet fra lager
Sikkerhet
Unngå kontakt med metallionløsninger, elueringsløsningen og visualiseringsløsningen. Bruk engangshansker for å berøre kromatogrammet etter elueringen og for resten av forsøket. Ikke pust inn dampene i elueringsløsningen eller visualiseringsløsningen. Legg det våte kromatogrammet på et papirhåndkle, ikke direkte på laboratoriebenken. Bruk kun visualiseringsløsningen i det rommet læreren din har gitt. Kast hanskene og kromatogrammet i den angitte avfallsbeholderen etter at forsøket er ferdig. Vask hendene grundig etter kontakt med alle løsninger i dette laboratoriet.
Forberedelse av papiret for kromatografi
- hvert par studenter skal få et stykke filterpapir med dimensjonene vist i Figur 3. Pass på at papiret er rent og uten tårer eller bretter. Bruk en blyant-ikke en penn – og en linjal for å tegne en linje over papiret en cm fra papirets lange kant. Du vil oppdage metallionløsninger på denne linjen. Skriv navnet ditt med blyant i øvre venstre hjørne av papiret.
- Øv på å spotte vann og / eller ioneløsninger på en stripe med filterpapir, slik at du vet hvordan du lager flekker av riktig størrelse. Bruk glasskapillarrør for å få øye på ioner på papiret. Løsningen påføres ved lett og raskt å berøre et kapillærrør som inneholder løsningen på linjen du trakk på papiret. Plettene skal være mellom 5-8 mm i diameter. Spots større enn dette vil overdrevet spre seg under forsøket og gjøre analysen vanskelig.
- Kjent 0.1 m vandige løsninger av \(\ce{AgNO3}\), \(\ce{Hg (NO3) 2}\), \(\ce{Fe (NO3)3}\), \(\ce{Co (NO3)2}\) og \(\ce{Cu (NO3)2}\) er gitt i reagensrør, som hver inneholder to eller tre kapillærrør. Start til venstre, merk identiteten til ion under hvert sted med en blyant; deretter spot hver kjente ion nøye på linjen. Vær forsiktig for å unngå å forurense kapillærrøret med andre ioner og sett kapillærrørene tilbake i riktig reagensrør. Et reagensrør som inneholder en kjent blanding av alle fem ioner, er også utstyrt med et sett kapillærrør. Spot denne blandingen på linjen også. Fordi denne løsningen er mer fortynnet enn de single-ion kjente løsningene, bruk den kjente blandingen tre ganger, la flekken tørke mellom hver applikasjon. En varmelampe vil bidra til å tørke stedet raskere.
- Flere ukjente er også gitt i reagensrør, sammen med kapillærrør. Din instruktør vil fortelle deg hvilken ukjent skal brukes. De ukjente vil inneholde mellom ett og fire kationer, og er mer fortynnede enn de enkelt-ion kjente løsningene. Det ukjente må også påføres to og fire ganger for de to forsøkene, slik at stedet tørker mellom hver applikasjon. I tilfelle feil, bør du oppdage det ukjente på to steder langs linjen slik at to forsøk er tilgjengelige for analyse.
Utvikle kromatografipapiret
- Legg et stykke tape langs øvre høyre kant, som vist i Figur 3. Deretter danner en sylinder ved å koble de to korte kantene av papiret med båndet. Pass på at kantene ikke berører. Papiret skal se ut Som Figur 4.
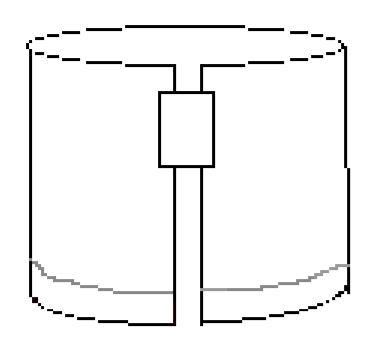
Figur 4: Brettet papir skal se slik ut før eksperimentet utvikles.
- Hent 15 mL av elueringsoppløsningen. Hell forsiktig noe av dette løsningsmidlet i et 600 mL beger og virvle forsiktig i et sekund eller to. Forsiktig: ikke pust inn dampene fra denne løsningen! Kontroller at væskenivået vil være under spotlinjen på papiret når papiret er plassert i utviklingskammeret.
- Plasser papirsylinderen i begeret med den merkede kanten ned. Plettene skal være over nivået av løsningsmidlet. Papiret skal ikke berøre sidene av begeret. Dekk forsiktig begeret med plastfolie og legg det i hetten i 75-90 minutter. Løsningsmidlet bør begynne å bevege seg opp i papiret. Når begeret er dekket, sørg for at det er nivå og ikke forstyrr det i utviklingsperioden. Din instruktør kan ha en oppgave for deg å jobbe med mens du venter.
Visualisering og analyse av papiret
- når utviklingsperioden er over, bruk engangshansker og fjern papiret fra begeret. Latekshansker er tilgjengelig i laboratoriet og nitrilhansker er tilgjengelig på lageret for personer med Latexallergi. La løsningsmidlet dryppe tilbake i begeret, og fjern deretter tapen. Legg kromatografipapiret på et papirhåndkle og merk umiddelbart løsemiddelfronten med en blyant. Hell det brukte elueringsløsningsmidlet i avfallsbeholderen som følger med. Tørk papiret under en varmelampe i hetten. Forsiktig: Ikke pust inn dampene! Pass på at du ikke brenner papiret under lampen.
- når papiret er tørt, ta det med til visualiseringsstasjonen på papirhåndkleet. Dyp papiret kort inn i visualiseringsløsningen som ligger i en grunne tallerken i avtrekksdekselet. Løft papiret ut av løsningen umiddelbart og la overflødig drypp av på stasjonen. Legg det våte papiret på et tørt papirhåndkle og tørk det under en varmelampe umiddelbart, og bær det deretter til benken for analyse.
- Finn hver kjente single-ion først og ta opp fargene du observerer. Noen flekker kan falme over tid, så ta opp fargene mens papiret fortsatt er vått. Mål avstanden hvert sted flyttet, D, med en linjal. Mål til midten av hvert sted. Ta opp dataene dine i datatabellen.
- Mål avstanden til løsemiddelfronten, F. verdien Av F skal være omtrent den samme over hele papiret. Bruk disse verdiene til å beregne Rf for hver ion. Gjør dine mål som vist i Figur 5. Hvert observert sted har sin Egen Rf-verdi. Ta opp resultatene dine i datatabellen.
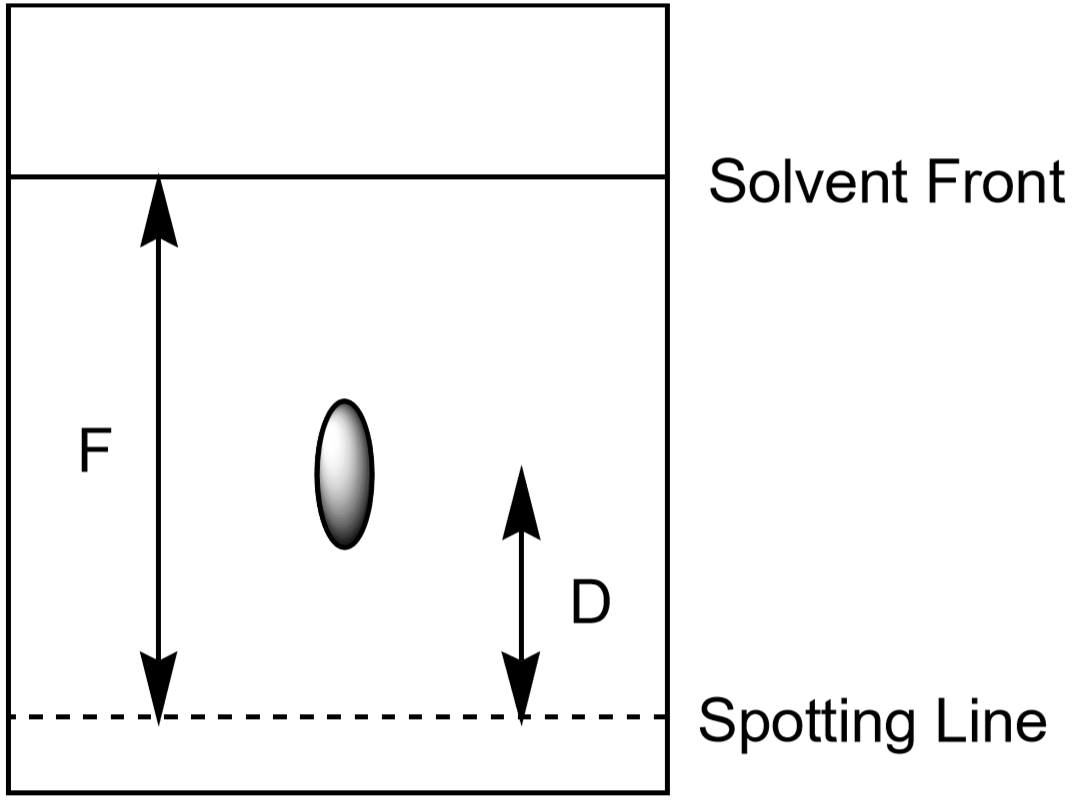
Figur 5: Måling av avstander som brukes i beregningen Av Rf for et sted.
- i banen som inneholder blandingen, finn hver ion og registrer avstanden flyttet av hver ion. Beregn Rf for hver ion i denne banen. Verdiene bør nøye samsvare med de som er observert i single-ion knowns.
- i kjørefeltet som inneholder de ukjente, finn midten av hvert punkt observert og registrer avstanden og beregne Rf-verdiene. Bruk kjørefelt som har de klareste stedene. Farge-Og Rf-verdiene for de ukjente stedene bør nøye matche noen av de kjente ioner. Du skal nå kunne identifisere hvilke ion eller ioner som finnes i ditt ukjente. Ta opp dataene dine i den tilsvarende tabellen.
- Lag en skisse av kromatogrammet ditt i feltet som er oppgitt på laboratorierapportskjemaet, og sørg for å angi posisjon og omtrentlig størrelse og form på hvert sted på papiret. Kast papiret i den angitte avfallsbeholderen.
Cleanup
Legg kromatografipapiret og de brukte hanskene i avfallsbeholderen som følger med. Den brukte elueringsløsningen skal allerede ha blitt plassert i en annen avfallsbeholder. Merk at to forskjellige avfallsbeholdere sørger for dette eksperimentet, så sørg for å lese etikettene slik at du bruker den riktige! Pass på å vaske hendene grundig før du forlater laboratoriet.
pre-laboratorieoppgave: Papirkromatografi
- en to-komponentblanding analyseres ved papirkromatografi. Komponent A er mer løselig i mobilfasen enn komponent B. følgende resultat oppnås. Beregn Rf for hver komponent og merk identiteten til hvert sted.
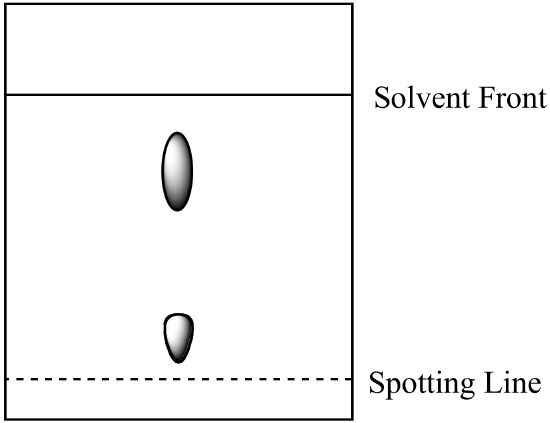
- blandingen fra spørsmål 1 (ovenfor) analyseres ved kolonnekromatografi ved bruk av samme mobilfase og en stasjonær silikagelfase. Hvilken komponent har kortere retensjonstid? Forklar svaret ditt. (Anta at samme type bindingskrefter mellom komponentene og den stasjonære fasen er tilstede i både papirkromatografi og kolonnekromatografi.)
- en ukjent væskeprøve analyseres ved bruk av papirkromatografi ved bruk av løsemiddel X som mobilfase. Ett sted observeres etter at platen er utviklet og visualisert. Det samme ukjente stoffet analyseres på nytt ved hjelp Av løsningsmiddel Y som mobilfasen. Denne gangen observeres tre flekker etter at platen er utviklet og visualisert.
- er den ukjente prøven en ren substans eller en blanding? Forklar svaret ditt, inkludert en mulig årsak til de forskjellige observasjonene i de to forsøkene.
Lab Report for Paper Chromatography
Data, Observations, Calculations and Analysis Known Ions
Known Ions
|
Ion |
Spot Color (Stained) |
D (Single- Ion) |
F (Single- Ion) |
Rf |
D (Ion Mixt.) |
F (Ion Mixt.) |
Rf |
|---|---|---|---|---|---|---|---|
|
\(\ce{Ag^{+}}\) |
|||||||
|
\(\ce{Co^{2+}}\) |
|||||||
|
\(\ce{Cu^{2+}}\) |
|||||||
|
\(\ce{Fe^{3+}}\) |
|||||||
|
\(\ce{Hg^{2+}}\) |
Unknown ID Code _________________
Unknowns
|
Spot Number (from lowest Rr) |
Spot Color (Stained) |
D (Unknown) |
F (Unknown) |
Rf |
Identity of Spot |
|---|---|---|---|---|---|
- Sketch of Chromatogram:
Summary:
| Ioner Identifisert |
|---|
spørsmål og konklusjoner
- hvilke kriterier ble brukt til å identifisere ion(ene) funnet i ditt ukjente? Forklar svaret ditt i minst tre setninger. Inkluder eventuelle problemer med å identifisere noen ioner.
- hvis du lar eksperimentet kjøre i bare 30 minutter, hva ville være det sannsynlige resultatet? Vil det oppstå problemer ved identifisering av det ukjente?
- Hvis \(\ce{Co^{2+}}\) og \(\ce{Cu^{2+}}\) flekker var samme farge, ville identifikasjonen av en ukjent være vanskeligere? Forklar svaret ditt.