Video \(\PageIndex{1}\): en kort introduksjon Til geni Av Mendeleev.
da tidlige kjemikere jobbet for å rense malmer og oppdaget flere elementer, innså de at ulike elementer kunne grupperes sammen av deres lignende kjemiske oppførsel. En slik gruppering inkluderer litium (Li), natrium (Na) og kalium (K): Disse elementene er alle skinnende, leder varme og elektrisitet godt, og har lignende kjemiske egenskaper. En annen gruppering inkluderer kalsium (Ca), strontium (Sr) og barium (Ba), som også er skinnende, gode ledere av varme og elektrisitet, og har kjemiske egenskaper til felles. Imidlertid er de spesifikke egenskapene til disse to grupperingene spesielt forskjellige fra hverandre. For Eksempel: Li, Na Og K er mye mer reaktive enn Ca, Sr Og Ba; Li, Na og K danner forbindelser med oksygen i et forhold på to av deres atomer til ett oksygenatom, Mens Ca, Sr og Ba danner forbindelser med et av deres atomer til ett oksygenatom. Fluor (F), klor (Cl), brom (Br) og jod (i) har også lignende egenskaper til hverandre, men disse egenskapene er drastisk forskjellige fra noen av elementene ovenfor.
Dimitri Mendeleev I Russland (1869) Og Lothar Meyer I Tyskland (1870) anerkjente uavhengig at det var et periodisk forhold mellom egenskapene til elementene som var kjent på den tiden. Begge publiserte tabeller med elementene arrangert i henhold til økende atommasse. Men Mendeleev gikk et skritt lenger Enn Meyer: han brukte sitt bord til å forutsi eksistensen av elementer som ville ha egenskaper som aluminium og silisium, men var ennå ukjente. Oppdagelsene av gallium (1875) og germanium (1886) ga stor støtte Til Mendeleevs arbeid. Selv Om Mendelejev og Meyer hadde en lang strid om prioritet, Mendelejevs bidrag til utviklingen av det periodiske system er nå mer anerkjent (Figur \ (\PageIndex{1}\)).
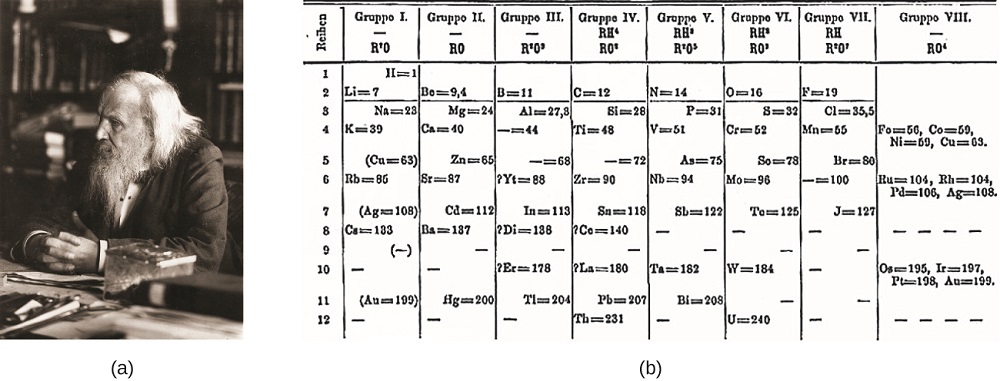
Figur \(\PageIndex{1}\): (A) Dimitri Mendelejev er viden kreditert med å skape (b) den første periodiske tabell over elementene. (kreditt a: modifikasjon av arbeid Av Serge Lachinov; kreditt b: modifikasjon av arbeid av «den fjä ankan»/Wikimedia Commons)
Video \(\PageIndex{2}\): en introduksjon til organiseringen av det periodiske system i perioder og grupper. Denne organisasjonen vil være viktig når vi fortsetter å bygge på prinsippene om kjemi.
ved det tjuende århundre ble det klart at det periodiske forholdet involverte atomnummer i stedet for atommasser. Den moderne uttalelsen av dette forholdet, den periodiske loven, er som følger: egenskapene til elementene er periodiske funksjoner av deres atomnummer. Et moderne periodisk bord arrangerer elementene i økende rekkefølge av deres atomnummer og grupper atomer med lignende egenskaper i samme vertikale kolonne(Figur \(\PageIndex{2}\)). Hver boks representerer et element og inneholder atomnummer, symbol, gjennomsnittlig atommasse og (noen ganger) navn. Elementene er ordnet i syv horisontale rader, kalt perioder eller serier, og 18 vertikale kolonner, kalt grupper. Grupper er merket øverst i hver kolonne. I Usa var etikettene tradisjonelt tall med store bokstaver. IUPAC anbefaler imidlertid at tallene 1 til 18 brukes, og disse etikettene er vanligere. For at tabellen skal passe på en enkelt side, skrives deler av to av radene, totalt 14 kolonner, vanligvis under hoveddelen av tabellen.

Figur \(\PageIndex{2}\): Elementer i periodisk tabell er organisert i henhold til deres egenskaper.
Mange elementer varierer dramatisk i deres kjemiske og fysiske egenskaper, men noen elementer er like i deres oppførsel. For eksempel virker mange elementer skinnende, er formbare (kan deformeres uten å bryte) og duktile (kan trekkes inn i ledninger), og leder varme og elektrisitet godt. Andre elementer er ikke skinnende, formbare eller duktile, og er dårlige ledere av varme og elektrisitet. Vi kan sortere elementene i store klasser med felles egenskaper: metaller (elementer som er skinnende, formbare, gode ledere av varme og elektrisitet—skyggelagt gul); nonmetals (elementer som virker kjedelige, dårlige ledere av varme og elektrisitet-skyggelagt grønt); og metalloider (elementer som leder varme og elektrisitet moderat godt, og har noen egenskaper av metaller og noen egenskaper av ikke-metaller-skyggelagt lilla).
elementene kan også klassifiseres i hovedgruppeelementene (eller representative elementer) i kolonnene merket 1, 2 og 13-18; overgangsmetallene i kolonnene merket 3-12; og indre overgangsmetaller i de to radene nederst i tabellen(de øverste radelementene kalles lantanider og de nederste radelementene er aktinider; Figur \(\PageIndex{3}\)). Elementene kan deles videre av mer spesifikke egenskaper, slik som sammensetningen av forbindelsene de danner. For eksempel danner elementene i gruppe 1 (den første kolonnen) forbindelser som består av ett atom av elementet og ett atom av hydrogen. Disse elementene (unntatt hydrogen) er kjent som alkalimetaller, og de har alle lignende kjemiske egenskaper. Elementene i gruppe 2 (den andre kolonnen) danner forbindelser som består av ett atom av elementet og to atomer av hydrogen: disse kalles jordalkalimetaller, med lignende egenskaper blant medlemmer av den gruppen. Andre grupper med spesifikke navn er pniktogener (gruppe 15), chalcogener (gruppe 16), halogener (gruppe 17) og edelgassene (gruppe 18, også kjent som inerte gasser). Gruppene kan også henvises til av det første elementet i gruppen: for eksempel kan chalcogenene kalles oksygengruppen eller oksygenfamilien. Hydrogen er et unikt, ikke-metallisk element med egenskaper som ligner både gruppe 1 og gruppe 17 elementer. Av den grunn kan hydrogen vises øverst i begge grupper, eller av seg selv.
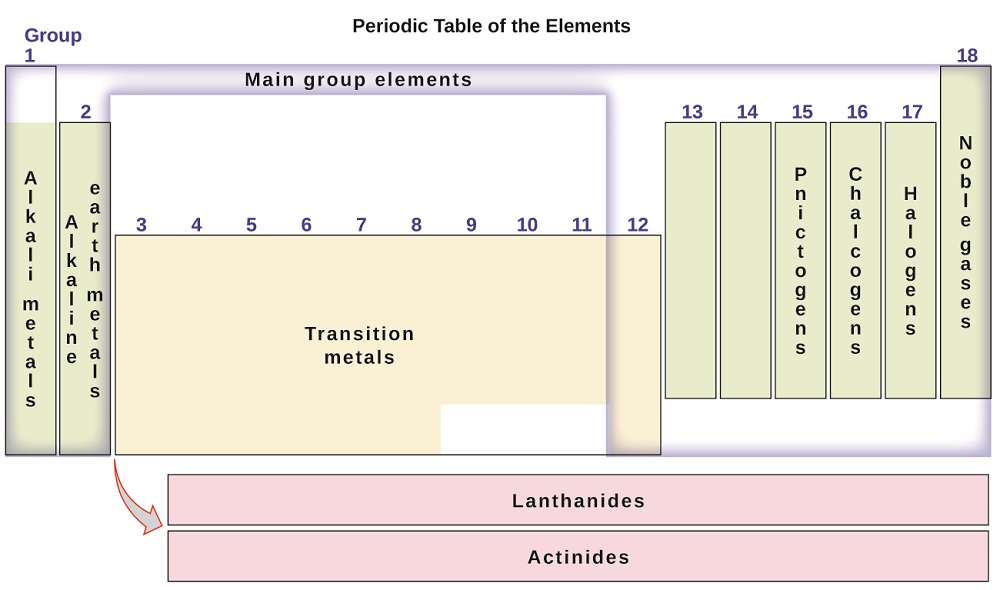
Figur \(\PageIndex{3}\): det periodiske tabellen organiserer elementer med lignende egenskaper i grupper.
Eksempel \(\PageIndex{1}\): Navngi Grupper Av Elementer
Atomer av hvert av følgende elementer er avgjørende for livet. Gi gruppenavnet for følgende elementer:
- chlorine
- calcium
- sodium
- sulfur
Solution
The family names are as follows:
- halogen
- alkaline earth metal
- alkali metal
- chalcogen
Exercise \(\PageIndex{1}\)
Give the group name for each of the following elements:
- krypton
- selen
- barium
- litium
svar a
edelgass
svar b
jordalkalimetall
svar d
alkalimetall
når du studerer det periodiske bordet, har du kanskje lagt merke til noe om atommassene til noen av elementene. Element 43 (technetium), element 61 (promethium), og de fleste av elementene med atomnummer 84 (polonium) og høyere har sin atommasse gitt i hakeparenteser. Dette er gjort for elementer som består helt av ustabile, radioaktive isotoper(du vil lære mer om radioaktivitet i kjernekjemi kapittel). En gjennomsnittlig atomvekt kan ikke bestemmes for disse elementene fordi deres radioisotoper kan variere betydelig i relativ overflod, avhengig av kilden, eller kanskje ikke engang eksisterer i naturen. Tallet i firkantede parenteser er atommassenummeret (og omtrentlig atommasse) av den mest stabile isotopen av det elementet.
Sammendrag
Video \(\PageIndex{3}\): et sammendrag av oppdagelsen og egenskapene til det periodiske tabellen.
oppdagelsen av periodisk gjentakelse av lignende egenskaper blant elementene førte til formuleringen av det periodiske bordet, hvor elementene er ordnet i rekkefølge av økende atomnummer i rader kjent som perioder og kolonner kjent som grupper. Elementer i samme gruppe i periodisk tabell har lignende kjemiske egenskaper. Elementer kan klassifiseres som metaller, metalloider og ikke-metaller, eller som hovedgruppeelementer, overgangsmetaller og indre overgangsmetaller. Gruppene er nummerert 1-18 fra venstre til høyre. Elementene i gruppe 1 er kjent som alkalimetaller; de i gruppe 2 er jordalkalimetaller; de i 15 er pniktogener; de i 16 er chalcogener; de i 17 er halogener; og de i 18 er edle gasser.