Læringsmål
ved slutten av denne delen vil du Kunne:
- Forklare forholdet mellom mikroskopiske og makroskopiske mengder i en gass
- Løse problemer som involverer blandinger av gasser
- Løse problemer som involverer avstanden og tiden mellom et gassmolekyls kollisjoner
/li>
Vi Har Undersøkt Trykk og temperatur basert på deres makroskopiske Definisjoner. Trykk er kraften dividert med området som kraften utøves på, og temperaturen måles med et termometer. Vi kan få en bedre forståelse av trykk og temperatur fra den kinetiske teorien om gasser, teorien som relaterer gassens makroskopiske egenskaper til bevegelsen av molekylene de består av. Først gjør vi to forutsetninger om molekyler i en ideell gass.
- Det er et veldig stort antall n molekyler, alle identiske og hver har masse m.
- molekylene adlyder Newtons lover og er i kontinuerlig bevegelse, som er tilfeldig og isotrop, det vil si det samme i alle retninger.For å utlede den ideelle gassloven og sammenhengen mellom mikroskopiske mengder som energien til et typisk molekyl og makroskopiske mengder som temperatur, analyserer vi en prøve av en ideell gass i en stiv beholder, som vi gjør to ytterligere antagelser om:
- molekylene er mye mindre enn gjennomsnittsavstanden mellom dem, så deres totale volum er mye mindre enn beholderens (som har volum V). Med Andre ord tar Vi van Der Waals konstant b, volumet av en mol gassmolekyler, for å være ubetydelig i forhold til volumet av en mol gass i beholderen.
- molekylene gjør perfekt elastiske kollisjoner med beholderens vegger og med hverandre. Andre krefter på Dem, inkludert tyngdekraften og attraksjonene representert Av van Der Waals konstant a, er ubetydelige (som er nødvendig for antagelsen om isotropi).kollisjonene mellom molekyler vises ikke i avledningen av den ideelle gassloven. De forstyrrer heller ikke avledningen, siden kollisjoner mellom molekyler som beveger seg med tilfeldige hastigheter, gir nye tilfeldige hastigheter. Videre, hvis hastighetene til gassmolekyler i en beholder i utgangspunktet ikke er tilfeldige og isotrope, er molekylære kollisjoner det som gjør dem tilfeldige og isotrope.
vi gjør ytterligere antagelser som forenkler beregningene, men som ikke påvirker resultatet. Først lar vi beholderen være en rektangulær boks. For det andre begynner vi med å vurdere monatomiske gasser, de hvis molekyler består av enkeltatomer, som helium. Da kan vi anta at atomene ikke har noen energi bortsett fra deres translasjonelle kinetiske energi; for eksempel har de verken rotasjons-eller vibrasjonsenergi. (Senere diskuterer vi gyldigheten av denne antagelsen for ekte monatomiske gasser og dispenserer med det for å vurdere diatomiske og polyatomiske gasser.Figur \(\PageIndex{1}\) viser en kollisjon av et gassmolekyl med veggen av en beholder, slik at Den utøver en kraft på veggen (Ved Newtons tredje lov). Disse kollisjonene er kilden til trykk i en gass. Etter hvert som antall molekyler øker, øker antall kollisjoner, og dermed trykket. På samme måte, hvis gjennomsnittshastigheten til molekylene er høyere, er gasstrykket høyere.
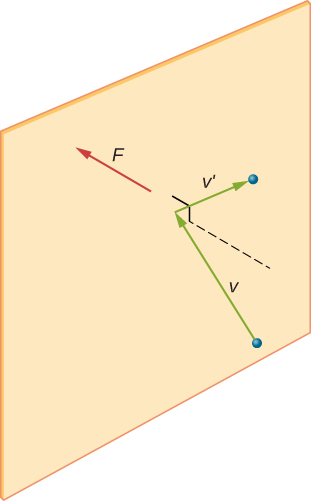
Figur \(\PageIndex{1}\): når et molekyl kolliderer med en stiv vegg, blir komponenten av dens momentum vinkelrett på veggen reversert. En kraft utøves således på veggen, noe som skaper trykk. i en prøve av gass i en beholder forårsaker tilfeldigheten av molekylbevegelsen at antall kollisjoner av molekyler med hvilken som helst del av veggen i en gitt tid svinger. Men fordi et stort antall molekyler kolliderer med veggen på kort tid, varierer antall kollisjoner på skalaen av tid og rom vi måler med bare en liten, vanligvis uobserverbar brøkdel fra gjennomsnittet. Vi kan sammenligne denne situasjonen med et kasino, hvor resultatene av spillene er tilfeldige og kasinoets takings svinger i minuttet og timen. Men over lange tider som et år er kasinoets takings svært nær gjennomsnittet som forventes fra oddsen. En tank med gass har enormt flere molekyler enn et kasino har bettors i et ar, og molekylene gjor enormt flere kollisjoner i et sekund enn et kasino har spill.en beregning av den gjennomsnittlige kraften som utøves av molekyler på boksens vegger fører oss til den ideelle gassloven og til forbindelsen mellom temperatur og molekylær kinetisk energi. (Faktisk vil vi ta to gjennomsnitt: en over tid for å få den gjennomsnittlige kraften som utøves av ett molekyl med en gitt hastighet, og deretter et annet gjennomsnitt over molekyler med forskjellige hastigheter.) Denne tilnærmingen ble utviklet Av Daniel Bernoulli (1700-1782), som er best kjent i fysikk for sitt arbeid med væskestrøm (hydrodynamikk). Bemerkelsesverdig, Bernoulli gjorde dette arbeidet før Dalton etablert syn på saken som består av atomer.
Figur \(\PageIndex{2}\) viser en beholder full av gass og en utvidet visning av en elastisk kollisjon av et gassmolekyl med en vegg av beholderen, brutt ned i komponenter. Vi har antatt at et molekyl er lite sammenlignet med separasjon av molekyler i gassen, og at samspillet med andre molekyler kan ignoreres. Under disse forholdene er den ideelle gassloven eksperimentelt gyldig. Fordi vi også har antatt at veggen er stiv og partiklene er poeng, er kollisjonen elastisk (ved bevaring av energi—det er ingen steder for en partikkels kinetiske energi å gå). Derfor forblir molekylets kinetiske energi konstant, og dermed forblir dens hastighet og størrelsen på dens momentum også konstant. Denne antakelsen er ikke alltid gyldig, men resultatene i resten av denne modulen er også oppnådd i modeller som lar molekylene utveksle energi og momentum med veggen.
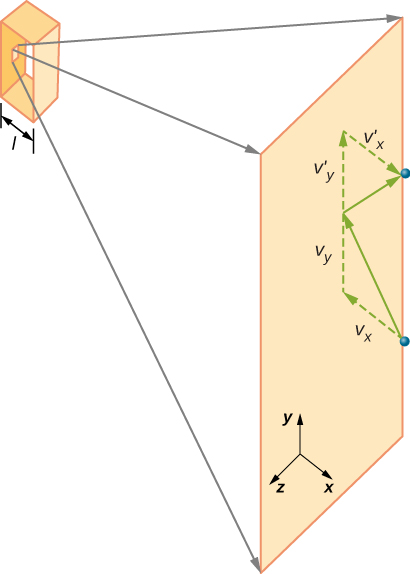
Figur \(\PageIndex{2}\): Gass i en boks utøver et ytre trykk på veggene. Et molekyl som kolliderer med en stiv vegg har sin hastighet og momentum i x-retningen reversert. Denne retningen er vinkelrett på veggen. Komponentene i hastighetsmomentet i y-og z-retningene endres ikke, noe som betyr at det ikke er noen kraft parallelt med veggen. hvis molekylets hastighet endres i x-retningen, endres dens momentum fra \(- m_x\) til \(+mv_x\). Dermed er endringen i momentum \(\Delta mv = + mv_x – (- mv_x) = 2mv_x\). I henhold til impuls-momentum-teoremet gitt i kapitlet om lineær momentum og kollisjoner, er kraften som utøves på ith-molekylet, hvor jeg merker molekylene fra 1 Til N, gitt ved \
(i denne ligningen alene representerer p momentum, ikke trykk.) Det er ingen kraft mellom veggen og molekylet unntatt mens molekylet berører veggen. I løpet av kollisjonens korte tid er kraften mellom molekylet og veggen relativt stor, men det er ikke den kraften vi leter etter. Vi ser etter gjennomsnittlig kraft, så vi tar \(\Delta t\) for å være gjennomsnittlig tid mellom kollisjoner av det gitte molekylet med denne veggen, som er tiden vi forventer å finne en kollisjon. La l representere lengden på boksen i x-retningen. Da er \(\Delta t\ ) tiden molekylet ville ta for å gå over boksen og tilbake, en avstand 2l, med en hastighet på \(v_x\). Dermed \(\delta t = 2l / v_x\), og uttrykket for kraften blir
\
denne kraften skyldes ett molekyl. For å finne den totale kraften På veggen, F, må vi legge til bidragene fra Alle n-molekyler:Vi bruker nå definisjonen av gjennomsnittet, som vi betegner med en bar, for å finne kraften:
\
Vi vil ha kraften i form av hastigheten v, i stedet for x-komponenten av hastigheten. Merk at den totale hastigheten kvadrert er summen av kvadratene av komponentene, slik at
\
med antagelsen om isotropi, er de tre gjennomsnittene på høyre side like, så
\
Erstatte dette i uttrykket for F gir
\
Trykket Er F/A, så vi får
\ hvor vi brukte \(V = Al\) for volumet. Dette gir det viktige resultatet
\
Kombinere denne ligningen med \(pV = Nk_BT\) gir
\
Vi kan få den gjennomsnittlige kinetiske energien til et molekyl, \(\frac{1}{2}m\overline{v}^2\), fra venstre side av ligningen ved å dele Ut N Og multiplisere med 3/2.den gjennomsnittlige kinetiske energien til et molekyl er direkte proporsjonal med dens absolutte temperatur:
ligningen\(\overline{K} = \frac{3}{2} k_BT\) er den gjennomsnittlige kinetiske energien per molekyl. Legg spesielt merke til at ingenting i denne ligningen avhenger av molekylmassen (eller annen egenskap) av gassen, trykket eller noe annet enn temperaturen. Hvis prøver av helium og xenongass, med svært forskjellige molekylmasser, har samme temperatur, har molekylene samme gjennomsnittlige kinetiske energi.den indre energien til et termodynamisk system er summen av de mekaniske energiene til alle molekylene i det. Vi kan nå gi en ligning for den indre energien til en monatomisk ideell gass. I en slik gass er molekylenes eneste energi deres translasjonelle kinetiske energi. Derfor betegner vi den interne energien ved \(E_{int}\) vi bare har \(E_{int} = N\overline{K}\), eller
\
ofte vil Vi gjerne bruke denne ligningen når det gjelder mol:
\
Vi kan løse \(\overline{K} = \frac{1}{2}m\overline{v}^2 = \frac{3}{2}k_BT\) for en typisk hastighet av et molekyl I En Ideell Gass i form av temperatur for å bestemme hva som er kjent som Rot-middel-kvadrat (rms) hastighet av et molekyl.rms-hastigheten til Et molekyl, eller kvadratroten av gjennomsnittet av kvadratet av hastigheten \(\overline{v}^2\), er
rms-hastigheten er ikke gjennomsnittet eller den mest sannsynlige hastigheten til molekyler, som vi vil se I Fordeling Av Molekylhastigheter, men det gir et lett beregnet estimat av molekylernes hastighet som er relatert til deres kinetiske energi. Igjen kan vi skrive denne ligningen i form av gasskonstanten R Og molarmassen M i kg / mol:Vi går bort et øyeblikk for å svare på et spørsmål som kan ha skjedd for deg: når vi bruker modellen til atomer i stedet for teoretiske punktpartikler, endrer rotasjons kinetisk energi resultatene våre? For å svare på dette spørsmålet må vi appellere til kvantemekanikk. I kvantemekanikk kan rotasjonskinetisk energi ikke ta på seg noen verdi; den er begrenset til et diskret sett med verdier, og den minste verdien er omvendt proporsjonal med rotasjons treghet. Rotasjons treghet av et atom er liten fordi nesten all sin masse er i kjernen, som vanligvis har en radius mindre enn \(10^{-14} m\). Dermed er den minste rotasjonsenergien til et atom mye mer enn \(\frac{1}{2}k_BT\) for enhver oppnåelig temperatur, og den tilgjengelige energien er ikke nok til å få et atom til å rotere. Vi kommer tilbake til dette punktet når vi diskuterer diatomiske og polyatomiske gasser i neste avsnitt.
Eksempel \(\PageIndex{1}\): Beregning Av Kinetisk Energi og Hastighet for Et Gassmolekyl
- Hva er gjennomsnittlig kinetisk energi for et gassmolekyl ved \(20,0^oC\) (romtemperatur)?
- Finn rms-hastigheten til et nitrogenmolekyl (\(N_2\)) ved denne temperaturen.
Strategi
(a) den kjente i ligningen for gjennomsnittlig kinetisk energi er temperaturen:
\
Før vi erstatter verdier i denne ligningen, må vi konvertere den oppgitte temperaturen til kelvin: \(T = (20,0 + 273) \, K = 293 \, K\). Vi kan finne rms-hastigheten til et nitrogenmolekyl ved å bruke ligningen
\
men vi må først finne massen av et nitrogenmolekyl. Ved å skaffe molarmassen av nitrogen \(N_2\) fra det periodiske bordet finner vi
\
Løsning
- temperaturen alene er tilstrekkelig for oss å finne den gjennomsnittlige translasjonelle kinetiske energien. Ved å erstatte temperaturen i den translasjonelle kinetiske energiligningen Gir \
- Å Erstatte denne massen og verdien for \(k_B\) i ligningen for\ (v_{rms}\) utbytter \
Betydning
Merk at molekylets gjennomsnittlige kinetiske energi er uavhengig av molekylets type. Den gjennomsnittlige translasjonelle kinetiske energien avhenger bare av absolutt temperatur. Den kinetiske energien er svært liten sammenlignet med makroskopiske energier, slik at vi ikke føler når et luftmolekyl rammer huden vår. På den annen side er det mye større enn den typiske forskjellen i gravitasjonspotensiell energi når et molekyl beveger seg fra toppen til bunnen av et rom, så vår forsømmelse av gravitasjon er berettiget i typiske virkelige situasjoner. Rms-hastigheten til nitrogenmolekylet er overraskende stor. Disse store molekylhastighetene gir ikke makroskopisk bevegelse av luft, siden molekylene beveger seg i alle retninger med like sannsynlighet. Den gjennomsnittlige frie banen (avstanden et molekyl beveger seg i gjennomsnitt mellom kollisjoner, diskutert litt senere i denne delen) av molekyler i luft er svært liten, så molekylene beveger seg raskt, men kommer ikke veldig langt om et sekund. Den høye verdien for rms-hastighet reflekteres i lydens hastighet, som er ca 340 m / s ved romtemperatur. Jo høyere rms-hastigheten til luftmolekyler, desto raskere lydvibrasjoner kan overføres gjennom luften. Lydens hastighet øker med temperatur og er større i gasser med små molekylære masser ,som helium(Se Figur \(\PageIndex{3}\)).
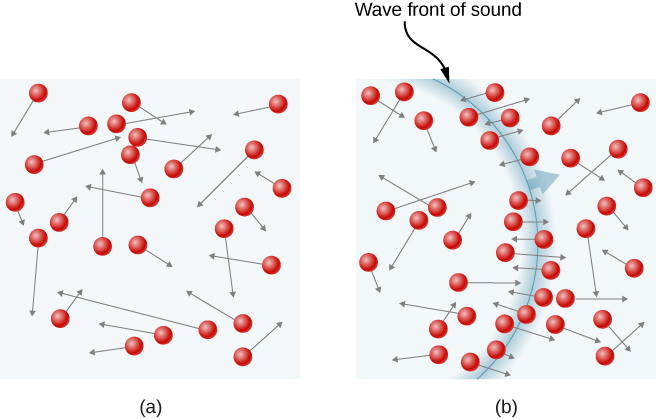
Figur \(\PageIndex{3}\): i en vanlig gass beveger så mange molekyler seg så fort at de kolliderer milliarder ganger hvert sekund. (B) Individuelle molekyler beveger seg ikke veldig langt på kort tid, men forstyrrelser som lydbølger overføres ved hastigheter relatert til molekylhastighetene. Eksempel \(\PageIndex{2}\): Beregning Av Temperatur: Flukthastighet Av Heliumatomer
for å unnslippe jordens tyngdekraft må et objekt nær toppen av atmosfæren (i en høyde på 100 km) reise vekk Fra Jorden ved 11,1 km / s. denne hastigheten kalles flukthastigheten. Ved hvilken temperatur vil heliumatomer ha en rms-hastighet lik flukthastigheten?
Strategi
Identifiser knowns og ukjente og avgjøre hvilke ligninger som skal brukes til å løse problemet.
Løsning
- Identifiser knowns: v er flukthastigheten, 11,1 km / s.
- Identifiser de ukjente: Vi må løse for temperatur, T. Vi må også løse for massen m av heliumatomet.
- Bestem hvilke ligninger som trengs.
- for å få massen m av heliumatomet, kan vi bruke informasjon fra det periodiske bordet: \
- for å løse for temperatur T, kan vi omorganisere \for å gi \
- Erstatte de kjente verdiene i ligningene og løse for de ukjente, \ og \
Betydning
denne temperaturen er mye høyere enn atmosfærisk temperatur, som er omtrent 250 K (\(-25^oC\) eller \(-10^av\)) ved høy høyde. Svært få heliumatomer er igjen i atmosfæren, men mange var til stede da atmosfæren ble dannet, og flere blir alltid skapt av radioaktivt henfall (se kapitlet om kjernefysikk). Årsaken til tapet av heliumatomer er at et lite antall heliumatomer har hastigheter høyere Enn Jordens flukthastighet selv ved normale temperaturer. Hastigheten til et heliumatom endres fra en kollisjon til den neste, slik at det til enhver tid er en liten, men ikke-null sjanse for at atomets hastighet er større enn flukthastigheten. Sjansen er høy nok til at nesten alle heliumatomer som har vært I atmosfæren i løpet Av Jordens levetid har nådd flukthastighet i høye høyder og rømt Fra Jordens gravitasjonskraft. Tyngre molekyler, som oksygen, nitrogen og vann, har mindre rms-hastigheter, og det er derfor mye mindre sannsynlig at noen av dem vil ha hastigheter større enn flukthastigheten. Faktisk er sannsynligheten så liten at milliarder år kreves for å miste betydelige mengder tyngre molekyler fra atmosfæren. Figur \(\PageIndex{4}\) viser effekten av mangel på atmosfære på Månen. Fordi gravitasjonskraften til Månen er mye svakere, har den mistet nesten hele atmosfæren. Atmosfæren Til Jorden og andre legemer blir sammenlignet i dette kapittelets øvelser.

Figur \(\PageIndex{4}\): Dette bildet Av Apollo 17 Commander Eugene Cernan kjører lunar rover på Månen i 1972 ser ut som om det ble tatt om natten med en stor spotlight. Faktisk kommer lyset fra Solen. Fordi akselerasjonen på grunn av tyngdekraften på Månen er så lav (ca 1/6 Av Jorden), Er Månens flukthastighet mye mindre. Som et resultat slipper gassmolekyler veldig lett fra Månen, og etterlater det nesten ingen atmosfære. Selv om dagen er himmelen svart fordi det ikke er gass for å spre sollys. (kreditt: Harrison H. Schmitt/NASA) Øvelse \(\PageIndex{2}\)
hvis du vurderer en veldig liten gjenstand, for eksempel et pollenkorn, i en gass, vil antall molekyler som rammer overflaten også være relativt små. Vil du forvente at pollenkornet opplever svingninger i trykk på grunn av statistiske svingninger i antall gassmolekyler som rammer det i en gitt tid?
Svar
Ja. Slike svingninger forekommer faktisk for en kropp av enhver størrelse i en gass, men siden antall molekyler er enorme for makroskopiske legemer, er svingningene en liten prosentandel av antall kollisjoner, og gjennomsnittene som er omtalt i denne delen varierer umerkelig. Grovt sett er svingningene omvendt proporsjonale med kvadratroten av antall kollisjoner, så for små kropper kan de bli signifikante. Dette ble faktisk observert i det nittende århundre for pollenkorn i vann og er kjent som Brunisk bevegelse.
Damptrykk, Partialtrykk og Daltons Lov
trykket en gass ville skape hvis den okkuperte det totale volumet tilgjengelig kalles gassens partialtrykk. Hvis to eller flere gasser blandes, kommer de til termisk likevekt som følge av kollisjoner mellom molekyler; prosessen er analog med varmeledning som beskrevet i kapitlet om temperatur og varme. Som vi har sett fra kinetisk teori, når gassene har samme temperatur, har deres molekyler samme gjennomsnittlige kinetiske energi. Således adlyder hver gass den ideelle gassloven separat og utøver det samme trykket på veggene i en beholder som det ville hvis det var alene. Derfor er det totale trykket i en blanding av gasser summen av partialtrykk av komponentgassene, forutsatt ideell gassadferd og ingen kjemiske reaksjoner mellom komponentene. Denne loven er Kjent Som Daltons lov om partialtrykk, etter den engelske forskeren John Dalton (1766-1844) som foreslo det. Daltons lov er i samsvar med det faktum at presset legger til I Henhold Til Pascals prinsipp.
i en blanding av ideelle gasser i termisk likevekt er antall molekyler av hver gass proporsjonal med partialtrykket. Dette resultatet følger av å anvende den ideelle gassloven til hver i formen \(p / n = RT / V\). Fordi høyre side er den samme for enhver gass ved en gitt temperatur i en beholder med et gitt volum, er venstre side den samme også.
- Partialtrykk Er trykket en gass ville skape hvis den eksisterte alene.Daltons lov sier at det totale trykket er summen av partialtrykket av alle gassene som er tilstede.
- for to gasser (merket 1 og 2) i likevekt i en beholder, \(\frac{p_1}{n_1} = \frac{p_2}{n_2}.\)
en viktig anvendelse av partialtrykk er at det i kjemi fungerer som konsentrasjonen av en gass for å bestemme reaksjonshastigheten. Her nevner vi bare at partialtrykket av oksygen i en persons lunger er avgjørende for liv og helse. Pusteluft som har et partialtrykk av oksygen under 0,16 atm kan svekke koordinasjon og dømmekraft, spesielt hos personer som ikke akklimatiseres til en høy høyde. Lavere partialtrykk av \(O_2\) har mer alvorlige effekter; partialtrykk under 0,06 atm kan raskt være dødelig, og permanent skade er sannsynlig selv om personen blir reddet. Men følelsen av å måtte puste, som når man holder pusten, skyldes mye mer av høye konsentrasjoner av karbondioksid i blodet enn ved lave konsentrasjoner av oksygen. Således, hvis et lite rom eller skap er fylt med luft med lav oksygenkonsentrasjon, kanskje fordi en lekkende sylinder av noe komprimert gass er lagret der, vil en person ikke føle noen» kvelende » følelse og kan gå i kramper eller miste bevisstheten uten å merke seg noe galt. Sikkerhetsingeniører gir stor oppmerksomhet til denne faren.En annen viktig anvendelse av partialtrykk er damptrykk, som er partialtrykket av en damp hvor den er i likevekt med væsken (eller fast, i tilfelle sublimering) fase av samme substans. Ved en hvilken som helst temperatur kan partialtrykket av vannet i luften ikke overstige damptrykket av vannet ved den temperaturen, fordi når partialtrykket når damptrykket, kondenserer vannet ut av luften. Dugg er et eksempel på denne kondensasjonen. Temperaturen der kondens oppstår for en prøve av luft kalles duggpunktet. Det måles lett ved sakte avkjøling av en metallkule; duggpunktet er temperaturen der kondens først vises på ballen.
damptrykket av vann ved noen temperaturer av interesse for meteorologi er gitt I Tabell\(\PageIndex{1}\).
Tabell\(\PageIndex{1}\): Damptrykk Av Vann Ved Forskjellige Temperaturer T(\(^oC\)) Damptrykk (Pa) 0 610,5 3 757,9 5 872.3 8 1073 10 1228 13 1497 15 1705 18 2063 20 2338 23 2809 25 3167 30 4243 35 5623 40 7376 The relative humidity (R.H.) Ved en temperatur t er definert av
\
en relativ fuktighet på \(100\%\) betyr at partialtrykket av vann er lik damptrykket; med andre ord er luften mettet med vann.
Eksempel \(\PageIndex{3}\): Beregning Av Relativ Fuktighet
hva er relativ fuktighet når lufttemperaturen er \(25^oC\) og duggpunktet er \(15^oC\)?
Strategi
Vi ser bare opp damptrykket ved den gitte temperaturen og det ved duggpunktet og finner forholdet.
Løsning
\
Betydning
Rh er viktig for vår komfort. Verdien av \(53,8\%\) er innenfor området \(40\%\) til \(60\%\) anbefales for komfort innendørs.som nevnt i kapittelet om temperatur og varme, faller temperaturen sjelden under duggpunktet, fordi når det når duggpunktet eller frostpunktet, kondenserer vannet og frigjør en relativt stor mengde latent fordampningsvarme.
Betyr Fri Bane og Betyr Fritid
vi vurderer nå kollisjoner eksplisitt. Det vanlige første trinnet (som er alt vi tar) er å beregne den gjennomsnittlige frie banen, \(\lambda\), den gjennomsnittlige avstanden et molekyl beveger seg mellom kollisjoner med andre molekyler, og den gjennomsnittlige fritiden \(\tau\), den gjennomsnittlige tiden mellom kollisjonene av et molekyl. Hvis vi antar at alle molekylene er sfærer med en radius \(r\), vil et molekyl kollidere med en annen hvis deres sentre er innenfor en avstand 2r av hverandre. For en gitt partikkel sier vi at arealet av en sirkel med den radiusen, \(4\pi r^2\), er «tverrsnittet» for kollisjoner. Når partikkelen beveger seg, sporer den en sylinder med det tverrsnittsarealet. Den gjennomsnittlige frie banen er lengden \(\lambda\) slik at det forventede antall andre molekyler i en sylinder med lengde \(\lambda\) og tverrsnitt \(4\pi r^2\) er 1. Hvis vi midlertidig ignorerer bevegelsen til andre molekyler enn den vi ser på, er det forventede tallet antall tetthet av molekyler, N / V, ganger volumet, og volumet er \(4\pi r^2 \lambda\), så vi har \((n/V)4\pi r^2 \lambda = 1\), eller
\
Å Ta bevegelsen av alle molekylene i betraktning gjør beregningen mye vanskeligere, men den eneste endringen er en faktor på \(\sqrt{2}\). Resultatet er
\
i en ideell gass kan vi erstatte \(v / N = k_BT / p\) for å oppnå
\
den gjennomsnittlige fritiden \(\tau\) er ganske enkelt den gjennomsnittlige frie banen delt med en typisk hastighet, og det vanlige valget er rms-hastigheten. Deretter
\
Beregning Av Gjennomsnittlig Fritid
Finn gjennomsnittlig fritid for argonatomer (\(m = 39,9 \, g / mol\)) ved en temperatur på \(0^oC\) og et trykk på 1,00 atm. Ta radiusen til et argonatom til å være \(1,70 \ ganger 10^{-10} \ space m\).
Løsning
- Identifiser knowns og konverter TIL si-enheter. Vi vet at molarmassen er 0.0399 kg / mol, temperaturen er 273 K, trykket er \(1,01 \ ganger 10^5\, Pa\), og radiusen er \(1,70 \ ganger 10^{-10} \, m\).
- Finn rms-hastigheten: \(v_{rms} = \sqrt{\frac{3RT}{M}} = 413\, m / s\).
- Erstatning i ligningen for gjennomsnittlig fritid: \
Betydning
vi kan knapt sammenligne dette resultatet med vår intuisjon om gassmolekyler, men det gir oss et bilde av molekyler som kolliderer med ekstremt høy frekvens.
Øvelse \(\PageIndex{4}\)
Som har en lengre middelfri bane, flytende vann eller vanndamp i luften?
Svar
i en væske er molekylene svært tett sammen og kolliderer stadig med hverandre. For at en gass skal være nesten ideell, da luft er under vanlige forhold, må molekylene være veldig langt fra hverandre. Derfor er den gjennomsnittlige frie banen mye lengre i luften.
Bidragsytere og Attribusjoner
-
Samuel J. Ling (Truman State University), Jeff Sanny (Loyola Marymount University), Og Bill Moebs med mange bidragsytere. Dette verk er lisensieret af OpenStax University Physics under En Creative Commons Navngivelse (Av 4.0).