Molekylorbitaler Av En Allylisk Karbokasjon
stabiliteten av karbokasjonen av propen skyldes et konjugert π elektronsystem. En «dobbeltbinding» eksisterer egentlig ikke. I stedet er det en gruppe på 3 tilstøtende, overlappende, ikke-hybridiserte p-orbitaler vi kaller et konjugert elektronsystem. Du kan tydelig se samspillet mellom alle tre p-orbitaler fra de tre karbonene som resulterer i en veldig stabil kation. Alt kommer ned til hvor plasseringen av elektron-mangelfull karbon er.
Molekylære orbitale beskrivelser kan forklare allylisk stabilitet på en annen måte ved hjelp av 2-propenyl. Fig.6
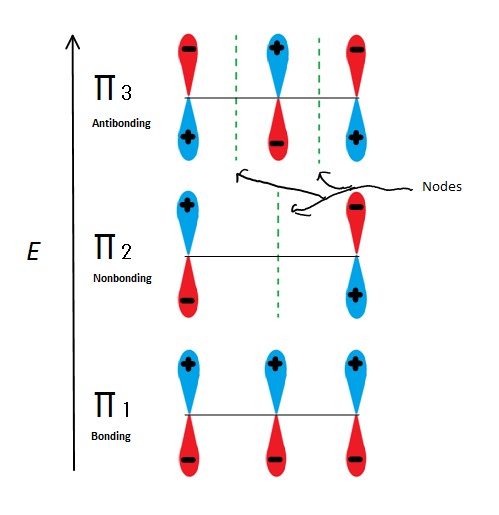
Fig.6 Viser 3 mulige Molekylorbitaler av 2-propenyl
hvis vi bare tar den π molekylorbitale og ikke noen av s, får vi tre av dem. π 1 binder seg uten noder, π 2 er nonbonding (Med andre ord den samme energien som en vanlig p-orbital) med en node, og π 3 er antibonding med 2 noder(ingen av orbitalene interagerer). De to første elektronene vil gå inn i π 1 molekylorbital, uansett om det er en kation, radikal eller anion. Hvis det er en radikal eller anion, går neste elektron inn i π 2 molekylorbital. Den siste anionelektronen går også inn i ikke-bundet orbital. Så uansett hva slags karbon senter eksisterer, vil ingen elektron noen gang gå inn i antibonding orbital.
Bindingsorbitalene er de laveste energibitalene og er gunstige, og derfor fylles de først. Selv om de ikke-bundet orbitaler kan fylles, er den totale energien i systemet fortsatt lavere og mer stabil på grunn av de fylte bindingsmolekylære orbitaler.
dette tallet viser også at π2 er det eneste molekylorbitalet hvor elektronen er forskjellig, og det er også der en enkelt node passerer gjennom midten. På grunn av dette er ladningene av molekylet hovedsakelig på de to terminale karbonene og ikke midtkarbonet.
denne molekylorbitale beskrivelsen kan også illustrere stabiliteten til allyliske karbonsentre i figur 7.
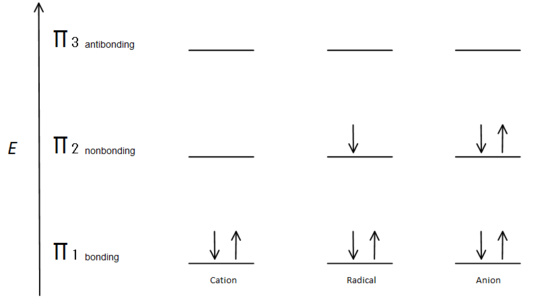
Fig.7 diagram som viser hvordan elektronene fyller ut basert på aufbau-prinsippet.
den π bonding orbital er lavere i energi enn nonbonding p orbital. Siden hvert vist karbonsenter har to elektroner i den lavere energien, bindes π orbitaler, blir energien til hvert system senket samlet (og dermed mer stabil), uavhengig av kation, radikal eller anion.