Obiettivi formativi
Alla fine di questa sezione, sarete in grado di:
- Esaminare il trasferimento di calore.
- Calcolare la temperatura finale dal trasferimento di calore.
Finora abbiamo discusso il cambiamento di temperatura dovuto il trasferimento di calore. Nessun cambiamento di temperatura si verifica dal trasferimento di calore se il ghiaccio si scioglie e diventa acqua liquida (cioè, durante un cambiamento di fase). Ad esempio, considera l’acqua che gocciola dai ghiaccioli che si sciolgono su un tetto riscaldato dal sole. Al contrario, l’acqua si congela in un vassoio di ghiaccio raffreddato da un ambiente a temperatura inferiore.

Figura 1. Il calore dall’aria si trasferisce al ghiaccio facendolo sciogliere. (credit: Mike Brand)
L’energia è necessaria per fondere un solido perché i legami coesivi tra le molecole nel solido devono essere spezzati in modo tale che, nel liquido, le molecole possano muoversi a energie cinetiche comparabili; pertanto, non vi è alcun aumento della temperatura. Allo stesso modo, l’energia è necessaria per vaporizzare un liquido, perché le molecole in un liquido interagiscono tra loro tramite forze attraenti. Non vi è alcun cambiamento di temperatura fino al completamento di un cambiamento di fase. La temperatura di una tazza di soda inizialmente a 0ºC rimane a 0ºC fino a quando tutto il ghiaccio si è sciolto. Al contrario, l’energia viene rilasciata durante il congelamento e la condensazione, di solito sotto forma di energia termica. Il lavoro è fatto da forze coesive quando le molecole sono riunite. L’energia corrispondente deve essere emessa (dissipata)per consentire loro di rimanere insieme Figura 2.
L’energia coinvolta in un cambiamento di fase dipende da due fattori principali: il numero e la forza di legami o coppie di forze. Il numero di legami è proporzionale al numero di molecole e quindi alla massa del campione. La forza delle forze dipende dal tipo di molecole. Il calore Q richiesto di modificare la fase di un campione di massa m è dato da
Q = mLf (punto di fusione/congelamento,
Q = mLv (evaporazione/condensazione),
in cui il calore latente di fusione, Lf, e il calore latente di vaporizzazione, Lv, sono le costanti del materiale che sono determinati sperimentalmente. Cfr. (Tabella 1).

Figura 2. (a) L’energia è necessaria per superare parzialmente le forze attrattive tra le molecole in un solido per formare un liquido. Quella stessa energia deve essere rimossa perché il congelamento abbia luogo. (b) Le molecole sono separate da grandi distanze quando vanno dal liquido al vapore, richiedendo energia significativa per superare l’attrazione molecolare. La stessa energia deve essere rimossa per la condensazione. Non vi è alcun cambiamento di temperatura fino al completamento di un cambiamento di fase.
Il calore latente è misurato in unità di J / kg. Sia Lf che Lv dipendono dalla sostanza, in particolare dalla forza delle sue forze molecolari come notato in precedenza. Lf e Lv sono chiamati collettivamente coefficienti di calore latente. Sono latenti, o nascosti, perché nei cambiamenti di fase, l’energia entra o esce da un sistema senza causare un cambiamento di temperatura nel sistema; quindi, in effetti, l’energia è nascosta. La tabella 1 elenca i valori rappresentativi di Lf e Lv, insieme ai punti di fusione e di ebollizione.
La tabella mostra che quantità significative di energia sono coinvolte nei cambiamenti di fase. Diamo un’occhiata, ad esempio, a quanta energia è necessaria per sciogliere un chilogrammo di ghiaccio a 0ºC per produrre un chilogrammo di acqua a 0°C. Usando l’equazione per un cambiamento di temperatura e il valore per l’acqua dalla Tabella 1, troviamo che Q = mLf = (1.0 kg) (334 kJ/kg) = 334 kJ è l’energia per sciogliere un chilogrammo di ghiaccio. Questa è molta energia in quanto rappresenta la stessa quantità di energia necessaria per aumentare la temperatura di 1 kg di acqua liquida da 0ºC a 79,8 ºC. Ancora più energia è necessaria per vaporizzare l’acqua; ci vorrebbero 2256 kJ per cambiare 1 kg di acqua liquida al normale punto di ebollizione (100ºC a pressione atmosferica) a vapore (vapore acqueo). Questo esempio mostra che l’energia per un cambiamento di fase è enorme rispetto all’energia associata a cambiamenti di temperatura senza un cambiamento di fase.
| Table 1. Heats of Fusion and Vaporization | ||||||
|---|---|---|---|---|---|---|
| Lf | Lv | |||||
| Substance | Melting point (ºC) | kJ/kg | kcal/kg | Boiling point (°C) | kJ/kg | kcal/kg |
| Helium | −269.7 | 5.23 | 1.25 | −268.9 | 20.9 | 4.99 |
| Hydrogen | −259.3 | 58.6 | 14.0 | −252.9 | 452 | 108 |
| Nitrogen | −210.0 | 25.5 | 6.09 | −195.8 | 201 | 48.0 |
| Oxygen | −218.8 | 13.8 | 3.30 | −183.0 | 213 | 50.9 |
| Ethanol | −114 | 104 | 24.9 | 78.3 | 854 | 204 |
| Ammonia | −75 | 108 | −33.4 | 1370 | 327 | |
| Mercury | −38.9 | 11.8 | 2.82 | 357 | 272 | 65.0 |
| Water | 0.00 | 334 | 79.8 | 100.0 | 2256 | 539 |
| Sulfur | 119 | 38.1 | 9.10 | 444.6 | 326 | 77.9 |
| Lead | 327 | 24.5 | 5.85 | 1750 | 871 | 208 |
| Antimony | 631 | 165 | 39.4 | 1440 | 561 | 134 |
| Aluminum | 660 | 380 | 90 | 2450 | 11400 | 2720 |
| Silver | 961 | 88.3 | 21.1 | 2193 | 2336 | 558 |
| Gold | 1063 | 64.5 | 15.4 | 2660 | 1578 | 377 |
| Copper | 1083 | 134 | 32.0 | 2595 | 5069 | 1211 |
| Uranium | 1133 | 84 | 20 | 3900 | 1900 | 454 |
| Tungsten | 3410 | 184 | 44 | 5900 | 4810 | 1150 |
Phase changes can have a tremendous stabilizing effect even on temperatures that are not near the melting and boiling points, because evaporation and condensation (conversion of a gas into a liquid state) occur even at temperatures below the boiling point. Prendiamo, ad esempio, il fatto che le temperature dell’aria nei climi umidi raramente superano i 35,0 ºC, il che è dovuto al fatto che la maggior parte del trasferimento di calore va nell’evaporazione dell’acqua nell’aria. Allo stesso modo, le temperature in tempo umido raramente scendono al di sotto del punto di rugiada perché il calore enorme viene rilasciato quando il vapore acqueo si condensa.
Esaminiamo gli effetti del cambiamento di fase più precisamente considerando l’aggiunta di calore in un campione di ghiaccio a −20ºC (Figura 3). La temperatura del ghiaccio aumenta linearmente, assorbendo calore ad una velocità costante di 0,50 cal / g º ºC fino a raggiungere 0ºC. Una volta a questa temperatura, il ghiaccio inizia a sciogliersi fino a quando tutto il ghiaccio si è sciolto, assorbendo 79,8 cal/g di calore. La temperatura rimane costante a 0ºC durante questo cambiamento di fase. Una volta che tutto il ghiaccio si è sciolto, la temperatura dell’acqua liquida aumenta, assorbendo calore ad una nuova velocità costante di 1,00 cal/g º ºC. A 100ºC, l’acqua inizia a bollire e la temperatura rimane costante mentre l’acqua assorbe 539 cal/g di calore durante questo cambiamento di fase. Quando tutto il liquido è diventato vapore vapore, la temperatura aumenta di nuovo, assorbendo calore ad una velocità di 0,482 cal/g º ºC.
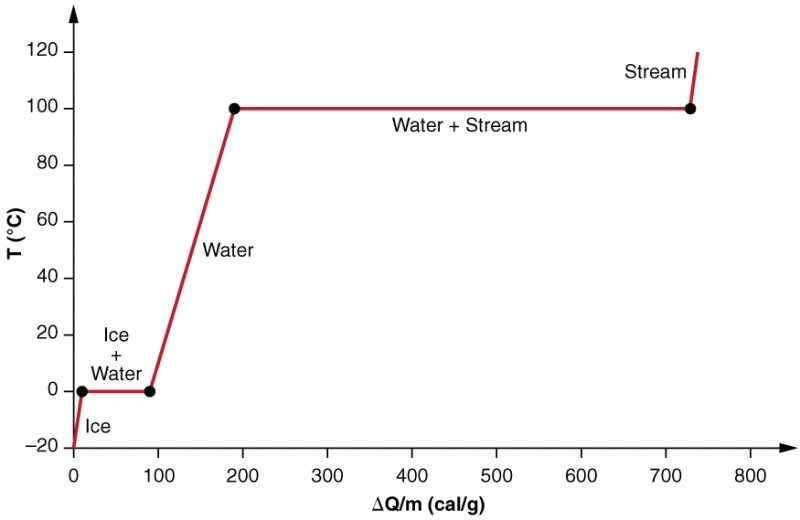
Figura 3. Un grafico di temperatura rispetto all’energia aggiunto. Il sistema è costruito in modo che nessun vapore evapori mentre il ghiaccio si scalda per diventare acqua liquida e in modo che, quando si verifica la vaporizzazione, il vapore rimanga nel sistema. I lunghi tratti di valori di temperatura costanti a 0ºC e 100ºC riflettono il grande calore latente di fusione e vaporizzazione, rispettivamente.
L’acqua può evaporare a temperature inferiori al punto di ebollizione. È richiesta più energia rispetto al punto di ebollizione, perché l’energia cinetica delle molecole d’acqua a temperature inferiori a 100ºC è inferiore a quella a 100ºC, quindi meno energia è disponibile da movimenti termici casuali. Prendiamo, ad esempio, il fatto che, a temperatura corporea, la sudorazione dalla pelle richiede un apporto di calore di 2428 kJ/kg, che è circa il 10% superiore al calore latente di vaporizzazione a 100ºC. Questo calore proviene dalla pelle e fornisce quindi un efficace meccanismo di raffreddamento nella stagione calda. L’elevata umidità inibisce l’evaporazione, in modo che la temperatura corporea possa aumentare, lasciando il sudore non evaporato sulla fronte.
Esempio 1. Calcolare la temperatura finale dal cambiamento di fase: Raffreddamento Soda con cubetti di ghiaccio
Tre cubetti di ghiaccio vengono utilizzati per raffreddare una soda a 20ºC con massa msoda = 0,25 kg. Il ghiaccio è a 0ºC e ogni cubetto di ghiaccio ha una massa di 6,0 g. Si supponga che la soda sia conservata in un contenitore di schiuma in modo che la perdita di calore possa essere ignorata. Supponiamo che la soda abbia la stessa capacità termica dell’acqua. Trova la temperatura finale quando tutto il ghiaccio si è sciolto.
Strategia
I cubetti di ghiaccio sono alla temperatura di fusione di 0ºC. Il calore viene trasferito dalla soda al ghiaccio per sciogliersi. Lo scioglimento del ghiaccio avviene in due fasi: prima si verifica il cambiamento di fase e il solido (ghiaccio) si trasforma in acqua liquida alla temperatura di fusione, quindi la temperatura di quest’acqua aumenta. La fusione produce acqua a 0ºC, quindi più calore viene trasferito dalla soda a quest’acqua fino a quando il sistema water plus soda raggiunge l’equilibrio termico, Qice = − Qsoda.
Il calore trasferito al ghiaccio è
Qice = mouse Lf + micecW(Tf−0ºC).
Il calore emesso dalla soda è Qsoda = msodacW(Tf−20ºC). Poiché nessun calore è perso, Qice = – Qsoda, in modo che
topi Lf + micecW (Tf-0ºC) = −msodacW(Tf-20ºC).
Porta tutti i termini che coinvolgono Tf sul lato sinistro e tutti gli altri termini sul lato destro. Risolvere per la quantità sconosciuta Tf:
\displaystyle{T}_{\text{f}}=\frac{m_{\text{soda}}c_{\text{W}}\left(20^{\circ}\text{C}\right)-m_{\text{ice}}L_{\text{f}}}{\left(m_{\text{soda}}+m_{\text{ice}}\right)c_{\text{W}}}\\
Soluzione
- Identificare la quantità note. La massa di ghiaccio è topi = 3 × 6,0 g = 0,018 kg e la massa di soda è msoda = 0,25 kg.
- Calcola i termini nel numeratore: m sodacW(20ºC)=(0,25 kg)(4186 J/kg º ºC)(20ºC) = 20,930 J e miceLf = (0,018 kg)(334,000 J/kg) = 6012 J.
- Calcola il denominatore: (msoda + topi)cW = (0,25 kg + 0.018 kg) (4186 K/(kg º ºC) = 1122 J / ºC.
- Calcola la temperatura finale: \displaystyle{T}_{\text{f}}=\frac{20,930\text{ J}-6012\text{ J}}{1122\text{ J/}^{\circ}\text{C}}=13^{\circ}\text{C}\\
Discussione
in Questo esempio evidenzia le enormi energie in gioco durante un cambiamento di fase. La massa di ghiaccio è circa il 7 per cento della massa d’acqua, ma porta ad un notevole cambiamento nella temperatura della soda. Anche se abbiamo ipotizzato che il ghiaccio fosse alla temperatura di congelamento, questo non è corretto: la temperatura tipica è −6ºC. Tuttavia, questa correzione fornisce una temperatura finale che è essenzialmente identica al risultato che abbiamo trovato. Può spiegare perché?

Figura 4. Condensazione su un bicchiere di tè freddo. (credit: Jenny Downing)
Abbiamo visto che la vaporizzazione richiede il trasferimento di calore a un liquido dall’ambiente circostante, in modo che l’energia venga rilasciata dall’ambiente circostante. La condensazione è il processo inverso, aumentando la temperatura dell’ambiente circostante. Questo aumento può sembrare sorprendente, dal momento che associamo la condensazione con oggetti freddi—il vetro nella figura, per esempio. Tuttavia, l’energia deve essere rimossa dalle molecole di condensazione per far condensare un vapore. L’energia è esattamente la stessa necessaria per effettuare il cambiamento di fase nell’altra direzione, da liquido a vapore, e quindi può essere calcolata da Q = mLv.
Si forma condensa in Figura 4 perché la temperatura dell’aria vicina è ridotta al di sotto del punto di rugiada. L’aria non può contenere tanta acqua come ha fatto a temperatura ambiente, e così l’acqua si condensa. L’energia viene rilasciata quando l’acqua si condensa, accelerando lo scioglimento del ghiaccio nel vetro.
Applicazione del mondo reale
L’energia viene rilasciata anche quando un liquido si congela. Questo fenomeno viene utilizzato dai coltivatori di frutta in Florida per proteggere le arance quando la temperatura è vicina al punto di congelamento (0ºC). I coltivatori spruzzano acqua sulle piante nei frutteti in modo che l’acqua si congeli e il calore venga rilasciato alle arance in crescita sugli alberi. Ciò impedisce alla temperatura all’interno dell’arancia di scendere sotto lo zero, il che danneggerebbe il frutto.

Figura 14.11. Il ghiaccio su questi alberi ha rilasciato grandi quantità di energia quando si è congelato, aiutando a impedire che la temperatura degli alberi scenda sotto 0ºC. L’acqua viene spruzzata intenzionalmente sui frutteti per aiutare a prevenire gelate dure. (credito: Hermann Hammer)
La sublimazione è la transizione dalla fase solida a quella vapore. Avrete notato che la neve può scomparire nel nulla senza una traccia di acqua liquida, o la scomparsa di cubetti di ghiaccio in un congelatore. È anche vero il contrario: il gelo può formarsi su finestre molto fredde senza passare attraverso lo stadio liquido. Un effetto popolare è la produzione di” fumo ” dal ghiaccio secco, che è anidride carbonica solida. La sublimazione si verifica perché la pressione di vapore di equilibrio dei solidi non è zero. Alcuni deodoranti utilizzano la sublimazione di un solido per iniettare un profumo nella stanza. Le sfere di falena sono un esempio leggermente tossico di un fenolo (un composto organico) che sublima, mentre alcuni solidi, come il tetrossido di osmio, sono così tossici che devono essere conservati in contenitori sigillati per impedire l’esposizione umana ai loro vapori prodotti dalla sublimazione.

Figura 5. Le transizioni dirette tra solido e vapore sono comuni, a volte utili e persino belle. (a) Il ghiaccio secco sublima direttamente il gas di anidride carbonica. Il vapore visibile è fatto di gocce d’acqua. (credito: Windell Oskay) (b) Gelo forma modelli su una finestra molto freddo, un esempio di un solido formato direttamente da un vapore. (credit: Liz West)
Tutte le transizioni di fase coinvolgono il calore. Nel caso di transizioni dirette solido-vapore, l’energia richiesta è data dall’equazione Q = mLs, dove Ls è il calore di sublimazione, che è l’energia richiesta per cambiare 1.00 kg di una sostanza dalla fase solida alla fase vapore. Ls è analogo a Lf e Lv e il suo valore dipende dalla sostanza. La sublimazione richiede energia, in modo che il ghiaccio secco sia un refrigerante efficace, mentre il processo inverso (cioè la glassa) rilascia energia. La quantità di energia richiesta per la sublimazione è dello stesso ordine di grandezza di quella per altre transizioni di fase.
Il materiale presentato in questa sezione e nella sezione precedente ci consente di calcolare qualsiasi numero di effetti relativi alla temperatura e al cambiamento di fase. In ogni caso, è necessario identificare quali cambiamenti di temperatura e fase stanno avvenendo e quindi applicare l’equazione appropriata. Tieni presente che il trasferimento di calore e il lavoro possono causare cambiamenti di temperatura e di fase.
Strategie di risoluzione dei problemi per gli effetti del trasferimento di calore
- Esaminare la situazione per determinare che c’è un cambiamento nella temperatura o nella fase. C’è trasferimento di calore dentro o fuori dal sistema? Quando la presenza o l’assenza di un cambiamento di fase non è evidente, si potrebbe desiderare di risolvere prima il problema come se non ci fossero cambiamenti di fase, ed esaminare il cambiamento di temperatura ottenuto. Se è sufficiente portarti oltre un punto di ebollizione o di fusione, dovresti tornare indietro e fare il problema in passaggi: cambiamento di temperatura, cambiamento di fase, cambiamento di temperatura successivo e così via.
- Identifica ed elenca tutti gli oggetti che cambiano temperatura e fase.
- Identifica esattamente ciò che deve essere determinato nel problema (identifica le incognite). Una lista scritta è utile.
- Fai un elenco di ciò che viene dato o ciò che può essere dedotto dal problema come affermato (identifica i knowns).
- Risolvere l’equazione appropriata per la quantità da determinare (l’ignoto). Se c’è un cambiamento di temperatura, il calore trasferito dipende dal calore specifico (vedi Tabella 1 in Variazione di temperatura e capacità termica) mentre, per un cambiamento di fase, il calore trasferito dipende dal calore latente. Cfr. Tabella 1.
- Sostituire i knowns con le loro unità nell’equazione appropriata e ottenere soluzioni numeriche complete di unità. È necessario eseguire questa operazione in fasi se vi è più di una fase del processo (ad esempio un cambiamento di temperatura seguito da un cambiamento di fase).
- Controlla la risposta per vedere se è ragionevole: ha senso? Ad esempio, assicurati che il cambiamento di temperatura non causi anche un cambiamento di fase che non hai preso in considerazione.
Verifica la tua comprensione
Perché la neve rimane sui pendii di montagna anche quando le temperature diurne sono superiori alla temperatura di congelamento?
Soluzione
La neve è formata da cristalli di ghiaccio e quindi è la fase solida dell’acqua. Poiché il calore enorme è necessario per i cambiamenti di fase, ci vuole una certa quantità di tempo per accumulare questo calore dall’aria, anche se l’aria è superiore a 0ºC. Più l’aria è calda, più velocemente si verifica questo scambio di calore e più velocemente la neve si scioglie.
Sommario della sezione
- La maggior parte delle sostanze può esistere sia in forme solide, liquide e gassose, che sono indicate come “fasi.”
- I cambiamenti di fase si verificano a temperature fisse per una determinata sostanza ad una data pressione e queste temperature sono chiamate punti di ebollizione e congelamento (o fusione).
- Durante i cambiamenti di fase, il calore assorbito o rilasciato è dato da: Q = mL dove L è il coefficiente di calore latente.
Domande concettuali
- Il trasferimento di calore può causare variazioni di temperatura e di fase. Cos’altro può causare questi cambiamenti?
- In che modo il calore latente della fusione dell’acqua aiuta a rallentare la diminuzione delle temperature dell’aria, forse impedendo che le temperature scendano significativamente al di sotto di ºC, in prossimità di grandi corpi idrici?
- Qual è la temperatura del ghiaccio subito dopo che è formata dal congelamento dell’acqua?
- Se metti ºC ice in ºC water in un contenitore isolato, cosa succederà? Un po ‘ di ghiaccio si scioglierà, più acqua si congelerà o nessuno dei due avrà luogo?
- Che effetto ha la condensazione su un bicchiere di acqua ghiacciata sulla velocità con cui il ghiaccio si scioglie? La condensazione accelererà il processo di fusione o lo rallenterà?
- In climi molto umidi dove ci sono numerosi corpi d’acqua, come in Florida, è insolito che le temperature superino circa 35ºC (95ºF). Nei deserti, tuttavia, le temperature possono salire molto al di sopra di questo. Spiega come l’evaporazione dell’acqua aiuta a limitare le alte temperature nei climi umidi.
- In inverno, è spesso più caldo a San Francisco che nella vicina Sacramento, 150 km nell’entroterra. In estate, è quasi sempre più caldo a Sacramento. Spiega come i corpi d’acqua che circondano San Francisco moderano le sue temperature estreme.
- Mettere un coperchio su una pentola bollente riduce notevolmente il trasferimento di calore necessario per mantenerlo bollente. Spiega perché.
- Gli alimenti liofilizzati sono stati disidratati nel vuoto. Durante il processo, il cibo si congela e deve essere riscaldato per facilitare la disidratazione. Spiega sia come il vuoto accelera la disidratazione che perché il cibo si congela di conseguenza.
- Quando l’aria si raffredda ancora irradiando di notte, è insolito che le temperature scendano al di sotto del punto di rugiada. Spiega perché.
- In una dimostrazione in aula di fisica, un istruttore gonfia un palloncino per bocca e poi lo raffredda in azoto liquido. Quando è freddo, il palloncino rimpicciolito ha una piccola quantità di liquido azzurro, così come alcuni cristalli simili a neve. Mentre si riscalda, il liquido bolle e parte dei cristalli sublima, con alcuni cristalli che persistono per un po ‘ e poi producono un liquido. Identificare il liquido blu e i due solidi nel pallone freddo. Giustifica le tue identificazioni utilizzando i dati della Tabella 1.
Problemi& Esercizi
- Quanto trasferimento di calore (in kilocalorie) è necessario per scongelare un pacchetto di 0,450 kg di verdure surgelate originariamente a 0ºC se il loro calore di fusione è lo stesso di quello dell’acqua?
- Un sacchetto contenente ghiaccio 0ºC è molto più efficace nell’assorbimento di energia di uno contenente la stessa quantità di acqua 0ºC. (a) Quanto trasferimento di calore è necessario per aumentare la temperatura di 0.800 kg di acqua da 0ºC a 30.0 ºC? (b)Quanto trasferimento di calore è necessario per fondere prima 0.800 kg di ghiaccio 0ºC e quindi aumentare la sua temperatura? (c) Spiega come la tua risposta supporta la tesi che l’ice sia più efficace.
- (a) Quanto trasferimento di calore è necessario per aumentare la temperatura di una pentola di alluminio da 0,750 kg contenente 2,50 kg di acqua da 30,0 ºC al punto di ebollizione e quindi far bollire 0,750 kg di acqua? (b) Quanto tempo ci vuole se la velocità di trasferimento del calore è di 500 W 1 watt = 1 joule/secondo (1 W = 1 J/s)?
- La formazione di condensa su un bicchiere di acqua ghiacciata fa sì che il ghiaccio si sciolga più velocemente di quanto non sarebbe altrimenti. Se 8.00 g di condensa si formano su un bicchiere contenente sia acqua che 200 g di ghiaccio, quanti grammi di ghiaccio si scioglieranno di conseguenza? Si supponga che non si verifichi altro trasferimento di calore.
- Durante un viaggio, si nota che un sacchetto di ghiaccio da 3,50 kg dura in media un giorno nel dispositivo di raffreddamento. Qual è la potenza media in watt che entra nel ghiaccio se inizia a 0ºC e si scioglie completamente in acqua 0ºC esattamente in un giorno 1 watt = 1 joule / secondo (1 W = 1 J/s)?
- In una certa giornata di sole secco, la temperatura di una piscina aumenterebbe di 1,50 ºC se non fosse per evaporazione. Quale frazione dell’acqua deve evaporare per portare via con precisione abbastanza energia per mantenere costante la temperatura?
- (a) Quanto trasferimento di calore è necessario per aumentare la temperatura di un pezzo di ghiaccio da 0,200 kg da -20,0 ºC a 130ºC, compresa l’energia necessaria per i cambiamenti di fase? (b) Quanto tempo è richiesto per ogni fase, assumendo una velocità costante di trasferimento di calore di 20,0 kJ/s? (c) Fare un grafico della temperatura in funzione del tempo per questo processo.
- Nel 1986, un gigantesco iceberg si staccò dalla piattaforma di ghiaccio di Ross in Antartide. Era approssimativamente un rettangolo lungo 160 km, 40.0 km di larghezza e 250 m di spessore. (a) Qual è la massa di questo iceberg, dato che la densità del ghiaccio è di 917 kg/m3? (b) Quanto trasferimento di calore (in joule) è necessario per fonderlo? (c) Quanti anni ci vorrebbe solo la luce del sole per sciogliere il ghiaccio così spesso, se il ghiaccio assorbe una media di 100 W/m2, 12,00 h al giorno?
- Quanti grammi di caffè devono evaporare da 350 g di caffè in una tazza di vetro da 100 g per raffreddare il caffè da 95,0 ºC a 45,0 ºC? Si può supporre che il caffè abbia le stesse proprietà termiche dell’acqua e che il calore medio di vaporizzazione sia di 2340 kJ/kg (560 cal/g). (Si può trascurare il cambiamento di massa del caffè come si raffredda, che vi darà una risposta che è leggermente più grande di quella corretta.)
- (a) È difficile spegnere un incendio su una petroliera, perché ogni litro di petrolio greggio rilascia 2,80 × 107 J di energia quando viene bruciato. Per illustrare questa difficoltà, calcolare il numero di litri di acqua che devono essere spesi per assorbire l’energia rilasciata bruciando 1,00 L di petrolio greggio, se l’acqua ha la sua temperatura aumentata da 20,0 ºC a 100ºC, bolle e il vapore risultante viene portato a 300ºC. (b) Discutere ulteriori complicazioni causate dal fatto che il petrolio greggio ha una densità inferiore all’acqua.
- L’energia rilasciata dalla condensazione nei temporali può essere molto grande. Calcola l’energia rilasciata nell’atmosfera per una piccola tempesta di raggio 1 km, supponendo che 1,0 cm di pioggia siano precipitati uniformemente su quest’area.
- Per prevenire i danni causati dal gelo, 4,00 kg di acqua a 0ºC vengono spruzzati su un albero da frutto. (a) Quanto trasferimento di calore avviene quando l’acqua si congela? (b) Quanto diminuirebbe la temperatura dell’albero di 200 kg se questa quantità di calore trasferito dall’albero? Prendi il calore specifico per essere 3.35 kJ / kg · ºC e supponiamo che non si verifichi alcun cambiamento di fase.
- Una ciotola di alluminio da 0,250 kg che contiene 0,800 kg di zuppa a 25,0 ºC viene posta in un congelatore. Qual è la temperatura finale se 377 kJ di energia viene trasferita dalla ciotola e dalla zuppa, assumendo che le proprietà termiche della zuppa siano le stesse di quelle dell’acqua?
- Un cubetto di ghiaccio da 0,0500 kg a -30,0 ºC viene posto in 0,400 kg di acqua da 35,0 ºC in un contenitore molto ben isolato. Qual è la temperatura finale?
- Se si versano 0,0100 kg di acqua 20,0 ºC su un blocco di ghiaccio da 1,20 kg (che inizialmente è a -15,0 ºC), qual è la temperatura finale? Si può supporre che l’acqua si raffreddi così rapidamente che gli effetti dell’ambiente circostante sono trascurabili.
- Gli indigeni a volte cucinano in cesti stagni mettendo rocce calde nell’acqua per portarla a ebollizione. Quale massa di roccia a 500ºC deve essere posta in 4,00 kg di acqua a 15,0 ºC per portare la sua temperatura a 100ºC, se 0,0250 kg di acqua fuoriesce come vapore dallo sfrigolio iniziale? Si può trascurare gli effetti dei dintorni e prendere il calore specifico medio delle rocce per essere quello di granito.
- Quale sarebbe la temperatura finale della padella e dell’acqua nel calcolo della temperatura finale quando il calore viene trasferito tra due corpi: Versare acqua fredda in una padella calda se 0,260 kg di acqua sono stati posti nella padella e 0,0100 kg di acqua evaporata immediatamente, lasciando il resto a raggiungere una temperatura comune con la padella?
- In alcuni paesi, l’azoto liquido viene utilizzato su camion da latte invece di frigoriferi meccanici. A 3.il viaggio di consegna di 00 ore richiede 200 L di azoto liquido, che ha una densità di 808 kg/m3. (a) Calcolare il trasferimento di calore necessario per evaporare questa quantità di azoto liquido e aumentare la sua temperatura a 3,00 ºC. (Utilizzare cp e assumere che sia costante nell’intervallo di temperatura.) Questo valore è la quantità di raffreddamento delle forniture di azoto liquido. (b) Qual è questa velocità di trasferimento del calore in kilowattora? c) Confrontare la quantità di raffreddamento ottenuta dalla fusione di una massa identica di 0ºC di ghiaccio con quella ottenuta dall’evaporazione dell’azoto liquido.
- Alcuni appassionati di pistole fanno i propri proiettili, che comporta la fusione e la fusione delle lumache di piombo. Quanto trasferimento di calore è necessario per aumentare la temperatura e fondere 0.500 kg di piombo, a partire da 25.0 ºC?
Glossario
il calore di sublimazione: l’energia necessaria per cambiare una sostanza dalla fase solida alla fase di vapore
il calore latente coefficiente di fisica costante uguale alla quantità di calore trasferito per ogni 1 kg di una sostanza durante il cambiamento di fase di una sostanza
sublimazione: il passaggio dalla fase solida alla fase vapore
Soluzioni selezionate ai problemi & Esercizi
1. 35,9 kcal
3. a) 591 kcal; b)4,94 × 103 s
5. 13,5 W
7. (a) 148 kcal; (b) 0,418 s, 3,34 s, 4,19 s, 22,6 s, 0,456 s
9. 33,0 g
10. (a) 9.67 L; (b) Il petrolio greggio è meno denso dell’acqua, quindi galleggia sopra l’acqua, esponendolo così all’ossigeno nell’aria, che usa per bruciare. Inoltre, se l’acqua è sotto l’olio, è meno efficiente nell’assorbire il calore generato dall’olio.
12. a) 319 kcal; b) 2,00 ºC
14. 20,6 ºC
16. 4,38 kg
18. (a) 1,57 × 104 kcal; (b) 18,3 kW ⋅ h; (c) 1,29 × 104 kcal
- Valori citati alle normali temperature di fusione e di ebollizione alla pressione atmosferica standard (1 atm). ↵
- A 37.0 ° C (temperatura corporea), il calore di vaporizzazione Lv per l’acqua è 2430 kJ/kg o 580 kcal/kg ↵
- A 37.0 ° C (temperatura corporea), il calore di vaporizzazione Lv per l’acqua è 2430 kJ/kg o 580 kcal/kg ↵