Trova fonti: “Single bond” – news · giornali · libri · scholar · JSTOR (agosto 2012) (Scopri come e quando rimuovere questo messaggio modello)
In chimica, un singolo legame è un legame chimico tra due atomi che coinvolgono due elettroni di valenza. Cioè, gli atomi condividono una coppia di elettroni dove si forma il legame. Pertanto, un singolo legame è un tipo di legame covalente. Quando condiviso, ciascuno dei due elettroni coinvolti non è più in possesso esclusivo dell’orbitale in cui ha avuto origine. Piuttosto, entrambi i due elettroni passano il tempo in uno degli orbitali che si sovrappongono nel processo di legame. Come struttura di Lewis, un singolo legame è indicato come AːA o A-A, per cui A rappresenta un elemento (Moore, Stanitski e Jurs 329). Nella prima rappresentazione, ogni punto rappresenta un elettrone condiviso, e nella seconda rappresentazione, la barra rappresenta entrambi gli elettroni condivisi nel singolo legame.

Un legame covalente può anche essere un doppio legame o un triplo legame. Un singolo legame è più debole di un doppio legame o di un triplo legame. Questa differenza di forza può essere spiegata esaminando i legami componenti di cui ciascuno di questi tipi di legami covalenti è costituito (Moore, Stanitski e Jurs 393).
Di solito, un singolo legame è un legame sigma. Un’eccezione è il legame in diboron, che è un legame pi. Al contrario, il doppio legame è costituito da un legame sigma e un legame pi, e un legame triplo è costituito da un legame sigma e due legami pi (Moore, Stanitski e Jurs 396). Il numero di legami componenti è ciò che determina la disparità di forza. È ovvio che il legame singolo è il più debole dei tre perché consiste solo di un legame sigma, e il doppio legame o il triplo legame consistono non solo di questo tipo di legame componente, ma anche almeno un legame aggiuntivo.
Il legame singolo ha la capacità di rotazione, una proprietà non posseduta dal doppio legame o dal triplo legame. La struttura dei legami pi non consente la rotazione (almeno non a 298 K), quindi il doppio legame e il triplo legame che contengono legami pi sono tenuti a causa di questa proprietà. Il legame sigma non è così restrittivo e il singolo legame è in grado di ruotare usando il legame sigma come asse di rotazione (Moore, Stanitski e Jurs 396-397).
Un altro confronto di proprietà può essere fatto in lunghezza del legame. I singoli legami sono il più lungo dei tre tipi di legami covalenti poiché l’attrazione interatomica è maggiore negli altri due tipi, doppio e triplo. L’aumento dei legami componenti è la ragione di questo aumento di attrazione poiché più elettroni sono condivisi tra gli atomi legati (Moore, Stanitski e Jurs 343).
I singoli legami sono spesso visti nelle molecole biatomiche. Esempi di questo uso di singoli legami includono H2, F2 e HCl.
I singoli legami sono anche visti in molecole composte da più di due atomi. Esempi di questo uso di legami singoli includono:
- Entrambi i legami in H2O
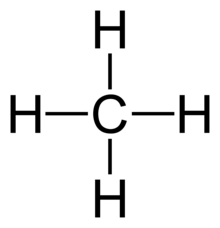
- Tutti e 4 i legami in CH4
Il legame singolo appare anche in molecole complesse come gli idrocarburi più grandi del metano. Il tipo di legame covalente negli idrocarburi è estremamente importante nella nomenclatura di queste molecole. Gli idrocarburi contenenti solo legami singoli sono indicati come alcani (Moore, Stanitski e Jurs 334). I nomi di molecole specifiche che appartengono a questo gruppo terminano con il suffisso-ane. Gli esempi includono etano, 2-metilbutano e ciclopentano (Moore, Stanitski e Jurs 335).