L’aggiunta di idrogeno a un doppio legame carbonio-carbonio è chiamata idrogenazione. L’effetto complessivo di tale aggiunta è la rimozione riduttiva del gruppo funzionale a doppio legame. La regioselettività non è un problema, poiché lo stesso gruppo (un atomo di idrogeno) è legato a ciascuno dei carboni a doppio legame. La fonte più semplice di due atomi di idrogeno è l’idrogeno molecolare (H2), ma la miscelazione di alcheni con idrogeno non provoca alcuna reazione distinguibile. Sebbene la reazione di idrogenazione complessiva sia esotermica, un’elevata energia di attivazione impedisce che si verifichi in condizioni normali. Questa restrizione può essere aggirata mediante l’uso di un catalizzatore, come mostrato nello schema seguente.
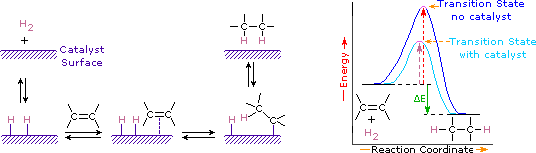
I catalizzatori sono sostanze che modificano la velocità (velocità) di una reazione chimica senza essere consumate o apparire come parte del prodotto. I catalizzatori agiscono abbassando l’energia di attivazione delle reazioni, ma non modificano l’energia potenziale relativa dei reagenti e dei prodotti. I metalli finemente divisi, come platino, palladio e nichel, sono tra i catalizzatori di idrogenazione più utilizzati. L’idrogenazione catalitica avviene in almeno due fasi, come illustrato nel diagramma. In primo luogo, l’alchene deve essere adsorbito sulla superficie del catalizzatore insieme ad alcuni dell’idrogeno. Successivamente, due idrogeni si spostano dalla superficie metallica ai carboni del doppio legame e l’idrocarburo saturo risultante, che è più debolmente adsorbito, lascia la superficie del catalizzatore. La natura esatta e la tempistica degli ultimi eventi non è ben compresa.
Come mostrato nel diagramma di energia, l’idrogenazione degli alcheni è esotermica e il calore viene rilasciato corrispondente al ΔE (colorato verde) nel diagramma. Questo calore di reazione può essere utilizzato per valutare la stabilità termodinamica di alcheni con diversi numeri di sostituenti alchilici sul doppio legame. Ad esempio, la seguente tabella elenca i riscaldamenti di idrogenazione per tre alcheni C5H10 che danno lo stesso prodotto alcano (2-metilbutano). Poiché un grande calore di reazione indica un reagente ad alta energia, questi riscaldamenti sono inversamente proporzionali alle stabilità degli isomeri alchenici. Ad un’approssimazione approssimativa, vediamo che ogni sostituente alchilico su un doppio legame stabilizza questo gruppo funzionale di un po ‘ più di 1 kcal/mole.
| Alchene Isomero | (CH3)2CHCH=CH2 3-metil-1-butene |
CH2=C(CH3)CH2CH3 2-metil-1-butene |
(CH3)2C=CHCH3 2-metil-2-butene |
|---|---|---|---|
| Calore di Reazione ( ΔHº ) |
-30.3 kcal/mole | -28.5 kcal/mole | -26.9 kcal/mole |
Dal meccanismo mostrato qui ci aspetta l’aggiunta di idrogeno si verifica con syn-stereoselettività. Questo è spesso vero, ma i catalizzatori di idrogenazione possono anche causare l’isomerizzazione del doppio legame prima dell’aggiunta di idrogeno, nel qual caso la stereoselettività può essere incerta.
La formazione di complessi di metalli di transizione con alcheni è stata dimostrata in modo convincente dall’isolamento di complessi di platino stabili come il sale di Zeise, K. H2O e etilenebis(trifenilfosfina)platino, 2Pt(H2C=CH2). In quest’ultimo, il platino è a tre coordinate e zero-valente, mentre il sale di Zeise è un derivato del platino(II). Un modello del sale di Zeise e una discussione sul legame insolito in tali complessi possono essere visualizzati cliccando qui. Complessi simili sono stati riportati per nichel e palladio, metalli che funzionano anche come catalizzatori per l’idrogenazione dell’alchene.
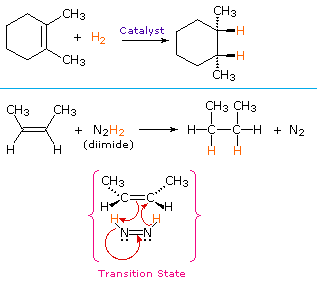
Una procedura non catalitica per l’addizione di idrogeno fa uso del composto instabile diimmide, N2H2. Questo reagente deve essere appena generato nel sistema di reazione, di solito per ossidazione dell’idrazina, e la reazione fortemente esotermica è favorita dall’eliminazione del gas azoto (un composto molto stabile). La diimide può esistere come isomeri cis-trans; solo l’isomero cis funge da agente riducente. Di seguito sono riportati esempi di riduzioni di alcheni con entrambe le procedure.
Collaboratori
- William Reusch, Professore Emerito (Michigan State University), Virtuale Libro di testo di Chimica Organica