A Microbial Biorealm page on the genus Enterococcus faecalis
Classification
Higher order taxa
Bacteria; Firmicutes; Bacilli; Lactobacillales; Enterococcaceae; Enterococcus
Specie
Enterococcus faecalis
Descrizione e significato
Gli enterococchi sono cocchi gram-positivi che possono sopravvivere a condizioni difficili in natura. Possono essere trovati nel suolo, nell’acqua e nelle piante. Alcuni ceppi sono utilizzati nella produzione di alimenti, mentre altri sono la causa di gravi infezioni umane e animali (ad esempio sono noti per colonizzare il tratto gastrointestinale e genitale degli esseri umani). Sono associati sia alle infezioni acquisite in comunità che in ospedale. Gli enterococchi possono crescere a temperature comprese tra 10 e 42 ° C e in ambienti con valori di pH ampi. Alcuni sono noti per essere mobili. Mentre ci sono oltre 15 specie del genere Enterococcus, 80-90% degli isolati clinici sono E. faecalis (8). Gli enterococchi in genere formano catene corte o sono disposti a coppie. Tuttavia, in determinate condizioni di crescita, si allungano e appaiono cocobacillari. In generale, gli enterococchi sono alfa-emolitici. Alcuni possiedono l’antigene Lancefield del gruppo D e possono essere rilevati utilizzando test di agglutinazione basati su anticorpi monoclonali.Gli enterococchi sono tipicamente catalasi negativi e sono anaerobici. Sono in grado di crescere nel 6,5% di NaCl, possono idrolizzare l’esculina in presenza di sali biliari del 40% e sono pirrolidonil arilamidasi e leucina arilamidasi positivi (8). Gli enterococchi hanno dimostrato di presentare una sfida terapeutica a causa della loro resistenza a molti farmaci antimicrobici, “compresi gli agenti attivi della parete cellulare; aminoglicosidi, penicillina e ampicillina e vancomicina” (1). Gli enterococchi hanno la capacità di acquisire un’ampia varietà di fattori di resistenza antimicrobica, che presentano gravi problemi nella gestione dei pazienti con infezioni enterococciche (8). In generale, gli isolati enterococcici con ridotta suscettibilità alla vancomicina possono essere classificati come vanA, vanB e VAN. vanA e vanB rappresentano la più grande minaccia perché sono i più resistenti e i geni di resistenza sono trasportati su un plasmide. Poiché i geni di resistenza sono trasportati su un plasmide sono facilmente trasferibili, E. faecalis può trasferire questi plasmidi mediante coniugazione (2). E. le feci sono anche resistenti alla teicoplanina. Sono stati trovati ceppi enterococcici che dipendono dalla vancomicina, ma sono rari e meno comuni dei ceppi resistenti alla vancomicina (denominati “enterococchi resistenti alla vancomicina” o “VRE”) (1).
struttura del Genoma

A causa di molti pericoli per la salute pubblica, i dati di sequenza del genoma da un ceppo di enterococco era necessario. Il ceppo scelto per il sequenziamento del DNA del genoma è stato E. faecalis V583, il primo isolato resistente alla vancomicina negli Stati Uniti. Il genoma del ceppo V583 è stato sequenziato dall’Istituto per la ricerca sul genoma (TIGR). Il genoma enterococcico mostra che E. faecalis è metabolicamente diverso e contiene una vasta gamma di sistemi normativi. Ceppo V583 contiene quattro molecole di DNA: il principale 3.218.030 coppia di base cromosoma batterico e tre plasmidi circolari. Il cromosoma contiene circa 3.500 open reading frames (ORFs), circa 1/3 di questi ORFs non hanno funzione assegnabile (8). I tre plasmidi sono molecole di DNA circolari identificate come Plasmid-1, Plasmid-2 e Plasmid-3. Plasmid-1 contiene 66.320 bp, Plasmid-2 contiene 17.963 bp e Plasmid-3 contiene 57.660 bp. I plasmidi codificano un certo numero di geni, tra cui trasposasi, proteine di resistenza multi-farmaco e un inibitore della crescita regolato da ppGpp (8). La composizione media G + C del cromosoma E. faecalis è del 37,38%. Poiché la molecola di DNA è così grande, si verificano deviazioni regionali dalla media. Una di queste posizioni è il grande segmento associato al “cluster di geni di resistenza alla vancomicina posizionato vicino a 2.22 Mb”, che mostra un grande aumento del contenuto percentuale di G+C (8). Queste differenze associate alla resistenza agli antibiotici o alla virulenza hanno suggerito l’acquisizione di materiale genetico da una specie estranea attraverso il trasferimento orizzontale. Non è ancora noto se i trasferimenti siano responsabili delle variazioni nella composizione del DNA. Le informazioni contenute nel genoma di E. faecalis V583 aiuterà notevolmente la comprensione di come l’organismo si è adattato per essere un patogeno umano versatile. Utilizzando la genomica comparativa, il ruolo dei diversi elementi normativi sarà meglio compreso nel modo in cui rispondono ai vari stress ambientali e nell’espressione di potenziali fattori di virulenza (8). Altri studi come questi suggeriranno nuovi farmaci per le infezioni batteriche causate dagli enterococchi.Il genoma contiene anche 3 Ebp (codifica per l’endocardite biofilm-associated pili) operoni che sono importanti per la produzione di biofilm di E. faecalis ceppo OG1RF. Questo ceppo utilizza questi operoni per produrre pili di superficie. . I pili superficiali sono utilizzati per “l’attaccamento alle superfici ospiti e sono antigenici nell’uomo durante l’endocardite” (9).
Il TIGR contiene un elenco completo dei geni per i cromosomi E. faecalis.
Struttura cellulare e metabolismo
Metabolismo cellulare
Gli enterococchi abitano ambienti difficili, come i tratti intestinali di esseri umani e animali. La crescita in queste condizioni ostili richiede che E. faecalis abbia un metabolismo flessibile. E. faecalis sono in grado non solo di fermentazione per produrre acido lattico, ma anche in grado di “da uno spettro di fonti di energia dai carboidrati, glicerolo, lattato, malate, citrato, diamino acidi e manya-cheto acidi” (3).È stato dimostrato che in selezionati condizioni di crescita e E. faecalis può aumentare la crescita attraverso la fosforilazione ossidativa utilizzando un protone forza motrice stabilito dal trasporto degli elettroni. Una conseguenza della “respirazione nascente è la produzione di potenti ossidanti” (ad esempio superossido e perossido di idrogeno), lo stress ossidativo che l’E. faecalis può tollerare (3). La tolleranza di questo stress, combinata con altre gravi condizioni di crescita, consente all’E. faecalis di crescere a 10-45°C, nei sali biliari e a PH estremamente bassi e alti. Inoltre, E. faecalis può resistere all’azide, ai detergenti, ai metalli pesanti e all’etanolo. Poiché E. faecalis può utilizzare varie fonti di zucchero, può vivere in ambienti diversi, specialmente nell’intestino dove i nutrienti sono limitati (2). Nell’intestino, E. faecalis ricava la maggior parte della loro energia dalla fermentazione degli zuccheri non assorbiti. E. le fecali possono anche ottenere energia degradando le mucine, un carboidrato fortemente glicosilato e prodotto dalle cellule caliciformi intestinali (2).L’E. faecalis utilizza un ” sistema di fosfoenolipiruvato fosfotransferasi (PTS) per rilevare gli zuccheri al di fuori della cellula e accoppia l’assorbimento degli zuccheri con la fosforilazione” (2). In tal modo, viene sprecata meno energia (ATP) rispetto al modo in cui lo zucchero viene accumulato dai sistemi non PTS. Gli zuccheri metabolizzati da E. faecalis sono: D-glucosio, D-fruttosio, lattosio, maltosio (tutti i substrati PTS). Negli enterococchi, il PTS regola anche il metabolismo del glicerolo, l’espulsione dell’induttore e la repressione dei cataboliti (8). E. faecalis è uno dei pochi batteri Gram-positivi a basso contenuto di G+C che espellono lo zucchero durante la crescita sul glucosio, un fenomeno noto come espulsione dell’induttore (8). E. faecalis può anche fermentare il glicerolo in condizioni aerobiche e microaerofilliche. E. faecalis può anche crescere sul glicerolo in condizioni anaerobiche perché “esprime un gene per l’attività anaerobica della glicerolo deidrogenasi legata a NAD+” (8). Il glicerolo può attraversare la membrana cellulare usando una proteina chiamata glycerol diffusion facilitator (GlpF). Il GlpF rende uguale la concentrazione di glicerolo all’interno e all’esterno della cellula, la proteina è inibita dalla glicolisi. E. faecalis sono in grado di vivere in pH alcalino estremo e alta concentrazione di sale. Questi tratti richiedono il trasporto cationico per mantenere la composizione costante dello cyt citosolico essenziale per l’omeostasi. Tutte le cellule devono espellere il sodio in eccesso per mantenere le concentrazioni citosoliche nell’intervallo che favorisce l’omeostasi. E. faecalis esprime sia un antiporter Na+/H+ che un’ATPasi di tipo vacuolare (2). Il potassio è un importante catione intracellulare. La concentrazione di potassio all’interno di E. faecalis da 0,4 a 0,6 M è essenziale per il normale metabolismo cellulare, “neutralizza gli anioni intracellulari, attiva diversi enzimi e regola il pH citosolico” (8). E. faecalis esprime almeno due trasportatori di potassio per eseguire la regolazione, KtrI e KtrII insieme al sistema Kep per l’estrusione K + (8). Anche se è noto che KtrI e KtrII sono sistemi di assorbimento K + (sono K+/H+ symporters), poco più è noto le proteine.
Struttura cellulare
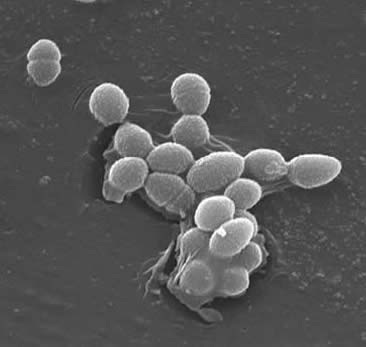
Gli enterococchi sono cocchi Gram-positivi che in genere formano catene corte o sono disposti a coppie (3). In determinate condizioni di crescita possono allungarsi e apparire coccobacillari. La parete cellulare di E. faecalis è dal 20 al 38% del peso delle cellule secche (nelle cellule di fase esponenziale e stazionaria). Dato che l’E. faecalis è un batterio Gram-positivo, ci sono tre componenti principali che costituiscono la sua parete cellulare: peptidoglicano, acido teichoico e polisaccaride. il 40% della parete cellulare è costituito da peptidoglicano, mentre il resto della parete cellulare è costituito da un “polisaccaride contenente ramnosio e un acido teichoico contenente ribitolo” (3). Le funzioni peptidioglicano (come nella maggior parte delle cellule Gram-positive) per resistere scoppio indotto da alta pressione osmotica citoplasmatica. E. faecalis è generalmente considerato un organismo non incapsulato, dimostrato dalla “mancanza di un fenotipo mucoide rilevabile” (3). Tuttavia, sottoinsiemi di isolati di E. faecalis possiedono un polisaccaride capsulare. E. le fecali possono scambiare materiale genetico (plasmidi) mediante processi di coniugazione indotti da piccoli feromoni peptidici (2). Le proteine di superficie “sostanze di aggregazione che riconoscono un ligando specifico sulle cellule riceventi” assicurano connessioni di successo per la coniugazione (2).E. faecalis ha anche la capacità di produrre pili superficiali che possono portare alla formazione di un biofilm. I ceppi di E. faecalis che causano l’endocardite contengono grandi quantità di questi pili. I pili consentono il fissaggio alle superfici ospitanti (ad esempio il tessuto cardiaco). I ceppi di E. le fecali che causano l’endocardite producono il ” biofilm significativamente più spesso e anche in misura maggiore rispetto agli isolati non endocarditi” (9).
Ecologia
E. faecalis è una specie molto varia di enterococchi. Interagisce con molti altri organismi e ha effetti sull’ambiente. Gli enterococchi sono membri della comunità batterica che abita l’intestino crasso negli esseri umani. Sono anche una parte naturale della flora intestinale nella maggior parte degli altri mammiferi e uccelli (8). Gli enterococchi si trovano anche nel suolo, nelle piante e nell’acqua. Quando si trovano in acqua è tipicamente perché l’acqua era stata contaminata con materia fecale. Anche se E. faecalis non appaiono troppo spesso nelle piante, altri ceppi di enterococchi sono stati trovati tra le piante ed è più probabile fare ad una fonte di acqua contaminata (8).L’ecologia della resistenza agli antibiotici e del trasferimento genico della virulenza nell’ambiente non è ancora ben compresa. Gli insetti, come le mosche domestiche (HF), che si sviluppano nel materiale organico in decomposizione possono trasmettere batteri resistenti agli antibiotici dal letame di animali e altri substrati organici in decomposizione agli ambienti residenziali (7). Gli HF sono trasmettitori perfetti a causa delle comunità microbiche vive presenti negli habitat in cui si sviluppano (ad esempio le feci). Alle buone qualità di trasferimento si aggiungono il modo in cui HF alimenta i loro piccoli (rigurgito) e la loro attrazione per il cibo umano. Poiché HF può volare su lunghe distanze, questo insetto è molto buono per la diffusione di batteri fecali, inclusi agenti patogeni umani e animali, e possibilmente ceppi di enterococchi resistenti agli antibiotici (7). Un recente studio ha esaminato la resistenza agli antibiotici e i geni di virulenza negli enterococchi da HF nei ristoranti fast-food di Kanasas. Questo studio ha dimostrato che” le mosche domestiche nelle strutture di manipolazione e servizio degli alimenti possono trasportare enterococchi resistenti agli antibiotici e potenzialmente virulenti che hanno la capacità di trasferire orizzontalmente i geni di resistenza agli antibiotici ad altri batteri ” (7).Gli effetti che E. faecalis ha sull’ambiente tendono ad essere più negativo. In genere contaminano le riserve idriche che possono portare a piante infette e infezioni nelle persone (8). I fattori antibiotici possono anche essere trasportati da vari insetti (ad esempio mosche domestiche) e animali, portando a un numero crescente di E. faecalis virulenti.
Patologia
Gli enterococchi sono emersi come una delle principali cause di infezioni nosocomiali e all’interno di questo gruppo Enterococcus faecalis causa la maggior parte delle infezioni enterococciche umane. Queste infezioni possono essere locali o sistematiche e comprendono infezioni del tratto urinario e dell’addome, infezioni della ferita, batteriemia ed endocardite (2). Poiché E. faecalis è in grado di sopravvivere a numerose sfide ambientali (come temperature estreme e presenza di sali biliari) e perché possono acquisire resistenza a più antibiotici, questi batteri sono diventati un grave problema di salute. Il sistema nazionale di sorveglianza delle infezioni nosocomiali (NNIS) ha segnalato un aumento dell’incidenza di infezioni dovute a enterococchi resistenti alla vancomicina (VRE) dal 1989 (1). Questo può significare gravi problemi di salute, che includono la mancanza di terapia antibiotica disponibile per le infezioni VRE, perché la maggior parte dei ceppi VRE porto resistenza a più antibiotici oltre vancomicina (ad esempio aminoglyscoides e ampicillina). Il trasferimento di geni resistenti alla vanocmicina da VRE ad altri patogeni Gram-positivi è una seria preoccupazione per la salute pubblica. Il modo più comune in cui l’infezione da E. faecalis causa si verifica in un ospedale/struttura di assistenza a lungo termine è la trasmissione di E. faecalis tra i pazienti (8). Gli enterococchi possono essere trasportati dalle mani degli operatori sanitari e trasportati (trasferiti) da un paziente all’altro. È stato dimostrato che il VRE sulle mani può persistere fino a 60 minuti (8). La trasmissione dalle mani di un operatore sanitario al paziente potrebbe avvenire a contatto con i cateteri endovenosi o urinari del paziente. Anche i termometri rettali, non adeguatamente puliti dopo l’uso, possono trasmettere il VRE da paziente a paziente. A volte la trasmissione può provocare la colonizzazione del tratto GASTROINTESTINALE del paziente con il ceppo acquisito. Il nuovo ceppo diventa quindi parte della flora endogena del paziente (8). Il ceppo acquisito, che trasporta geni di resistenza agli antibiotici, è in grado di vivere nel tratto gastrointestinale. Le infezioni quindi derivano da questi ceppi di E. faecalis appena acquisiti.E. faecalis può causare molte infezioni all’interno del corpo umano. L’infezione più comune causata da enterococchi è l’infezione delle vie urinarie. E. faecalis può causare infezioni del tratto urinario inferiore (UTI), come cistisi, prostatite ed epididimite (8). E. faecalis si trovano anche nelle infezioni intra-addominali, pelviche e dei tessuti molli. La E. le feci possono causare batteriemia nosocomiale. La fonte di batteriemia è più spesso il tratto urinario, che si verifica da un catetere endovenoso infetto. L’endocardite è l’infezione enterococcica più grave, in quanto causa l’infiammazione delle valvole cardiache. In molti casi di endocardite, il trattamento antibiotico fallisce e è necessario un intervento chirurgico per rimuovere la valvola infetta (8). Le infezioni meno comuni causate da E. faecalis includono meningite, ematogena, osteomielite, artrite settica e (molto raramente) polmonite. A causa della resistenza degli enterococchi a molti antibiotici, il trattamento di queste infezioni è difficile.
Applicazione alla biotecnologia
Gli enterococchi sono stati studiati per un possibile utilizzo come probiotico (un integratore alimentare che contiene cellule microbiche viventi non virulente che, se ingerite, si pensa influenzino beneficamente la composizione della microflora intestinale). La somministrazione del ceppo E. faecalis ha dimostrato di ridurre la diarrea. I probiotici E. faecalis sono utilizzati nell’alimentazione di pollo/maiale/bestiame per abbassare la diarrea negli animali (8).
A causa delle elevate proprietà che causano malattie di E. faecalis, sono state condotte molte più ricerche su come fermare la virulenza di E. faecalis rispetto all’uso benefico di E. faecalis.
Ricerca attuale
1.) Speranza per le infezioni causate da Enterococcus faecalis (4)
È noto che i batteri resistenti alla vancomicina (ad esempio E. faecalis) pongono molti problemi alla società, causando infezioni batteriche negli esseri umani che sono difficili da trattare. Le infezioni enterococciche sono impegnative perché gli organismi hanno la capacità di acquisire e diffondere rapidamente i geni di resistenza. Ceftobiprolo (BPR) è stato usato come cefalosporina sperimentale contro cocchi Gram-positivi. BPR è una cefalosporina parenterale ad ampio spettro con elevate affinità da proteine gram-positive e Gram-negative che legano la penicillina. Mostra anche stabilità contro l’idrolisi da parte delle β-lattamasi.Questo studio ha esaminato l’attività di BRP contro una vasta collezione di E. faecalis, esaminando l’attività battericida BPR contro isolati resistenti alla vancomicina. Lo studio ha trovato che suscettibile a BPR in E. faecalis non è influenzato dalla presenza di resistenza alla vancomicina o dalla produzione di β-lattamasi. Nei ceppi di E. faecalis che hanno mostrato resistenza alla vancomicina (fenotipi VanA e VanB) o resistenza all’ampiciliina, il BPR è risultato battericida. I ricercatori hanno dimostrato che il BPR ha mostrato attività battericida contro E. faecalis alla dose di 750 mg, inibendo il 100% dell’attività di E. faecalis. Sebbene la presenza dell’enzima β-lattamasi sia rara in E. faecalis, la sua presenza compromette l’uso dei β-lattami anti-enterococcici più efficaci (ad es. ampicillina). BPR è un substrato povero per l’enzima β-lattamasi, spiegando la sua eccellente attività contro la β-lattamasi producendo E. faecalis.Questa ricerca ha dimostrato che il BPR ha una potente attività contro una collezione molto ampia di E. faecalis. L’attività del BPR non è stata influenzata dalla resistenza alla vancomicina o dalla produzione di β-lattamasi. Pertanto, BPR è un agente di speranza per l’uso per il trattamento di β-lattamasi producendo e vancomicina-resistente E. faecalis infezioni negli esseri umani.
2.) Esaminando come Enterococcus faecalis diventa resistente al farmaco linezolid (5)
Quando gli antibiotici vengono utilizzati nel trattamento di un’infezione batterica, possono avere un impatto sulla flora intestinale. I batteri resistenti possono essere selezionati durante il trattamento, come gli enterococchi, e sono potenzialmente patogeni. L’emergere di resistenza è un problema per i nuovi antibiotici perché potrebbe rischiare l’utilità degli antibiotici.Questo studio ha esaminato l’emergere di resistenza agli antibiotici da parte di E. faecalis. Più specificamente, i ricercatori hanno esaminato la resistenza al linezolid (il primo di una nuova classe di antibiotici noti come “ossazolidinoni”). Linezolid può essere usato contro cocchi Gram-positivi resistenti ai farmaci multipli, incluso VRE. Inibisce la sintesi proteica batterica legandosi specificamente a un dominio nella subunità ribosomiale degli anni ‘ 50 e non è influenzato dai meccanismi di resistenza che influenzano altri antibiotici. Questo studio ha esaminato il tasso di comparsa di mutanti E. faecalis resistenti ai linezolidi nel tratto digestivo dei topi gnotobiotici. Il fa di linezolid è stato alimentato in acqua con dosi variabili da 0,5, 0,005 a 0,005 g/L. I mutanti erano tutti dipendenti dal linezolid somministrato, i livelli di resistenza aumentavano con la durata dell’esposizione. Nessun mutante è stato isolato in assenza di linezolid, suggerendo che la resistenza de novo a linezolid era rara negli enterococchi.La ricerca ha scoperto che una mutazione in un singolo gene rRNA 23S era il passo critico nell’emergere della resistenza ai linezolidi. La colonizzazione primaria con mutanti a mutazione singola è stata osservata già 5 giorni dopo l’inizio del trattamento nei topi.Questi esperimenti che coinvolgono topi aiutano a spiegare il modello di comparsa di resistenza al linezolid osservato in isolati clinici. Il team di ricerca ha dimostrato che la dose è fondamentale per la dinamica della resistenza. Questi risultati dovrebbero aiutare a definire le migliori strategie terapeutiche per ridurre al minimo l’emergere di resistenza nell’ambiente clinico, possibilmente salvando molte vite.
3.) Una chinasi Ser/Thr in Enterococcus faecalis è trovata per mediare la resistenza antimicrobica (6)
Enterococcus faecalis causa molte delle infezioni resistenti agli antibiotici negli ospedali, una conseguenza della sua resistenza intrinseca ad alcuni antibiotici e della sua capacità di sopravvivere e proliferare nel tratto intestinale.La base genetica della resistenza visto in E. faecalis non è ben noto, questa ricerca tenta di identificare una causa della resistenza. I ricercatori hanno dimostrato che PrkC, una proteina di segnalazione monocomponente contenente un dominio di chinasi Ser/Thr di tipo eucariotico, consentiva una resistenza antimicrobica intrinseca e una persistenza intestinale di E. faecalis. Hanno scoperto che un mutante E. faecalis privo di PrkC è cresciuto a un ritmo selvaggio in assenza di stress antimicrobico, ma ha mostrato una maggiore sensibilità ai composti attivi dell’involucro cellulare, compresi gli antibiotici che hanno mirato alla biogenesi della parete cellulare e ai detergenti biliari.PrkC regola i processi fisiologici in E. faecalis che sono la chiave del suo successo come agente patogeno nosocomiale. La struttura prevista dei ricercatori di PrkC era un dominio della chinasi citoplasmatica separato da un segmento transmembrana pensato per legare peptidoglicano uncross-linked. Ciò ha suggerito che PrkC era un recettore transmembrana che monitora l’integrità della parete cellulare di E. faecalis e media le risposte adattive per mantenere quell’intergrità. PrKC è importante per E. fecale per causare infezioni nosocomiali, suggerendo che la proteina di segnalazione è un bersaglio per lo sviluppo di terapie per prevenire le infezioni da enterococchi resistenti agli antibiotici.
1. I. T. Paulsen, L. Banerjei, G. S. A. Myers, K. E. Nelson, R. Seshadri, T. D. Di Lettura, D. E. Fouts, J. A. Eisen, S. R. Gill, J. F. Heidelberg, H. Tettelin, R. J. Dodson, L. Umayam, L. Brinkac, M. Beanan, S. Daugherty, R. T. DeBoy, S. Durkin, J. Kolonay, R. Madupu, W. Nelson, J. Vamathevan, B. Tran, J. Upton, T. Hansen, J. Shetty, H. Khouri, T. Utterback, D. Radune, K. A. Ketchum, B. A. Dougherty, C. M. Fraser. “Ruolo del DNA mobile nell’evoluzione di vancomicina-resistente Enterococcus faecalis.” Scienza. Marzo 2003. Vol. 299, n. 5615. pag. 2071-2074
2.) Murrary ESSERE. Maggio 1998. “Diversità tra gli enterococchi multiresistenti.”Malattie infettive emergenti. Vol. 4, n. 1. pag. 46-65.
3.) De la Maza, Luis M., Marie T. Pezzlo e Janet T. Shigei. Atlante di colore della batteriologia medica. Washington, DC: American Society for Microbiology Press, 2004.
4.) Arias C., Singh K., Panesso D., Murray BE. “Time-Kill and Synergism Studies of Ceftobiprole against Enterococcus faecalis, Including ß-Lactamase-Producing and Vancomycin-Resistant Isolates.”Agenti antimicrobici e chemioterapia. Giugno 2007. Vol. 51, n. 6. pag. 2043-2047.
5.) Bourgeois-Nicolaos N., Massias L., Couson B., Butel MJ, Andremont A., Doucet-Populaire F. ” Dipendenza da dose di emergenza di resistenza a Linezolid in Enterococcus faecalis in Vivo.”The Journal of Infectious Diseases. 2007. Vol. 195. pag. 1480-1488.
6.) Kristich C., Wells C., Dunny G. “Una chinasi Ser/Thr di tipo eucariotico in Enterococcus faecalis media la resistenza antimicrobica e la persistenza intestinale.”Proceedings of the National Academy of Sciences of the United States of America. Febbraio 2007. Vol. 104, n. 9. pag. 3508-3513.
7.) Macovei, L., Zurek, L. ” Ecologia dei geni di resistenza agli antibiotici: caratterizzazione degli enterococchi da mosche domestiche raccolte in ambienti alimentari.”Microbiologia applicata e ambientale. Giugno 2006. Vol. 72, n. 6. pag. 4028-4035.
8.) Gilmore, Michael. Gli enterococchi: patogenesi, Biologia molecolare e resistenza agli antibiotici. Washington, DC: American Society for Microbiology Press, 2002.
9.)Nallapareddy SR, Singh KV, Sillanpää J, Garsin DA, Höök M, Erlandsen SL, Murray BE.. “Endocardite e pili biofilm-associati di Enterococcus faecalis.”The Journal of Clinical Investigation. Ottobre 2006. Numero 116. pag.2799-2807.
A cura di Richard A. Martinez di UC San Diego, studente di Rachel Larsen.