Chemguide: Core Chimica 14 – 16
Doppi e tripli legami covalenti
Questa pagina introduce la possibilità di multiple (doppie o triple) legami covalenti tra gli atomi di ossigeno, azoto, anidride carbonica e etene come esempi. Questi sono scelti perché sono tutti comunemente specificati nei programmi del Regno Unito per i 14-16 anni.
Presumo che tu abbia letto la pagina che introduce il legame covalente e abbia accesso a una Tavola periodica come quella che puoi scaricare da questo sito.
Doppio legame in ossigeno
Se cerchi l’ossigeno sulla Tavola periodica, scoprirai che ha un numero atomico di 8 – e quindi l’atomo neutro ha 8 protoni e 8 elettroni. Questi saranno disposti 2,6.
Quindi hai due atomi come questo:
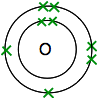
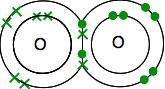
Ognuno ha due elettroni spaiati. Per ottenere la massima stabilità energetica, tutti questi dovranno essere accoppiati.
Quindi gli ossigeni condividono due coppie di elettroni:
Questo è molto più facile da vedere utilizzo di linee di rappresentare le coppie di elettroni condivisi:
![]()
Triplo legame azoto
Se si trova di azoto nella Tavola Periodica, sarete in grado di capire che la sua struttura elettronica è di 2,5. Confrontandolo con l’ossigeno, ha quindi una coppia di elettroni e tre elettroni spaiati nel suo livello esterno.
Per renderlo il più energeticamente stabile possibile, dovrà accoppiare tutti questi in legami covalenti. Due atomi di azoto sarà, quindi, si fondono in questo modo:
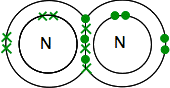
Ancora una volta, questo è molto più facile da vedere utilizzo di linee di rappresentare le coppie di elettroni condivisi:
![]()
Doppio legame in biossido di carbonio
in Carbonio della struttura elettronica è di 2,4 con 4 elettroni spaiati nel livello esterno.
L’ossigeno è 2,6 con 2 coppie di elettroni e 2 elettroni spaiati nel livello esterno.
Devi finire con tutti gli elettroni accoppiati – e c’è solo un modo per farlo.
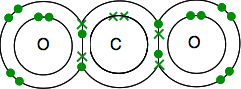
Come prima, il legame è più facile da vedere usando le linee per legare coppie di elettroni.
![]()
Se ci sono due coppie di elettroni tra due atomi, si chiama, non a caso, un doppio legame. Quindi ogni ossigeno è unito all’atomo di carbonio nel mezzo da un doppio legame.
Il doppio legame in etene, C2H4
L’etene e altri composti simili con doppi legami tra atomi di carbonio sono sostanze importanti in chimica. Li incontrerai più in dettaglio più avanti nel corso.
Guarda attentamente il diagramma di punti e croci e assicurati di capire come tutto si adatta. Deve essere in questo modo in modo che tutti i singoli elettroni sia nei carboni che negli idrogeni siano accoppiati in coppie di legami.
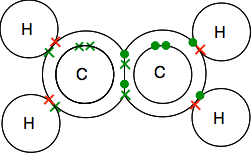
Se ci si imbatte in diagrammi che mostrano le coppie di legame come linee, è possibile trovare una delle due versioni.
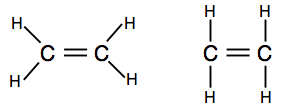
Il primo mostra meglio la forma effettiva della molecola, ma anche il secondo è perfettamente accettabile a questo livello.
Dove vorresti andare ora?
Alla pagina successiva di questa sezione sul legame covalente . . .
Al menu struttura atomica e incollaggio . . .
Al menu Chimica 14-16 . . .
Al menu principale di Chemguide . . .