Che cos’è il legame ionico?
I legami chimici si formano quando l’energia totale degli atomi legati è inferiore all’energia totale degli atomi separati.La forma che assume il legame è determinata dalla disposizione degli elettroni che minimizza l’energia.
In alcuni casi, gli elettroni sono condivisi tra atomi – questo è chiamato legame covalente.
In altri casi, c’è un trasferimento completo di uno o più elettroni da un atomo all’altro.L’atomo che perde elettroni diventa uno ion caricato positivamente.L’atomo che riceve elettroni diventa uno ion caricato negativamente.
Questo porta al legame ionico – la reciproca attrazione elettrostatica di positivo e negativo charges.In la sua forma più pura, il legame ionico non è direzionale. Può essere considerato come semplice attrazione coulombica tra cariche puntuali.Questo è diverso dal legame covalente, in cui la condivisione di elettroni si traduce in legami direzionali.
il Trasferimento di Elettroni
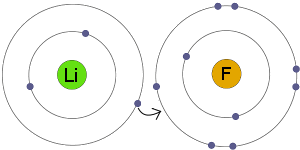
Li trasferisce un elettrone di F. Il risultato è che sia la risultante di ioni e si carica elettricamente, completo, stabile di elettroni conchiglie.
Attrazione Elettrostatica
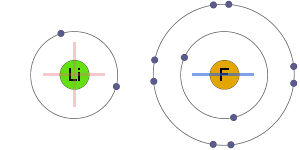
Gli ioni positivi e negativi sono elettrostaticamente attratti l’uno dall’altro, determinando un legame ionico.
La forza coulombica non ha una direzione preferita, con il risultato che i composti ionici tendono ad esistere come strutture reticolari cristalline giganti di ioni imballati insieme.
Un campione di reticolo cristallino del fluoruro di litio

Elettronegatività e legame ionico
Due elementi tenderanno a legarsi ionicamente quando differiscono ampiamente in elettronegatività.
Tavola periodica di Elettronegatività
Più chiara è la tonalità di verde, maggiore è l’elettronegatività. Grigio significa che non è noto alcun valore. (Clicca sull’immagine per ingrandirla.)

Covalent Bonding Character
Absolutely pure ionically bonded compounds do not truly exist, because the positively charged ion polarizes the negative ion’s electron cloud.Ciò è particolarmente evidente quando si tratta di ioni metallici piccoli e altamente carichi come Al3+, sebbene l’effetto polarizzante sia presente in una certa misura in tutti i composti ionici.La polarizzazione è effettivamente un effetto direzionale e di condivisione degli elettroni, quindi introduce una piccola quantità di covalenza nei composti ionici.
La proporzione del comportamento ionico/covalente in un legame può essere valutata molto approssimativamente usando la scala di Pauling dell’elettronegatività.Linus Pauling ha stimato che una differenza di elettronegatività di 1,7 tra gli elementi porta a un legame ionico del 50%.
Valori inferiori a 1 corrispondono al legame covalente dominante e valori superiori a 2 al legame ionico dominante.
Electronegativity of Selected Elements (Pauling Scale)
| Element | Electronegativity |
|---|---|
| hydrogen | 2.20 |
| lithium | 0.98 |
| sodium | 0.93 |
| aluminum | 1.61 |
| carbon | 2.55 |
| oxygen | 3.44 |
| chlorine | 3.16 |
| iodine | 2.66 |
Il legame C-H con una differenza di 0,35 sarà covalente, mentre il legame NaCl a 2,23 sarà ionico.Il legame HCl a 0,96 sarà covalente polare e il legame LiI a 1,68 sarà 50/50 ionico / covalente.
La più grande differenza di elettronegatività è 3.19, tra cesio (0.79) e fluoro (3.98). Il legame risultante è di circa il 95% di carattere ionico.
