I composti antiaromatici sono insolitamente instabili
Quali sono i fattori chiave che determinano se una molecola è antiaromatica?
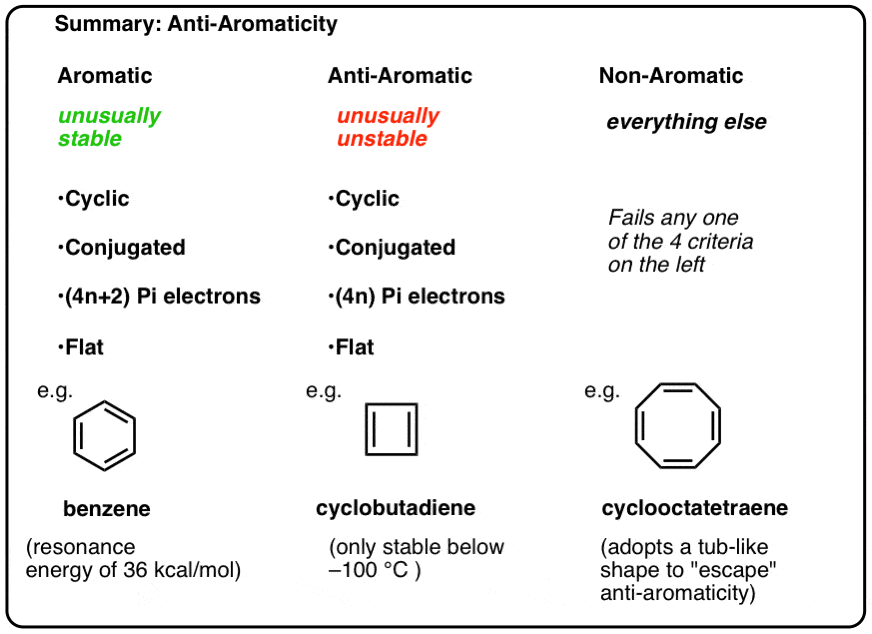
Nei nostri post precedenti nella nostra serie su aromaticità , , abbiamo visto che le molecole aromatiche sono insolitamente stabili. Hanno energie di risonanza particolarmente grandi, tendono a subire reazioni di sostituzione piuttosto che di addizione e hanno elettroni pi delocalizzati (tutte le lunghezze di legame C-C in benzene sono uguali, per esempio).
per essere aromatico, una molecola deve possedere le seguenti quattro caratteristiche strutturali:
- ciclico
- coniugato in tutto il ring
- sono pi elettroni
- piatto (planare)
Se questi quattro condizioni sono soddisfatte, la molecola aromatica.
Se boccia anche una domanda sul test, non è aromatico.
Sembra essere abbastanza chiaro. O lo è?
Potresti intuire dal modo in cui sto inquadrando questa domanda che la risposta è “non del tutto”. : – )
Sommario
- Alcune Molecole Sono Così Spettacolare E particolarmente Instabili E difficili Da Isolare Che Meritano una Categoria a parte:Antiaromatic
- Ciclopentadienil Cazione: La “Risonanza Stabilizzata” Carbocation Che non È Stabile
- Antiaromatic triatomico Anelli: Ossirene, 1H-Azirene, Thiirene
- Cyclobutadiene È Antiaromatic
- 8 Pi-Elettrone Esempio di un Antiaromatic Composto: Pentalene
- Cosa rende una molecola anti-aromatica?
- Cicloottatetraene “sfugge” Anti-aromaticità attraverso torsione di planarità
- Conclusione: Composti antiaromatici
- Note
- Avanzate: Riferimenti e ulteriori letture
1. Molecole straordinariamente instabili che formano una categoria a se stesse: “Anti-aromatico”
Ecco la cosa. C’è un piccolo numero di molecole che bocciano il test di aromaticità che non sono solo non aromatiche: hanno la proprietà di essere così spettacolare e insolitamente instabile e difficile da isolare che meritano un altro nome.
Chiamiamo queste molecole “anti-aromatiche”.
Ciò che è interessante è che in molti casi le molecole stesse non sembrano essere particolarmente instabili dai primi principi, in contrasto con, ad esempio, cubano. Abbastanza divertente, puoi comprare cubano (più o meno) da Aldrich, ma la maggior parte delle molecole anti-aromatiche che discuteremo di seguito sono stabili solo a temperature estremamente basse – se possono essere isolate!
2. Catione ciclopentadienile: La carbocation “stabilizzata dalla risonanza” Che non è stabile
Iniziamo il nostro viaggio nella tana del coniglio con un semplice esempio che dovrebbe sembrare familiare dalla chimica organica del primo semestre.
Ricorda la reazione SN1? Il gatto che lascia la sedia comoda prima?
Recensione rapida: inizia con un alogenuro alchilico. Lasciando le foglie del gruppo, formando un carbocation. Attacchi nucleofili. Si chiama SN1 perché il passo che determina la velocità (formazione di carbocation) è unimolecolare. Linea di fondo: più stabile è la carbocation, più velocemente procede la reazione. Quindi, la velocità di reazione per gli alogenuri alchilici è terziaria > secondaria > primaria, e la carbocation ottiene punti bonus speciali se è stabilizzata dalla risonanza.
Guarda queste due reazioni SN1. Quale pensi che potrebbe accadere più velocemente – la reazione SN1 che passa attraverso una carbocation secondaria (A), o la reazione SN1 che passa attraverso una carbocation secondaria e può formare più forme di risonanza (B)?
Da tutto ciò che hai imparato finora, ti aspetteresti che la risposta sia B).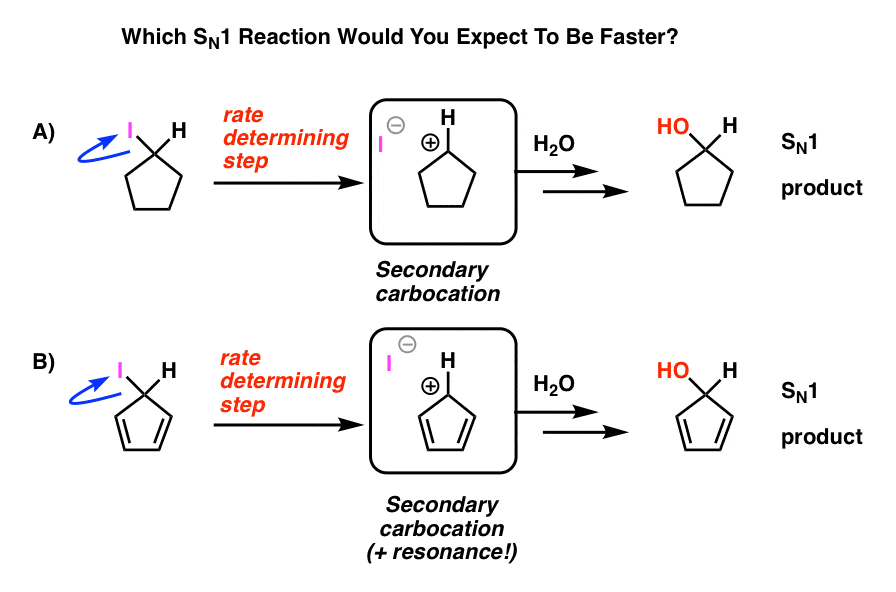
Non lo è.
La risposta è che la reazione A) avviene più velocemente. La reazione B non avviene affatto.
Questo dovrebbe sembrarti profondamente strano.
Lo è!
Come è possibile che questa carbocation presumibilmente stabilizzata dalla risonanza sia meno stabile di una carbocation secondaria?
Dopo tutto, quante volte è forato nella tua testa che la risonanza stabilizza le molecole, specialmente i carbocati?
Ma qui, sembra essere destabilizzante. È

Ma instabile lo è! Il catione ciclopentadienile è incredibilmente instabile e difficile da realizzare – e non è per mancanza di tentativi. C’è qualcosa di molto strano nella struttura del catione ciclopentadienile che gli conferisce un’instabilità insolita.

ciclico, coniugato, piatto…. e ha 4 elettroni pi. Interessante!
3. Anelli antiaromatici a tre membri: Oxirene, 1H-Azirene, Thiirene
Un’altra classe di molecole “elusive” è una famiglia di anelli a tre membri. Si potrebbe ricordare da Org 1 che è facile fare epossidi da alcheni utilizzando un ossidante come m-CPBA.
Vi siete mai chiesti perché non abbiamo mai coperto la stessa reazione per alchini?
Beh, non è per mancanza di tentativi. I chimici hanno provato tutti i tipi di metodi per epossidare gli alchini, e sai cosa? La reazione non funziona, cazzo.
Ad esempio, l’epossidazione dell’acetilene darebbe la molecola sottostante (ossirene).
Lo stesso Oxirene non è mai stato osservato, sebbene ci siano tracce allettanti della sua fugace esistenza. E a proposito, né l’analogo dell’azoto, 1H-azirene, né il thiirene.
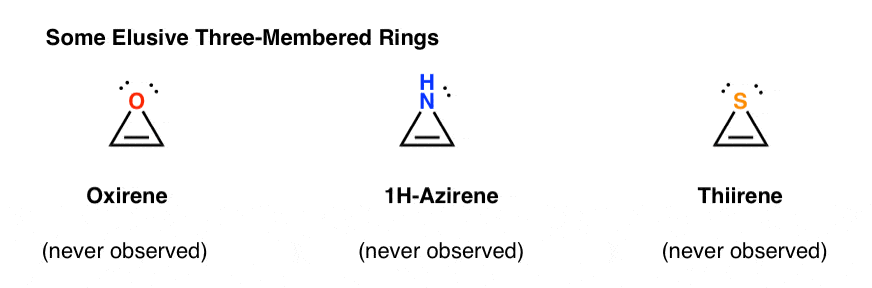
Perché no? Cosa c’è di speciale in ognuno di questi casi?
Potresti notare che, come il catione ciclopentadienile, queste molecole sono cicliche, coniugate, piatte e hanno 4 elettroni pi (due nel legame pi e due da una coppia solitaria).
OK. Cos’altro potrebbe essere ciclico, coniugato, piatto e avere 4 elettroni pi?
4. Il ciclobutadiene è antiaromatico
Il ciclobutadiene sembra una molecola abbastanza semplice, ma in realtà non è stato sintetizzato fino al 1965. E anche allora, si è scoperto che non è stabile a temperature superiori a 35 Kelvin.
La domanda è, perché?

Certo, è un anello a quattro membri, e sì, ha un sacco di tensione dell’anello, ma sono state fatte molecole più tese che sono effettivamente stabili a temperatura ambiente.
Potresti anche notare che, come gli esempi precedenti, il ciclobutadiene è un altro esempio di una molecola che è ciclica, coniugata, ha 4 elettroni pi ed è piatta.
Ciò che è ancora più interessante è ciò che è stato appreso sulla geometria del ciclobutadiene. Piuttosto che essere una molecola con lunghezze di legame identiche (come benzene), ciclobutadiene è stato trovato per avere una forma rettangolare, indicando che gli elettroni non sono stati delocalizzati.
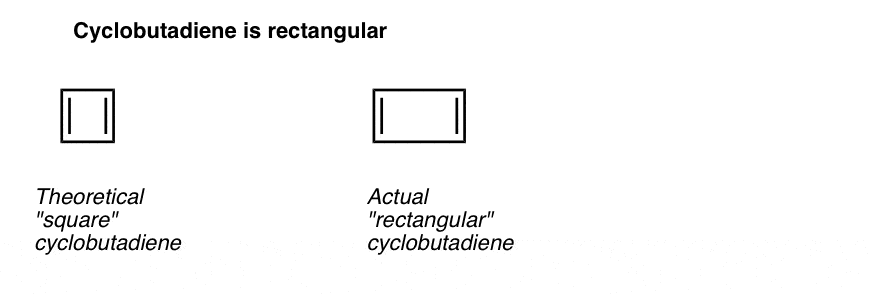
Ciò che questo ci dice è che, anche quando una molecola soddisfa tutte le condizioni (ciclico, coniugato, piatto, 4 pi elettroni), la geometria simmetrica è particolarmente instabile. . Molto interessante!
Un esempio a 8 elettroni Pi di un composto antiaromatico: Pentalene
Finora tutti gli esempi che abbiamo visto finora avevano 4 elettroni pi. Ci si potrebbe chiedere: ci sono esempi di molecole anti-aromatiche che hanno più di 4 elettroni pi? Beh, si’.
La molecola sottostante è chiamata “Pentalene”. È stato sintetizzato, ma è stabile solo al di sotto di -100 °C. Al di sopra di questa temperatura si combina con un’altra molecola di se stessa (riferimento). Un altro esempio di instabilità spettacolare.

Il pentalene ha 8 elettroni pi. Questo potrebbe innescare alcuni campanelli d’allarme di riconoscimento. Ricorda come il numero di elettroni pi nelle molecole aromatiche ha seguito la sequenza (2, 6, 10, 14….) ?
Questo esempio suggerisce che il numero di elettroni pi nelle molecole anti-aromatiche segue la sequenza (4, 8, 12…)
Cosa rende una molecola anti-aromatica?
Quindi cosa hanno in comune tutte queste molecole in questa galleria di ladri?
Ognuno di essi è ciclico, coniugato e piatto – e quando si conta il numero di elettroni pi, è multiplo di 4. Quindi, mentre le molecole aromatiche hanno (4n + 2) elettroni pi, la “regola” per le molecole anti aromatiche è (4n). (un altro modo per guardarlo: il numero di elettroni pi sarà il doppio di un numero pari).
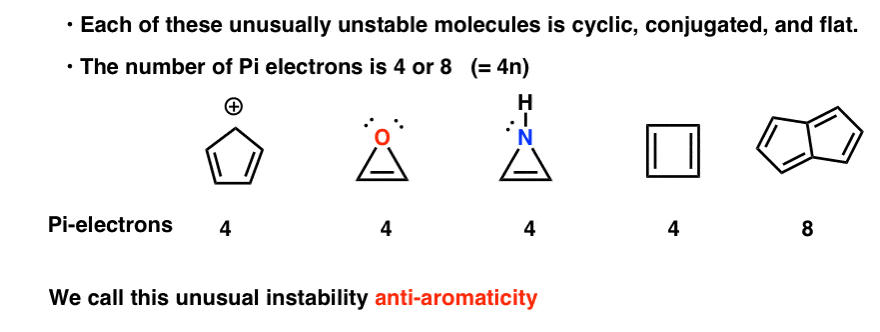
Questa insolita instabilità è chiamata “anti-aromaticità”.
Ciò significa che ora possiamo elaborare tre categorie per molecole secondo i seguenti criteri:
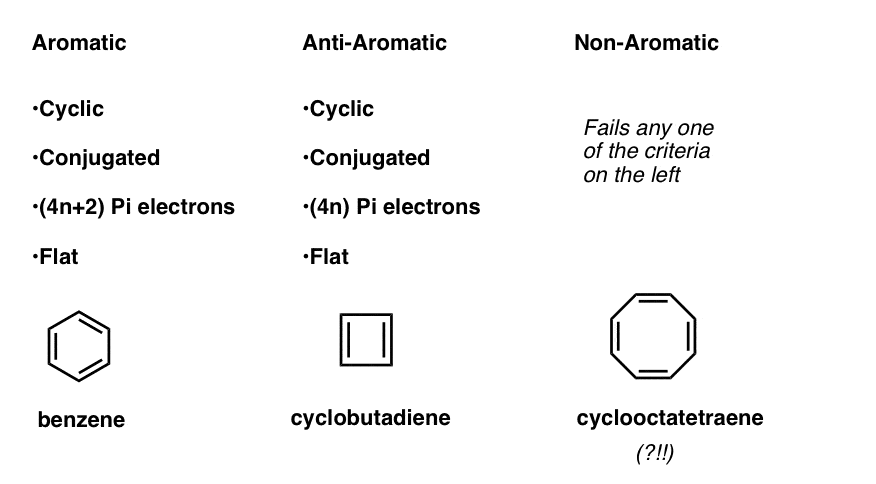
- Le molecole aromatiche sono cicliche, coniugate, hanno (4n+2) elettroni pi e sono piatte.
- Le molecole anti-aromatiche sono cicliche, coniugate, hanno elettroni (4n) pi e sono piatte.
- Le molecole non aromatiche sono ogni altra molecola che fallisce una di queste condizioni.
Aspetta un secondo-potresti chiederti perché il cicloottatetraene è classificato come”non aromatico”. Con 8 elettroni pi (due volte un numero pari) non dovrebbe essere “anti-aromatico”?
Il cicloottatetraene “sfugge” all’anti-aromaticità attraverso la torsione dalla planarità
Pensa di soddisfare le condizioni per “anti-aromaticità” come un po’ come qualificarsi per un’imposta sul reddito estremamente punitiva. Data l’opportunità di trovare una scappatoia per uscire dalla tassa, lo faresti? Probabilmente.
Il cicloottatetraene è anti-aromatico solo se è piatto. Tuttavia, la struttura relativamente “floppy” del cicloottatetraene consente una certa flessibilità. I legami possono ruotare lontano dalla planarità in modo tale che la molecola adotta una forma “tub-like”, evitando così la “tassa antiaromaticità” di 18 12 kcal/mol che verrebbe pagata se tutti i p-orbitali sulla molecola fossero coniugati tra loro.
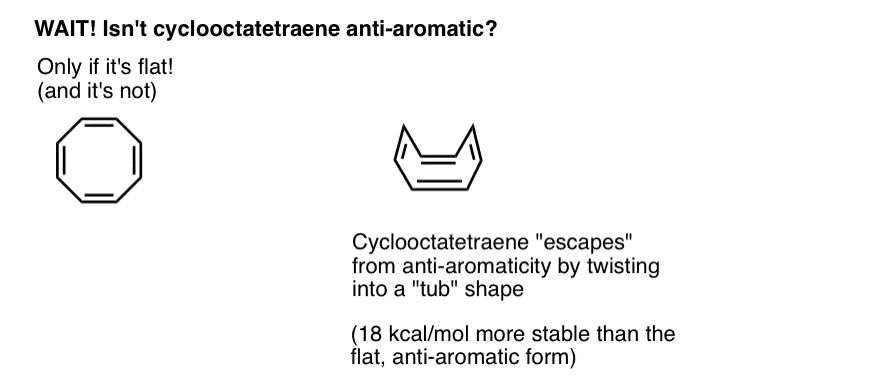
Si scopre che il cicloottatetraene è stato sintetizzato, è stabile (puoi acquistarlo qui, per esempio) e si comporta come un alchene “normale”, subendo reazioni di addizione, idrogenazione e così via.
Il pentalene (sopra) che ha anche 8 elettroni pi, ha una struttura biciclica molto rigida che impedisce la rotazione del legame lontano dalla planarità. Quindi, è bloccato nella sua conformazione anti-aromatica.
L’anti-aromaticità per molecole con più di 8 elettroni pi è nota, ma molto insolita. (Ecco un divertente esempio di un’altra “fuga” dall’aromaticità per una molecola con 18 elettroni pi.)
Conclusione: Composti antiaromatici
Finora il nostro trattamento di aromaticità e anti-aromaticità è stato puramente descrittivo ed empirico. Abbiamo mostrato molti esempi e dato molte regole, ma manca dalla discussione una spiegazione profonda del “perché”.
Cosa c’è di così speciale nell’anello benzenico che lo rende così stabile? Perché è stabile?
Cosa c’è di così speciale nel sistema ciclobutadiene che lo rende così instabile. Perché è instabile?
Per rispondere a queste domande più profonde, dovremo fare un passo indietro ed esaminare gli orbitali molecolari di queste due molecole, per poi giungere a una comprensione più profonda dell’aromaticità e dell’anti-aromaticità.
Questo è quello che faremo nel nostro prossimo post.
Grazie a Matthew Knowe per l’aiuto nella preparazione di questo post.
Note
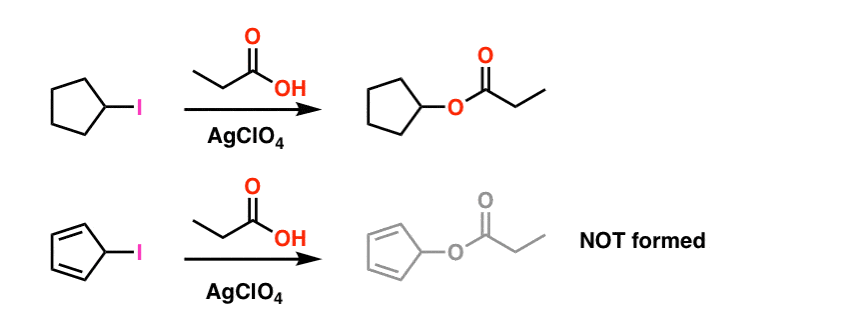
Nota 1. Per semplicità, l’immagine mostrata nell’articolo principale fudges sulle condizioni di reazione effettive. Le condizioni sperimentali effettive sono mostrate di seguito. Il solvente è acido propionico e il perclorato di argento acido di Lewis viene aggiunto per aiutare a estrarre lo iodio. .
Anche in queste condizioni il carbocation ciclopentadienile non si forma, il che è una testimonianza della sua estrema instabilità.
Nota 2. L’epossidazione su etene (aka etilene) è fatta per la somma di 15 milioni di tonnellate, ogni anno. L’epossidazione dell’acetilene per formare ossirene non è nota.
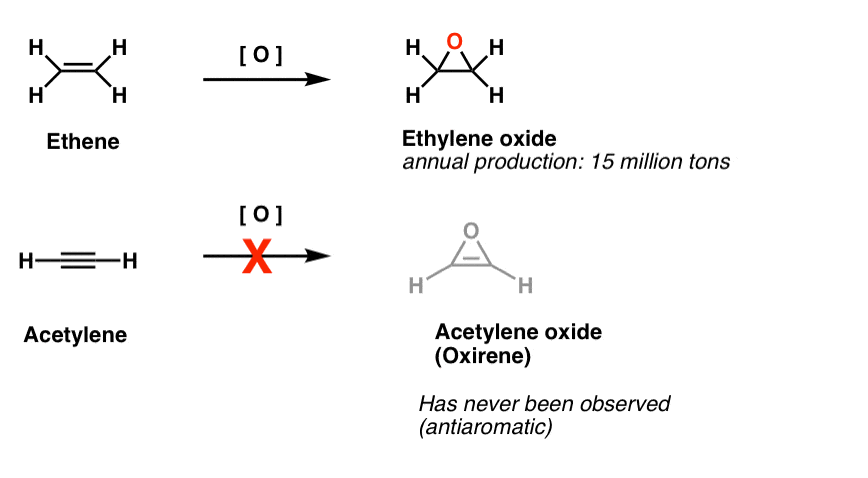
Sono state trovate prove fugaci dell’esistenza di ossireni. Ci sono buone prove da studi di etichettatura degli isotopi che gli ossireni sono intermedi fugaci in alcuni riarrangiamenti di Wolff. Ci sono anche due esempi di ossireni che sono stati intrappolati a temperature estremamente basse, ma decomposti sopra i 35 Kelvin.
La fugace esistenza di una 1H-azirina è stata postulata nell’aggiunta di un nitrene ad un acetilene, che si riorganizza rapidamente in un 2H-azirene (stabile) (sotto).
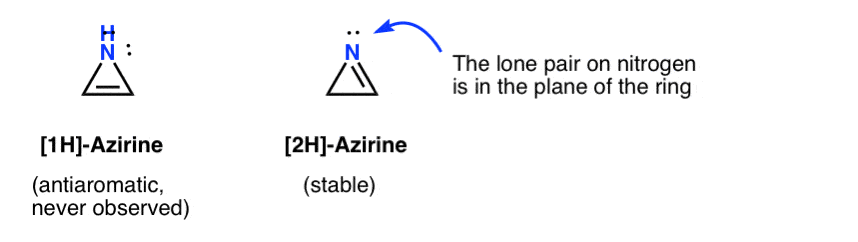
Si noti che in 2H-azirene la coppia solitaria sull’azoto è ad angolo retto rispetto al sistema pi, quindi questo sistema non è aromatico rispetto all’anti-aromatico.
Per ulteriori discussioni, vedi Chimica organica avanzata di marzo. Ho lavorato alla quinta edizione, pagine 62-63.
. Nota 3. Un esperimento molto intelligente ha determinato che il ciclobutadiene 1,2-dideutero ha due isomeri, non uno (vedi sotto). Ciò indica che i doppi legami in ciclobutadiene non sono delocalizzati come sono in benzene, ma sono più simili a doppi legami in un diene convenzionale.
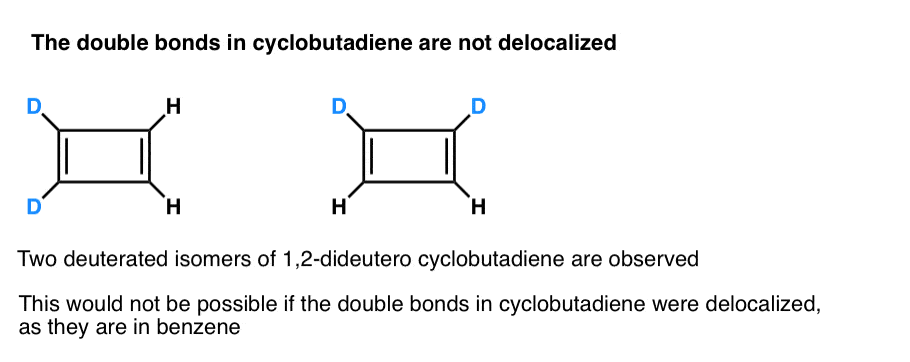
Il ciclobutadiene reagisce con se stesso a 35 K per formare un “dimero”, in un esempio di reazione di Diels-Ontano.
Nota 4. Sì, è vero che la coppia solitaria in azirene può essere messa in un orbitale ibrido sp3 (sotto). Questo probabilmente riduce un po ‘ la “penalità” anti aromatica, ma la molecola è ancora incredibilmente instabile. L’anti-aromaticità è il modo più semplice per spiegare questo.

Nota 5. La geometria rettangolare è dovuta a un effetto noto come effetto Jahn-Teller. Ricordate il principio di esclusione di Pauli, dove gli elettroni non possono avere lo stesso numero quantico? Bene, come vedremo guardando il diagramma orbitale molecolare del ciclobutadiene, il ciclobutadiene “quadrato” ha due elettroni “degenerati”, cioè hanno le stesse energie e numeri quantici. Questo porta ad un fenomeno noto come “repulsione di Pauli”, dove l’allungamento dei legami si verifica fino a quando i livelli di energia dei due elettroni sono differenziati. Sicuramente un argomento avanzato.
(Advanced) References and Further Reading
- Transition-State Spectroscopy of Cycloottatetraene
Paul G. Wenthold, David A. Hrovat, Weston T. Borden, W. C. Lineberger.
Scienza, 1996, 272, 1456-1459.
DOI: 10.1126 / scienza.272.5267.1456
Questo studio è la base per l’affermazione che lo stato fondamentale non aromatico del cicloottatetraene è 12 kcal/mol al di sotto della conformazione “antiaromatica”. - L’addomesticamento del ciclobutadiene
Donald J. Cram, Martin E. Tanner, Robert Thomas
Chem. Int. Ed. 1991, 30 (8), 1024-1027
DOI: 10.1002/anie.199110241
Questo articolo del premio Nobel Prof. Donald J. Cram (UCLA) descrive la prima caratterizzazione spettroscopica del ciclobutadiene. Ciò si ottiene racchiudendo il precursore in un emicarcerand (complesso a gabbia) e quindi irradiandolo con luce UV, creando così ciclobutadiene, che non è in grado di fare nulla poiché è intrappolato. - Ciclobutadiene
Thomas Bally, Satoru Masamune
Tetraedro 1980, 36 (3), 343-370
DOI: 1016/0040-4020(80)87003-7
Questo articolo del 1980 recensisce il lavoro svolto sul ciclobutadiene fino a quel momento. Questo è diviso in 2 parti: sforzi sintetici sperimentali e calcoli teorici. - Tetraedrano e Ciclobutadiene
Günther Maier
Chem. Int. Ed. 1988, 27 (3), 309-332
DOI: 10.1002/anie.198803093
Questo documento esamina gli sforzi sintetici verso tetraedrano e ciclobutadiene – entrambe le molecole hanno una formula di C4H4. Solo i tetraedrani sostituiti (tetra t-butil e tetra trimetilsilil) sono stati sintetizzati e isolati con successo fino ad oggi. - Ciclobutadiene – e benzociclobutadiene-ferro tricarbonile Complessi
F. Emerson, L. Watts, e R. Pettit
Journal of the American Chemical Society 1965, 87 (1), 131-133
DOI: 10.1021/ja01079a032 - Ciclobutadieneiron Tricarbonile. Un nuovo sistema aromatico
D. Fitzpatrick, L. Watts, G. F. Emerson, e R. Pettit
Journal of the American Chemical Society 1965, 87 (14), 3254-3255
DOI: 10.1021/ja01092a050
Un argomento bonus: ciclobutadiene può essere stabilizzato con metalli – il complesso organometallico ciclobutadiene ferro tricarbonile è stabile, solido cristallino. Come menzionano gli autori, è improbabile che il ciclobutadiene libero sia generato nella sintesi. - https://www.asu.edu/courses/chm233/notes/aromatic/aromaticRL1/antiaromatic.html
L’antipsicotico olanzapina adotta una forma a “farfalla” per evitare effetti antiaromatici, simili al cicloottatetraene. Questo è apparentemente fondamentale per la sua funzione. - Antiaromaticità
Ronald Breslow
Accounts of Chemical Research 1973, 6 (12), 393-398
DOI: 1021/ar50072a001
È interessante notare che il Prof. Breslow (Columbia) afferma in questo account che fu la persona a suggerire per prima il termine “antiaromatico” per composti ciclici particolarmente destabilizzati con elettroni 4n p. Cita anche altri lavori del Prof. M. J. S. Dewar e altri in cui la destabilizzazione antiaromatica del ciclobutadiene è calcolata tra 18-33 kcal/mol rispetto al butadiene lineare. - Determinazione sperimentale dell’antiaromaticità del ciclobutadiene
Ashok A. Deniz, Kevin S. Peters, Gary J. Snyder
Scienza 1999, 286 (5442), 1119-1122
DOI: 1126 / scienza.286.5442.1119
Questo è un documento molto rigoroso che utilizza nuove tecniche spettroscopiche per determinare la destabilizzazione antiaromatica del ciclobutadiene. Rispetto ad un ipotetico riferimento di diene coniugato senza sforzo, il ciclobutadiene è destabilizzato da un totale di 87 kcal/mol, di cui 32 kcal/mol attribuibili al ceppo ad anello e 55 kcal/mol all’antiaromaticità (rispetto a 21 kcal/mol per la stabilizzazione aromatica del benzene). - Insostituito ciclopentadienil cazione, una terra-stato di tripletto
Saunders, R. Berger, A. Jaffe, J. M. McBride, J. O’Neill, R. Breslow, J. M. Hoffmann, C. Perchonock, E. Wasserman, R. S. Hutton, V. J. Kuck
Journal of the American Chemical Society 1973, 95 (9), 3017-3018
DOI: 10.1021 / ja00790a049
Il catione ciclopentadienile può essere preparato solo con difficoltà, come descritto in questo documento. Una volta formato, ha uno stato fondamentale elettronico a tripletta (con 2 elettroni spaiati) e può essere caratterizzato dalla spettroscopia EPR (electron paramagnetic resonance). - Oxirenes
Errol G. Lewars
Chemical Reviews 1983, 83( 5), 519-534
DOI: 10.1021 / cr00057a002