Tendenze periodiche ed effetti dei solventi nella nucleofilia
Ci sono tendenze periodiche prevedibili nella nucleofilia. Spostandosi orizzontalmente attraverso la seconda riga della tabella, la tendenza della nucleofilia è parallela alla tendenza della basicità:
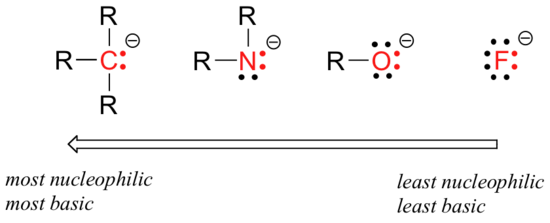
Il ragionamento dietro la tendenza nucleofila orizzontale è lo stesso del ragionamento dietro la tendenza alla basicità: più elementi elettronegativi tengono i loro elettroni più strettamente e sono meno in grado di donarli per formare un nuovo legame.
Questa tendenza orizzontale ci dice anche che le ammine sono più nucleofile degli alcoli, sebbene entrambi i gruppi agiscano comunemente come nucleofili sia nelle reazioni di laboratorio che biochimiche.
Ricordiamo che la basicità degli atomi diminuisce mentre ci muoviamo verticalmente lungo una colonna sulla tavola periodica: gli ioni tiolati sono meno basici degli ioni alcossido, ad esempio, e lo brom bromuro è meno basico dello chloride cloruro, che a sua volta è meno basico dello ion fluoruro. Ricordiamo anche che questa tendenza può essere spiegata considerando la dimensione crescente della’ nuvola di elettroni ‘ attorno agli ioni più grandi: la densità elettronica inerente alla carica negativa si sviluppa attorno a un’area più ampia, che tende ad aumentare la stabilità (e quindi a ridurre la basicità).
La tendenza periodica verticale per la nucleofilia è un po ‘ più complicata di quella per la basicità: a seconda del solvente in cui si svolge la reazione, la tendenza alla nucleofilia può andare in entrambe le direzioni. Prendiamo il semplice esempio della reazione SN2 qui sotto:
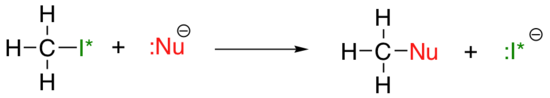
. . .dove Nu-è uno degli ioni alogenuri: fluoruro, cloruro, bromuro o ioduro, e il gruppo di partenza I* è un isotopo radioattivo di iodio (che ci permette di distinguere il gruppo di partenza dal nucleofilo in quel caso in cui entrambi sono ioduro). Se questa reazione si verifica in un solvente protico (cioè un solvente che ha un idrogeno legato ad un ossigeno o azoto – acqua, metanolo ed etanolo sono gli esempi più importanti), allora la reazione andrà più veloce quando lo ioduro è il nucleofilo e più lento quando il fluoruro è il nucleofilo, riflettendo la forza relativa del nucleofilo.

Nucleofilia relativa in un solvente protico
Questo ovviamente è opposto a quello della tendenza periodica verticale per la basicità, dove lo ioduro è il meno basico. Che sta succedendo qui? La base più forte, con i suoi elettroni di valenza non legati più reattivi, non dovrebbe essere anche il nucleofilo più forte?
Come accennato in precedenza, tutto ha a che fare con il solvente. Ricorda, stiamo parlando ora della reazione in esecuzione in un solvente protico come l’etanolo. Le molecole di solvente protico formano interazioni ion-dipolo molto forti con il nucleofilo caricato negativamente, creando essenzialmente una “gabbia solvente” attorno al nucleofilo:

Affinché il nucleofilo possa attaccare l’elettrofilo, deve liberarsi, almeno in parte, dalla sua gabbia solvente. Gli elettroni della coppia solitaria sullo ion ioduro più grande e meno basico interagiscono meno strettamente con i protoni sulle molecole di solvente protico-così il nucleofilo di ioduro è meglio in grado di liberarsi dalla sua gabbia solvente rispetto allo ion fluoruro più piccolo e più basico, i cui elettroni della coppia solitaria sono legati più strettamente ai protoni della gabbia.
L’immagine cambia se passiamo ad un solvente aprotico polare, come l’acetone, in cui c’è un dipolo molecolare ma nessun idrogeno legato all’ossigeno o all’azoto. Ora, il fluoro è il miglior nucleofilo e lo ioduro il più debole.
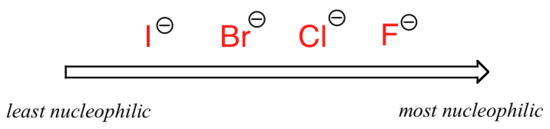
Relativa nucleofilicità in un polar solvente aprotico
La ragione per l’inversione è che, con un solvente aprotico, ione-dipolo interazioni tra solvente e nucleofilo sono molto più deboli: il lato positivo del solvente del dipolo è nascosto all’interno della molecola, e quindi è schermato dalla carica negativa di un nucleofilo.
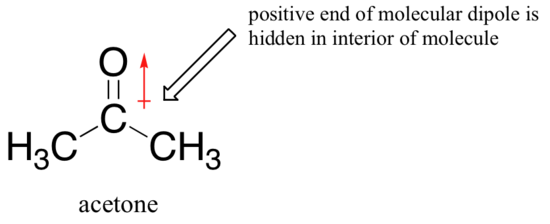
Un’interazione solvente-nucleofilo più debole significa una gabbia solvente più debole per il nucleofilo da sfondare, quindi l’effetto solvente è molto meno importante, e lo ion fluoruro più basico è anche il nucleofilo migliore.
Perché non utilizzare un solvente completamente non polare, come esano, per questa reazione, in modo che la gabbia del solvente sia completamente eliminata? La risposta a questo è semplice: il nucleofilo deve essere in soluzione per reagire ad una velocità apprezzabile con l’elettrofilo, e un solvente come l’esano non risolverà affatto un nucleofilo carico (o altamente polare). Ecco perché i chimici usano solventi aprotici polari per le reazioni di sostituzione nucleofila in laboratorio: sono abbastanza polari da solvatare il nucleofilo, ma non così polari da bloccarlo in una gabbia di solventi impenetrabile. Oltre all’acetone, altri tre solventi aprotici polari comunemente usati sono acetonitrile, dimetilformammide (DMF) e dimetilsolfossido (DMSO).
In chimica biologica, dove il solvente è protico (acqua), l’implicazione più importante delle tendenze periodiche nella nucleofilia è che i tioli sono nucleofili più potenti degli alcoli. Il gruppo tiolico in un amminoacido cisteina, ad esempio, è un potente nucleofilo e spesso agisce come nucleofilo nelle reazioni enzimatiche e, naturalmente, i tiolati caricati negativamente (RS -) sono ancora più nucleofili. Questo non vuol dire che i gruppi idrossilici su serina, treonina e tirosina non agiscano anche come nucleofili – lo fanno.