Obiettivi
- Conosciuti e soluzioni di ioni di metalli di \(\ce{Ag^{+}}\), \(\ce{Fe^{3+}}\), \(\ce{Co^{2+}}\), \(\ce{Cu^{2+}}\) e \(\ce{Hg^{2+}}\) saranno analizzati utilizzando la carta cromatografia.
- Una soluzione sconosciuta contenente alcuni di questi cationi sarà identificata confrontando i valori Rf e i colori delle macchie macchiate di soluzioni note.
La maggior parte dei chimici e molti altri scienziati devono regolarmente separare le miscele e identificare i loro componenti. La capacità di identificare qualitativamente le sostanze trovate in un campione può essere critica. Ad esempio, un chimico ambientale che studia campioni di acque sotterranee inquinate vorrà sapere quali ioni tossici potrebbero essere presenti in un campione.
La cromatografia è uno dei primi strumenti utilizzati in tali situazioni. In questa tecnica, molti tipi di miscele possono essere separati nelle sostanze pure componenti; in confronto a un campione standard, ogni sostanza componente può anche essere identificata provvisoriamente.
Esistono molte varietà di cromatografia, ognuna progettata per separare tipi specifici di miscele. La caratteristica comune di ogni tipo di cromatografia è che una fase mobile (un liquido o un gas) viene spinta attraverso una fase stazionaria (un solido). La tabella 1 elenca diverse varietà di cromatografia e identità tipiche delle fasi. La cromatografia su carta sarà utilizzata in questo esperimento.
|
Type of Chromatography |
Mobile Phase |
Stationary Phase |
|---|---|---|
|
Gas (GC) |
inert gas (helium) |
waxy liquid or silicone inside narrow tubing |
|
Liquid |
solvent/solvent Mixture (organic or aqueous) |
solid packing (silica, alumina) |
|
Paper |
solvent/solvent Mixture (organic or aqueous) |
paper |
|
Thin-Layer (TLC) |
solvent/solvent Mixture (organic or aqueous) |
silica/alumina coated glass, plastic or metal |
L’esempio di cromatografia su colonna (Figura 1) dimostra le caratteristiche tipiche di questa tecnica analitica. Il diagramma mostra un esperimento in cui una miscela bicomponente viene sottoposta a cromatografia su colonna. La colonna è imballata con un materiale solido chiamato fase stazionaria. Un solvente liquido o una soluzione eluente viene versato nella colonna e bagna completamente il materiale di imballaggio solido. Quindi la miscela viene caricata sulla parte superiore della colonna bagnata e viene aggiunto più eluente. Gravità tira la fase mobile verso il basso attraverso la fase stazionaria e le componenti nella miscela iniziano a muoversi attraverso la colonna a velocità diverse. Nel diagramma, il componente A si muove più velocemente del componente B; quindi il componente B viene trattenuto sulla colonna per un tempo più lungo rispetto al componente A. Di solito ciò è dovuto a una differenza di solubilità dei due composti nel solvente e/o a una differenza di attrazione per il materiale di imballaggio solido. Come più eluente viene aggiunto alla parte superiore della colonna, i componenti finiranno per uscire dalla colonna separatamente. Il tempo impiegato per uscire dalla colonna, chiamato tempo di ritenzione, sarà riproducibile per ciascun componente nelle condizioni stabilite: identità di fase mobile e stazionaria, temperatura e larghezza della colonna. Una volta che i componenti escono dalla colonna, il solvente può essere rimosso per evaporazione e i componenti puri possono essere ulteriormente analizzati o identificati.
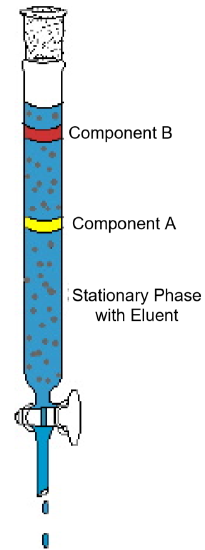
Figura 1: Un tipico esperimento di cromatografia a colonna dimostra la separazione di una miscela bicomponente.
L’identificazione provvisoria dei componenti può essere ottenuta confrontando la miscela sconosciuta con una miscela nota preparata con cura: se un componente noto ha lo stesso tempo di ritenzione di un componente sconosciuto nelle stesse condizioni, è probabile—ma non conclusivo—che i due componenti siano uguali. Potrebbero essere necessarie ulteriori analisi per confermare questa ipotesi. Se il noto e l’ignoto hanno tempi di ritenzione diversi, non è probabile che i due componenti siano identici.
Altre varianti della cromatografia utilizzano l’azione capillare—l’attrazione di un liquido su una superficie solida—per tirare un solvente attraverso il materiale solido. Una versione informale della cromatografia su carta può essere osservata quando una pagina scritta con inchiostro viene a contatto con acqua o altri liquidi. L’inchiostro viene eseguito e diversi colori sono separati nella striscia di inchiostro.
Lo schema seguente (Figura 2) mostra il risultato di un esperimento di cromatografia a strato sottile. Due macchie di inchiostro nero sulla superficie solida hanno avuto un solvente passato attraverso di loro. Il solvente è acqua o un altro liquido che viene tirato attraverso la fase stazionaria per azione capillare. In questo esempio, un pezzo di plastica rivestito con un solido in polvere viene utilizzato come fase stazionaria. In alternativa un pezzo di carta da filtro può essere utilizzato come fase stazionaria. L’esperimento mostra che l’inchiostro nero è una miscela contenente diverse sostanze colorate. Ogni componente ha una solubilità leggermente diversa nella fase mobile, quindi quando il liquido viene tirato attraverso la fase stazionaria, ogni componente si muove ad una velocità diversa, separando l’inchiostro in punti di diversi colori.

Figura 2: Cromatografia a strato sottile di inchiostro nero dopo lo sviluppo. Questa immagine dimostra un problema comune in cui le macchie si allargano mentre si muovono sulla piastra, alla fine si fondono nella parte superiore della piastra.
In questo esperimento, principi simili vengono utilizzati per separare diversi cationi metallici mediante una procedura di cromatografia su carta. Gli ioni metallici-\(\ce {Ag^{+}}\), \(\ce {Fe^{3+}}\),\(\ce{Co^{2+}}\), \(\ce{Cu^{2+}}\), e \(\ce{Hg ^ {2+}}\) – hanno diversa solubilità nella fase mobile-acquosa \ (\ce{HCl}\) con alcool etilico e butilico-e si muoverà a velocità diverse sulla carta. Le diverse solubilità degli ioni metallici sono probabilmente dovute alla formazione di vari composti con lo chloride cloruro e alla loro diversa capacità di dissolversi nel solvente organico.
Di seguito viene mostrato un diagramma che mostra come preparare la carta. Soluzioni standard contenenti ciascuno di questi ioni saranno individuati sulla carta utilizzando un tubo capillare, insieme a una soluzione standard contenente tutti e cinque gli ioni. Uno sconosciuto sarà anche individuato sulla carta. Una volta preparata la carta, verrà sviluppata posizionando la carta nell’eluente. Dopo 75-90 minuti, la carta viene visualizzata bagnandola con una soluzione acquosa contenente ioduro di potassio, \(\ce {KI}\) e ferrocianuro di potassio, \(\ce{K4}\). Il colore unico osservato per ogni ion è prodotto da una reazione chimica con la soluzione di visualizzazione. Questo è un modo utile per identificare quali ioni sono presenti in una miscela sconosciuta.
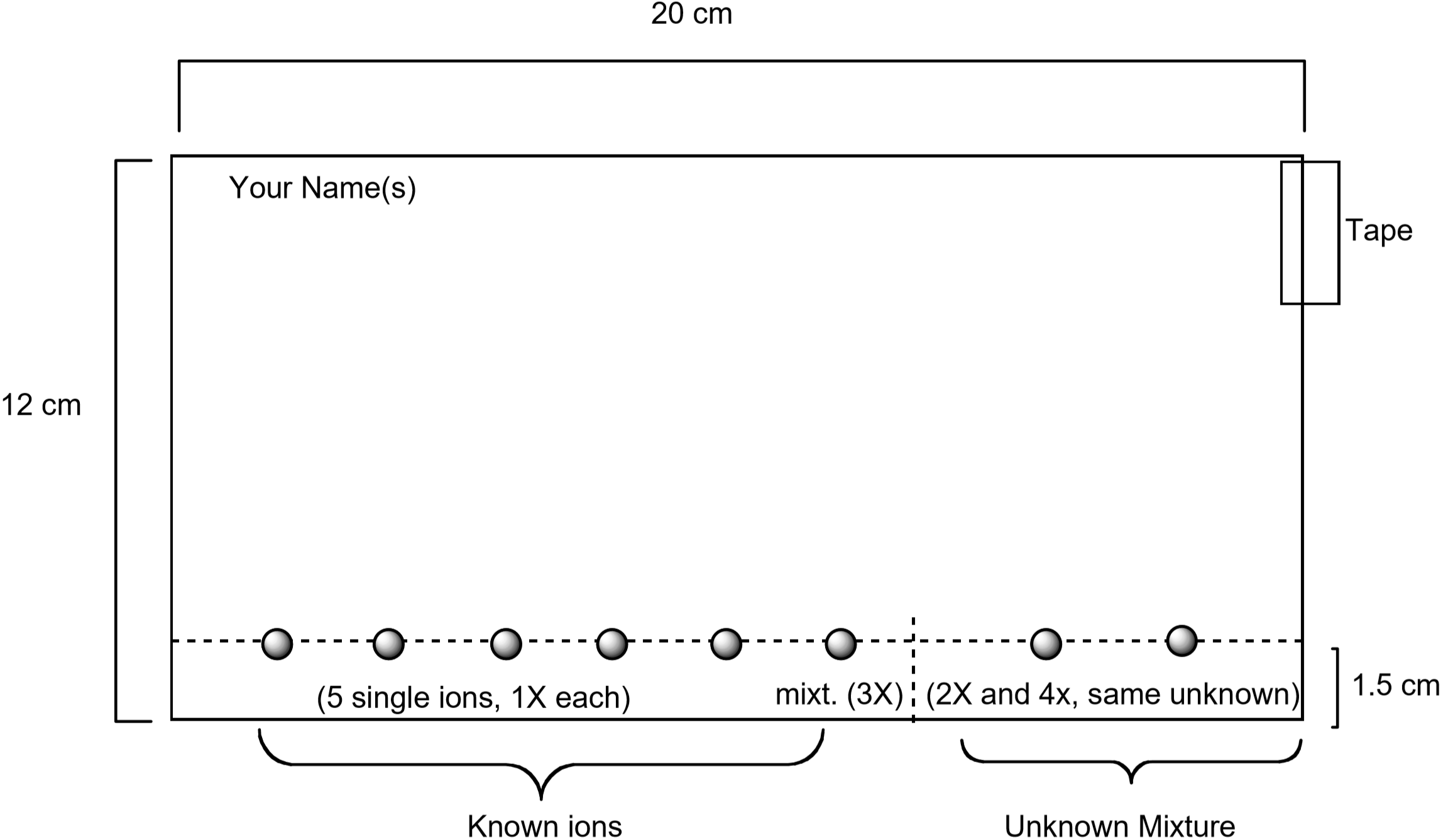
Figura 3: Diagramma che mostra come preparare la carta per l’esperimento di cromatografia
La distanza che lo ion muove verso l’alto la carta può anche essere utilizzata per identificare lo ion. Tuttavia, poiché gli studenti svilupperanno i loro esperimenti di cromatografia per diverse quantità di tempo e in condizioni leggermente diverse, ogni studente avrà una distanza misurata leggermente diversa per un dato ion. Il rapporto tra la distanza spostata da uno ion (\(D\)) e la distanza spostata dal solvente (\(F\), fronte solvente) è caratteristico e dovrebbe essere quasi lo stesso per tutti gli studenti. Questo rapporto è chiamato Rf, o ” fattore di ritenzione.”
\
Procedura
Materiali e attrezzature
Prodotti chimici: 0.1 M di soluzioni acquose di \(\ce{AgNO3}\), \(\ce{Hg(NO3)2}\), \(\ce{Fe(NO3)3}\), \(\ce{Co(NO3)2}\) e \(\ce{Cu(NO3)2}\), ciascuna dedicata con tubi capillari; eluizione soluzione acquosa di \(\ce{HCl}\) con alcole etilico e dall’alcol butilico); la visualizzazione di soluzione (soluzione acquosa di \(\ce{KI}\) e \(\ce{K4}\)).
Attrezzature: pezzo pulito di carta cromatografica; guanti in lattice monouso (guanti in nitrile sono disponibili nel magazzino per le persone con allergie al lattice); bicchiere da 600 ml; involucro di plastica; pinze o pinze becher; ruler *
*Articoli ottenuti da magazzino
Sicurezza
Evitare il contatto con le soluzioni di ioni metallici, il solvente eluente e la soluzione di visualizzazione. Indossare guanti monouso per toccare il cromatogramma dopo l’eluizione e per il resto dell’esperimento. Non respirare i vapori del solvente eluente o della soluzione di visualizzazione. Posizionare il cromatogramma bagnato su un tovagliolo di carta, non direttamente sul banco di laboratorio. Utilizzare la soluzione di visualizzazione solo nello spazio fornito dal proprio istruttore. Smaltire i guanti e il cromatogramma nel contenitore dei rifiuti specificato al termine dell’esperimento. Lavarsi accuratamente le mani dopo il contatto con tutte le soluzioni in questo laboratorio.
Preparazione della carta per cromatografia
- Ogni coppia di studenti deve ottenere un pezzo di carta da filtro con le dimensioni indicate in Figura 3. Assicurarsi che la carta sia pulita e senza strappi o pieghe. Usa una matita-non una penna-e un righello per tracciare una linea sulla carta a un cm dal bordo lungo della carta. Potrete individuare le soluzioni di ioni metallici su questa linea. Scrivi il tuo nome a matita nell’angolo in alto a sinistra della carta.
- Pratica spotting acqua e / o soluzioni ioniche su una striscia di carta da filtro in modo che si sa come creare macchie della dimensione corretta. Utilizzare tubi capillari di vetro per individuare gli ioni sulla carta. La soluzione viene applicata toccando leggermente e rapidamente un tubo capillare contenente la soluzione sulla linea disegnata sulla carta. Le macchie dovrebbero avere un diametro compreso tra 5-8 mm. Macchie più grandi di questo si diffonderanno eccessivamente durante l’esperimento e renderanno difficile l’analisi.
- Conosciuto 0.1 M soluzioni acquose di \(\ce{AgNO3}\), \(\ce{Hg(NO3)2}\), \(\ce{Fe(NO3)3}\), \(\ce{Co(NO3)2}\) e \(\ce{Cu(NO3)2}\) sono fornite in provette, ciascuna contenente due o tre tubi capillari. Partendo da sinistra, segnare l’identità dello ion sotto ogni punto con una matita; poi individuare ogni ion conosciuto con attenzione sulla linea. Fare attenzione a non contaminare il tubo capillare con altri ioni e sostituire i tubi capillari nella provetta corretta. Una provetta contenente una miscela nota di tutti e cinque gli ioni è dotata anche di un set di tubi capillari. Spot questa miscela sulla linea pure. Poiché questa soluzione è più diluita delle soluzioni note a singolo ion, applicare la miscela nota tre volte, lasciando asciugare il punto tra ogni applicazione. Una lampada di calore aiuterà ad asciugare il punto più rapidamente.
- Diverse incognite sono fornite anche in provette, insieme a tubi capillari. Il tuo istruttore ti dirà quale sconosciuto dovrebbe essere usato. Le incognite conterranno tra uno e quattro cationi e sono più diluite delle soluzioni note a singolo ion. Lo sconosciuto dovrà anche essere applicato due e quattro volte per le due prove, lasciando asciugare il punto tra ogni applicazione. In caso di errore, è necessario individuare l’ignoto in due punti lungo la linea in modo che siano disponibili due prove per l’analisi.
Sviluppare la carta per cromatografia
- Posizionare un pezzo di nastro lungo il bordo superiore destro, come mostrato in Figura 3. Quindi formare un cilindro collegando i due bordi corti della carta con il nastro. Assicurarsi che i bordi non tocchino. La carta dovrebbe essere simile alla Figura 4.
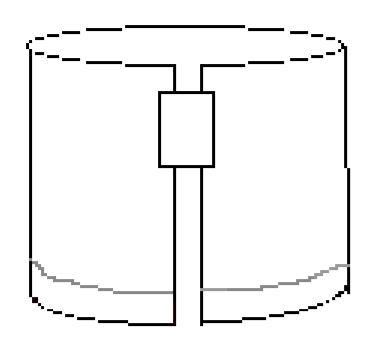
Figura 4: La carta piegata dovrebbe essere simile a questa prima di sviluppare l’esperimento.
- Ottenere 15 mL della soluzione eluente. Versare con cautela un po ‘ di questo solvente in un bicchiere da 600 ml e agitare con attenzione per un secondo o due. Attenzione: non respirare i vapori da questa soluzione! Assicurarsi che il livello del liquido sia al di sotto della linea spot sulla carta una volta che la carta è posizionata nella camera di sviluppo.
- Posizionare il cilindro di carta nel becher con il bordo segnato verso il basso. Le macchie dovrebbero essere al di sopra del livello del solvente. La carta non deve toccare i lati del becher. Coprire con cura il becher con un involucro di plastica e metterlo nel cappuccio per 75-90 minuti. Il solvente dovrebbe iniziare a spostare la carta. Una volta che il bicchiere è coperto, assicurarsi che sia di livello e non disturbare durante il periodo di sviluppo. Il tuo istruttore potrebbe avere un incarico su cui lavorare mentre aspetti.
Visualizzazione e analisi della carta
- Una volta terminato il periodo di sviluppo, indossare guanti monouso e rimuovere la carta dal becher. Guanti in lattice sono disponibili in laboratorio e guanti in nitrile sono disponibili nel magazzino per le persone con allergie al lattice. Lasciare che il solvente goccioli nuovamente nel becher, quindi rimuovere il nastro. Posare la carta cromatografica su un tovagliolo di carta e contrassegnare immediatamente il fronte solvente con una matita. Versare il solvente eluente usato nel contenitore dei rifiuti fornito. Asciugare la carta sotto una lampada di calore nel cappuccio. Cautela: Non respirare i vapori! Fare attenzione a non bruciare la carta sotto la lampada.
- Una volta che la carta è asciutta, portarla alla stazione di visualizzazione sul tovagliolo di carta. Immergere brevemente la carta nella soluzione di visualizzazione situata in un piatto poco profondo nella cappa aspirante. Sollevare immediatamente la carta dalla soluzione e lasciare gocciolare l’eccesso alla stazione. Posizionare la carta bagnata su un tovagliolo di carta asciutto e asciugarla immediatamente sotto una lampada di calore, quindi portarla al banco per l’analisi.
- Trova prima ogni singolo ion conosciuto e registra i colori che osservi. Alcune macchie possono sbiadire nel tempo, in modo da registrare i colori mentre la carta è ancora bagnata. Misurare la distanza ogni punto spostato, D, con un righello. Misura al centro di ogni punto. Registra i tuoi dati nella tabella dati.
- Misurare la distanza dal fronte solvente, F. Il valore di F dovrebbe essere approssimativamente lo stesso su tutta la carta. Utilizzare questi valori per calcolare la Rf per ogni ion. Effettuare le misurazioni come mostrato in Figura 5. Ogni punto osservato ha il proprio valore Rf. Registrare i risultati nella tabella dati.
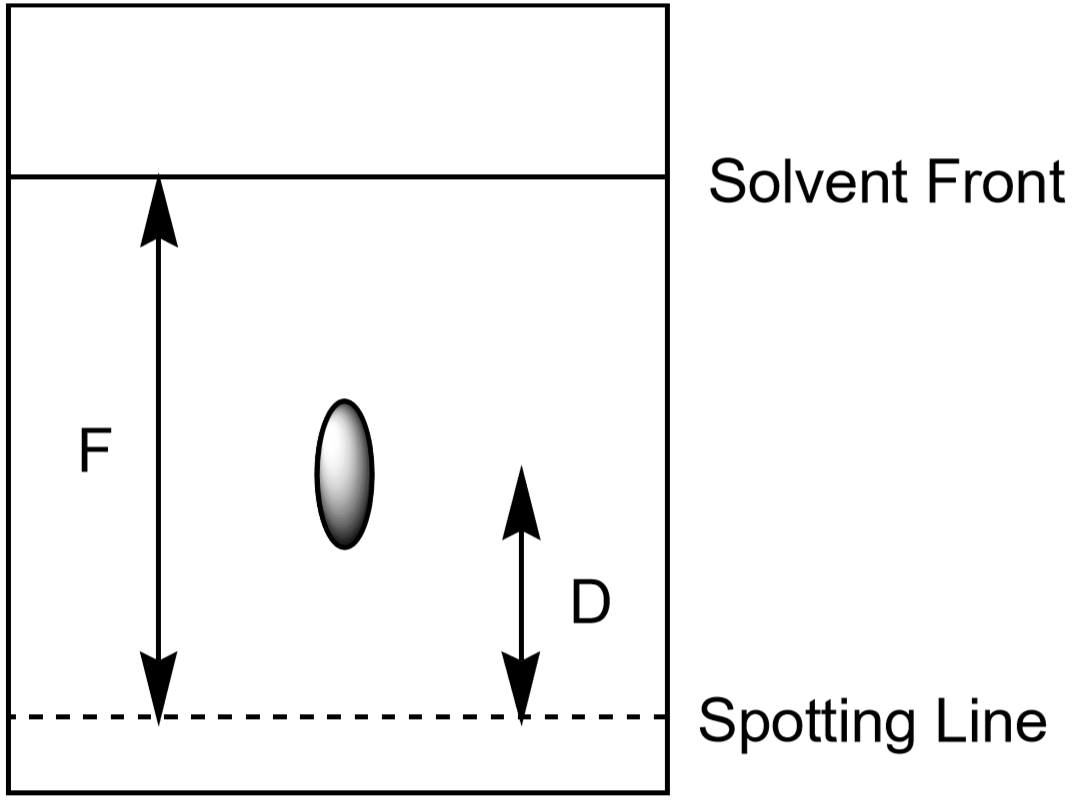
Figura 5: Misurazione delle distanze utilizzate nel calcolo della Rf per un punto.
- Nella corsia contenente la miscela, trovare ogni ion e registrare la distanza spostata da ogni ion. Calcola la Rf per ogni ion in questa corsia. I valori dovrebbero corrispondere strettamente a quelli osservati nei singoli ioni noti.
- Nella corsia contenente le incognite, individuare il centro di ogni punto osservato e registrare la sua distanza e calcolare i valori Rf. Usa la corsia che ha i punti più chiari. I valori di colore e Rf per i punti sconosciuti dovrebbero corrispondere strettamente ad alcuni degli ioni noti. Ora dovresti essere in grado di identificare quale ion o ioni si trovano nel tuo sconosciuto. Registra i tuoi dati nella tabella corrispondente.
- Fai uno schizzo del tuo cromatogramma nello spazio fornito sul modulo del rapporto di laboratorio, assicurandoti di indicare la posizione e la dimensione approssimativa e la forma di ogni punto sulla carta. Smaltire la carta nel contenitore dei rifiuti designato.
Cleanup
Posizionare la carta per cromatografia e i guanti usati nel contenitore dei rifiuti fornito. La soluzione di eluizione utilizzata dovrebbe essere già stata collocata in un altro contenitore di rifiuti. Si noti che due diversi contenitori per i rifiuti sono previsti per questo esperimento quindi assicuratevi di leggere le etichette in modo da utilizzare quella corretta! Assicurati di lavarti accuratamente le mani prima di lasciare il laboratorio.
Assegnazione pre-laboratorio: Cromatografia su carta
- Una miscela bicomponente viene analizzata mediante cromatografia su carta. Il componente A è più solubile nella fase mobile rispetto al componente B. Si ottiene il seguente risultato. Calcolare la Rf per ogni componente ed etichettare l’identità di ogni spot.
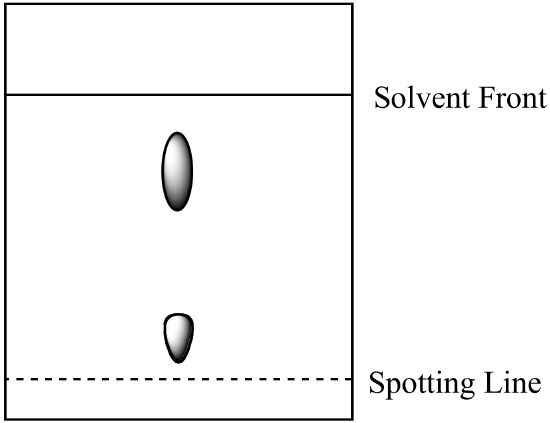
- La miscela della domanda 1 (sopra) viene analizzata mediante cromatografia a colonna utilizzando la stessa fase mobile e una fase stazionaria in gel di silice. Quale componente ha il tempo di ritenzione più breve? Spiega la tua risposta. (Supponiamo che lo stesso tipo di forze di legame tra i componenti e la fase stazionaria siano presenti sia nella cromatografia su carta che nella cromatografia su colonna.)
- Un campione liquido sconosciuto viene analizzato utilizzando la cromatografia della carta utilizzando il solvente X come fase mobile. Un punto viene osservato dopo che la piastra è stata sviluppata e visualizzata. La stessa sostanza sconosciuta viene ri-analizzata usando il solvente Y come fase mobile. Questa volta, tre punti vengono osservati dopo che la piastra è stata sviluppata e visualizzata.
- Il campione sconosciuto è una sostanza pura o una miscela? Spiega la tua risposta, inclusa una possibile ragione per le diverse osservazioni nei due esperimenti.
Lab Report for Paper Chromatography
Data, Observations, Calculations and Analysis Known Ions
Known Ions
|
Ion |
Spot Color (Stained) |
D (Single- Ion) |
F (Single- Ion) |
Rf |
D (Ion Mixt.) |
F (Ion Mixt.) |
Rf |
|---|---|---|---|---|---|---|---|
|
\(\ce{Ag^{+}}\) |
|||||||
|
\(\ce{Co^{2+}}\) |
|||||||
|
\(\ce{Cu^{2+}}\) |
|||||||
|
\(\ce{Fe^{3+}}\) |
|||||||
|
\(\ce{Hg^{2+}}\) |
Unknown ID Code _________________
Unknowns
|
Spot Number (from lowest Rr) |
Spot Color (Stained) |
D (Unknown) |
F (Unknown) |
Rf |
Identity of Spot |
|---|---|---|---|---|---|
- Sketch of Chromatogram:
Summary:
| Unknown Codice ID | Ioni Identificati |
|---|---|
Domande e Conclusioni
- Quali criteri sono stati utilizzati per identificare gli ioni presenti nella tua unknown? Spiega la tua risposta in almeno tre frasi. Includere eventuali difficoltà nell’identificazione di eventuali ioni.
- Se si lascia che l’esperimento venga eseguito per soli 30 minuti, quale sarebbe il risultato probabile? Sorgerebbero problemi nell’identificazione dell’ignoto?
- Se i punti \(\ce{Co^{2+}}\) e \(\ce{Cu^{2+}}\) fossero dello stesso colore, l’identificazione di uno sconosciuto sarebbe più difficile? Spiega la tua risposta.