Video \(\PageIndex{1}\): Una breve introduzione al genio di Mendeleev.
Mentre i primi chimici lavoravano per purificare i minerali e scoprivano più elementi, si resero conto che vari elementi potevano essere raggruppati insieme dai loro simili comportamenti chimici. Uno di questi gruppi comprende litio (Li), sodio (Na) e potassio (K): Questi elementi sono tutti lucidi, conducono bene il calore e l’elettricità e hanno proprietà chimiche simili. Un secondo raggruppamento comprende calcio (Ca), stronzio (Sr) e bario (Ba), che sono anche brillanti, buoni conduttori di calore ed elettricità e hanno proprietà chimiche in comune. Tuttavia, le proprietà specifiche di questi due raggruppamenti sono notevolmente diverse l’una dall’altra. Ad esempio: Li, Na e K sono molto più reattivi di Ca, Sr e Ba; Li, Na e K formano composti con ossigeno in un rapporto di due dei loro atomi a un atomo di ossigeno, mentre Ca, Sr e Ba formano composti con uno dei loro atomi a un atomo di ossigeno. Fluoro (F), cloro (Cl), bromo (Br) e iodio (I) presentano anche proprietà simili tra loro, ma queste proprietà sono drasticamente diverse da quelle di uno qualsiasi degli elementi sopra.
Dimitri Mendeleev in Russia (1869) e Lothar Meyer in Germania (1870) riconobbero indipendentemente che esisteva una relazione periodica tra le proprietà degli elementi noti in quel momento. Entrambe le tabelle pubblicate con gli elementi disposti in base alla crescente massa atomica. Ma Mendeleev è andato un passo oltre Meyer: Ha usato il suo tavolo per prevedere l’esistenza di elementi che avrebbero le proprietà simili a alluminio e silicio, ma erano ancora sconosciuti. Le scoperte del gallio (1875) e del germanio (1886) fornirono un grande sostegno al lavoro di Mendeleev. Sebbene Mendeleev e Meyer abbiano avuto una lunga disputa sulla priorità, i contributi di Mendeleev allo sviluppo della tavola periodica sono ora più ampiamente riconosciuti (Figura \ (\PageIndex{1}\)).
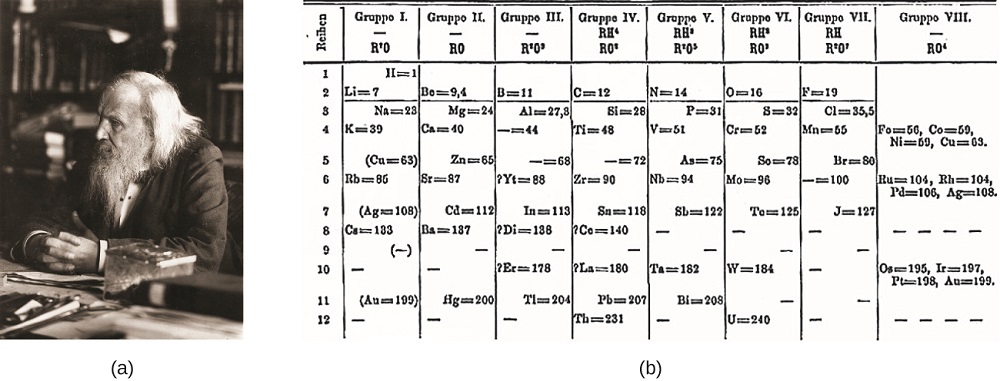
Figura \(\PageIndex{1}\): (a) Dimitri Mendeleev è ampiamente accreditato per aver creato (b) la prima tavola periodica degli elementi. (credit: modificazione dell’opera di Serge Lachinov di credito, b: modifica del lavoro “Den fjättrade ankan”/Wikimedia Commons)
Video \(\PageIndex{2}\): Un’introduzione per l’organizzazione della tavola periodica in periodi e gruppi. Questa organizzazione sarà importante mentre continuiamo a costruire sui principi della chimica.
Nel ventesimo secolo, divenne evidente che la relazione periodica coinvolgeva i numeri atomici piuttosto che le masse atomiche. L’affermazione moderna di questa relazione, la legge periodica, è la seguente: le proprietà degli elementi sono funzioni periodiche dei loro numeri atomici. Una tavola periodica moderna organizza gli elementi in ordine crescente dei loro numeri atomici e raggruppa gli atomi con proprietà simili nella stessa colonna verticale (Figura \ (\PageIndex{2}\)). Ogni casella rappresenta un elemento e contiene il suo numero atomico, il simbolo, la massa atomica media e (a volte) il nome. Gli elementi sono disposti in sette righe orizzontali, chiamate periodi o serie, e 18 colonne verticali, chiamate gruppi. I gruppi sono etichettati nella parte superiore di ogni colonna. Negli Stati Uniti, le etichette erano tradizionalmente numeri con lettere maiuscole. Tuttavia, IUPAC raccomanda di utilizzare i numeri da 1 a 18 e queste etichette sono più comuni. Affinché la tabella si adatti a una singola pagina, parti di due righe, per un totale di 14 colonne, vengono solitamente scritte sotto il corpo principale della tabella.

Figura \(\PageIndex{2}\): Gli elementi della tavola periodica sono organizzati in base alle loro proprietà.
Molti elementi differiscono notevolmente nelle loro proprietà chimiche e fisiche, ma alcuni elementi sono simili nei loro comportamenti. Ad esempio, molti elementi appaiono lucidi, sono malleabili (in grado di deformarsi senza rompersi) e duttili (possono essere aspirati in fili) e conducono bene il calore e l’elettricità. Altri elementi non sono lucenti, malleabili o duttili e sono poveri conduttori di calore ed elettricità. Possiamo ordinare gli elementi in grandi classi con proprietà comuni: metalli (elementi che sono lucidi, malleabili, buoni conduttori di calore ed elettricità—ombreggiato giallo); non metalli( elementi che appaiono opachi, poveri conduttori di calore ed elettricità—ombreggiato verde); e metalloidi (elementi che conducono il calore e l’elettricità moderatamente bene, e possiedono alcune proprietà dei metalli e alcune proprietà dei non metalli-viola ombreggiato).
Gli elementi possono anche essere classificati in base al principale gruppo di elementi (o elementi rappresentativi) nelle colonne contrassegnati con i numeri 1, 2, 13-18; i metalli di transizione in colonne contrassegnate 3-12; e interiore metalli di transizione in due righe in fondo alla tabella (la fila superiore elementi sono chiamati lantanidi e basso-elementi di riga sono attinidi; Figura \(\PageIndex{3}\)). Gli elementi possono essere ulteriormente suddivisi per proprietà più specifiche, come la composizione dei composti che formano. Ad esempio, gli elementi del gruppo 1 (la prima colonna) formano composti costituiti da un atomo dell’elemento e un atomo di idrogeno. Questi elementi (tranne l’idrogeno) sono noti come metalli alcalini e hanno tutti proprietà chimiche simili. Gli elementi del gruppo 2 (la seconda colonna) formano composti costituiti da un atomo dell’elemento e due atomi di idrogeno: questi sono chiamati metalli alcalino-terrosi, con proprietà simili tra i membri di quel gruppo. Altri gruppi con nomi specifici sono i pnictogeni (gruppo 15), i calcogeni (gruppo 16), gli alogeni (gruppo 17) e i gas nobili (gruppo 18, noti anche come gas inerti). I gruppi possono anche essere riferiti dal primo elemento del gruppo: ad esempio, i calcogeni possono essere chiamati gruppo di ossigeno o famiglia di ossigeno. L’idrogeno è un elemento unico e non metallico con proprietà simili agli elementi del gruppo 1 e del gruppo 17. Per questo motivo, l’idrogeno può essere mostrato nella parte superiore di entrambi i gruppi, o da solo.
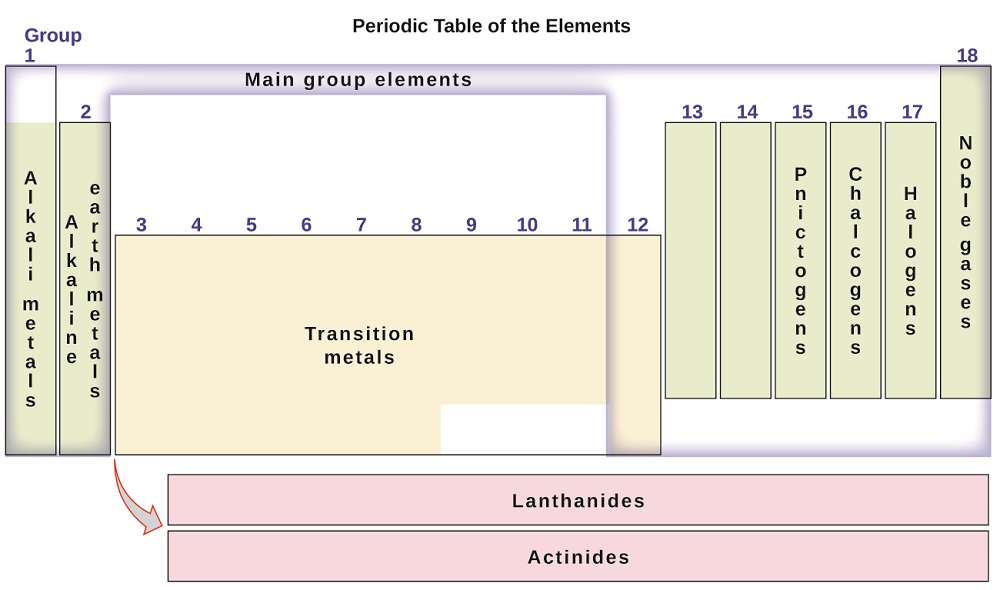
Figura \(\PageIndex{3}\): La tavola periodica organizza elementi con proprietà simili in gruppi.
Esempio \(\PageIndex{1}\): Denominare gruppi di elementi
Gli atomi di ciascuno dei seguenti elementi sono essenziali per la vita. Assegnare il nome del gruppo per i seguenti elementi:
- chlorine
- calcium
- sodium
- sulfur
Solution
The family names are as follows:
- halogen
- alkaline earth metal
- alkali metal
- chalcogen
Exercise \(\PageIndex{1}\)
Give the group name for each of the following elements:
- krypton
- selenio
- bario
- litio
Risposta
un gas nobile,
Risposta b
chalcogen
Risposta c
alcalino-metallo
Risposta d
metalli alcalini
Nello studio della tavola periodica, si potrebbe avere notato qualcosa atomica masse di alcuni elementi. L’elemento 43 (tecnezio), l’elemento 61 (promezio) e la maggior parte degli elementi con numero atomico 84 (polonio) e superiore hanno la loro massa atomica data tra parentesi quadre. Questo viene fatto per elementi che consistono interamente di isotopi radioattivi instabili (imparerai di più sulla radioattività nel capitolo sulla chimica nucleare). Un peso atomico medio non può essere determinato per questi elementi perché i loro radioisotopi possono variare significativamente in abbondanza relativa, a seconda della fonte, o potrebbero anche non esistere in natura. Il numero tra parentesi quadre è il numero di massa atomica (e massa atomica approssimativa) dell’isotopo più stabile di quell’elemento.
Sommario
Video \(\PageIndex{3}\): Un riassunto della scoperta e delle proprietà della tavola periodica.
La scoperta della ricorrenza periodica di proprietà simili tra gli elementi ha portato alla formulazione della tavola periodica, in cui gli elementi sono disposti in ordine crescente di numero atomico in righe note come periodi e colonne note come gruppi. Gli elementi dello stesso gruppo della tavola periodica hanno proprietà chimiche simili. Gli elementi possono essere classificati come metalli, metalloidi e non metalli, o come elementi del gruppo principale, metalli di transizione e metalli di transizione interni. I gruppi sono numerati 1-18 da sinistra a destra. Gli elementi del gruppo 1 sono noti come metalli alcalini; quelli del gruppo 2 sono i metalli alcalino-terrosi; quelli in 15 sono i pnictogeni; quelli in 16 sono i calcogeni; quelli in 17 sono gli alogeni; e quelli in 18 sono i gas nobili.