Obiettivi di Apprendimento
alla fine di questa sezione, si sarà in grado di:
- Spiegare le relazioni tra microscopico e macroscopico quantità di un gas
- Risolvere i problemi che coinvolgono le miscele di gas
- Risolvere i problemi che coinvolgono la distanza e il tempo tra una molecola di gas del collisioni
Abbiamo esaminato la pressione e la temperatura sulla base della loro macroscopica definizioni. La pressione è la forza divisa per l’area su cui viene esercitata la forza e la temperatura viene misurata con un termometro. Possiamo ottenere una migliore comprensione della pressione e della temperatura dalla teoria cinetica dei gas, la teoria che mette in relazione le proprietà macroscopiche dei gas con il movimento delle molecole di cui sono costituiti. Innanzitutto, facciamo due ipotesi sulle molecole in un gas ideale.
- C’è un numero molto grande N di molecole, tutte identiche e ognuna con massa m.
- Le molecole obbediscono alle leggi di Newton e sono in movimento continuo, che è casuale e isotropico, cioè lo stesso in tutte le direzioni.
Per ricavare la legge del gas ideale e la connessione tra grandezze microscopiche come l’energia di una molecola tipica e grandezze macroscopiche come la temperatura, analizziamo un campione di un gas ideale in un contenitore rigido, su cui facciamo due ulteriori ipotesi:
- Le molecole sono molto più piccole della distanza media tra loro, quindi il loro volume totale è molto inferiore a quello del loro contenitore (che ha volume V). In altre parole, prendiamo la costante di Van der Waals b, il volume di una mole di molecole di gas, per essere trascurabile rispetto al volume di una mole di gas nel contenitore.
- Le molecole fanno collisioni perfettamente elastiche con le pareti del contenitore e tra loro. Altre forze su di esse, inclusa la gravità e le attrazioni rappresentate dalla costante di Van der Waals a, sono trascurabili (come è necessario per l’assunzione di isotropia).
Le collisioni tra molecole non appaiono nella derivazione della legge del gas ideale. Non disturbano nemmeno la derivazione, poiché le collisioni tra molecole che si muovono con velocità casuali danno nuove velocità casuali. Inoltre, se le velocità delle molecole di gas in un contenitore non sono inizialmente casuali e isotropiche, le collisioni molecolari sono ciò che le rende casuali e isotropiche.
Facciamo ancora ulteriori ipotesi che semplificano i calcoli ma non influenzano il risultato. Per prima cosa, lasciamo che il contenitore sia una scatola rettangolare. In secondo luogo, iniziamo considerando i gas monatomici, quelli le cui molecole sono costituite da singoli atomi, come l’elio. Quindi, possiamo supporre che gli atomi non abbiano energia tranne la loro energia cinetica traslazionale; per esempio, non hanno né energia rotazionale né vibrazionale. (Più tardi, discutiamo la validità di questa ipotesi per i gas monatomici reali e ne facciamo a meno per considerare i gas biatomici e poliatomici.)
Figura \ (\PageIndex{1}\) mostra una collisione di una molecola di gas con la parete di un contenitore, in modo che eserciti una forza sulla parete (dalla terza legge di Newton). Queste collisioni sono la fonte di pressione in un gas. All’aumentare del numero di molecole, aumenta il numero di collisioni e quindi la pressione. Allo stesso modo, se la velocità media delle molecole è più alta, la pressione del gas è più alta.
In un campione di gas in un contenitore, la casualità del movimento molecolare fa fluttuare il numero di collisioni di molecole con qualsiasi parte della parete in un dato momento. Tuttavia, poiché un numero enorme di molecole si scontrano con il muro in breve tempo, il numero di collisioni sulle scale di tempo e spazio che misuriamo oscilla solo di una piccola frazione, solitamente non osservabile dalla media. Possiamo confrontare questa situazione con quella di un casinò, dove i risultati delle scommesse sono casuali e gli incassi del casinò fluttuano di minuto in minuto. Tuttavia, in tempi lunghi come un anno, gli incassi del casinò sono molto vicini alle medie attese dalle quote. Un serbatoio di gas ha enormemente più molecole di un casinò ha scommettitori in un anno, e le molecole fanno enormemente più collisioni in un secondo di un casinò ha scommesse.
Un calcolo della forza media esercitata dalle molecole sulle pareti della scatola ci porta alla legge del gas ideale e alla connessione tra temperatura ed energia cinetica molecolare. (In effetti, prenderemo due medie: una nel tempo per ottenere la forza media esercitata da una molecola con una data velocità, e poi un’altra media su molecole con velocità diverse.) Questo approccio è stato sviluppato da Daniel Bernoulli (1700-1782), che è meglio conosciuto in fisica per il suo lavoro sul flusso di fluido (idrodinamica). Sorprendentemente, Bernoulli fece questo lavoro prima che Dalton stabilisse la visione della materia come costituita da atomi.
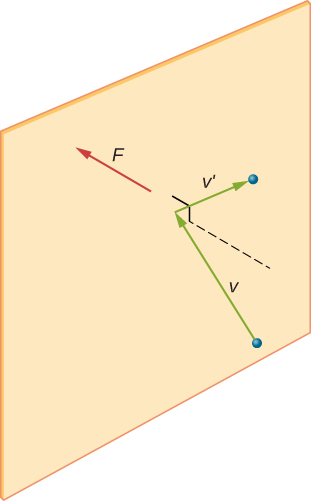
Figura \ (\PageIndex{2}\) mostra un contenitore pieno di gas e una vista espansa di una collisione elastica di una molecola di gas con una parete del contenitore, suddivisa in componenti. Abbiamo ipotizzato che una molecola sia piccola rispetto alla separazione delle molecole nel gas e che la sua interazione con altre molecole possa essere ignorata. In queste condizioni, la legge del gas ideale è sperimentalmente valida. Poiché abbiamo anche ipotizzato che il muro sia rigido e che le particelle siano punti, la collisione è elastica (per conservazione dell’energia—non c’è posto per l’energia cinetica di una particella). Pertanto, l’energia cinetica della molecola rimane costante, e quindi anche la sua velocità e la grandezza del suo momento rimangono costanti. Questa ipotesi non è sempre valida, ma i risultati nel resto di questo modulo si ottengono anche in modelli che consentono alle molecole di scambiare energia e quantità di moto con il muro.
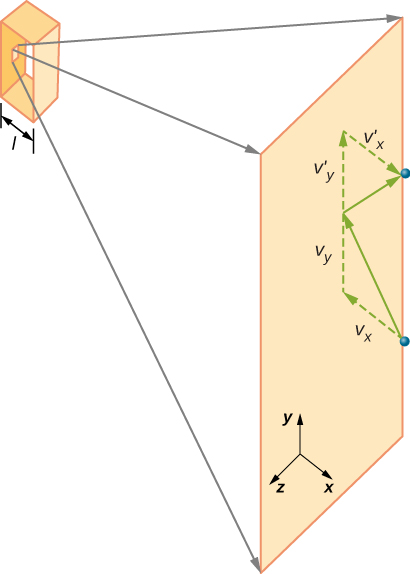
Se la velocità della molecola cambia nella direzione x, la sua quantità di moto cambia da \(- m_x\) a \(+mv_x\). Quindi, il suo cambiamento nella quantità di moto è \(\Delta mv = + mv_x – (- mv_x) = 2mv_x\). Secondo il teorema di impulso-momento dato nel capitolo sulla quantità di moto lineare e collisioni, la forza esercitata sulla molecola ith, dove i etichetta le molecole da 1 a N, è data da \
(In questa equazione da sola, p rappresenta la quantità di moto, non la pressione.) Non c’è forza tra il muro e la molecola tranne che mentre la molecola tocca il muro. Durante il breve periodo di collisione, la forza tra la molecola e la parete è relativamente grande, ma non è la forza che stiamo cercando. Stiamo cercando la forza media, quindi prendiamo \(\Delta t\) come il tempo medio tra le collisioni della molecola data con questo muro, che è il tempo in cui ci aspettiamo di trovare una collisione. Lascia che l rappresenti la lunghezza della scatola nella direzione x. Quindi \(\Delta t\) è il tempo che la molecola impiegherebbe per attraversare la scatola e tornare indietro, a una distanza 2l, ad una velocità di \(v_x\). Quindi \(\delta t = 2l / v_x\), e l’espressione per la forza diventa
\
Questa forza è dovuta a una molecola. Per trovare la forza totale sul muro, F, dobbiamo aggiungere i contributi di tutte le molecole N:
\
Ora usiamo la definizione della media, che denotiamo con una barra, per trovare la forza:
\
Vogliamo la forza in termini di velocità v, piuttosto che la componente x della velocità. Si noti che il totale della velocità al quadrato è la somma dei quadrati dei suoi componenti, in modo che
\
Con l’ipotesi di isotropia, le tre medie sul lato destro sono uguali, quindi
\
Sostituendo questa espressione per F dà
\
La pressione è di F/A, si ottiene, così,
\ dove abbiamo usato \(V = Al\) per il volume. Questo dà il risultato importante
\
Combinando questa equazione con \(pV = Nk_BT\) dà
\
Possiamo ottenere l’energia cinetica media di una molecola, \(\frac{1}{2}m\overline{v}^2\), dal lato sinistro dell’equazione dividendo N e moltiplicando per 3/2.
Energia Cinetica Media per Molecola
L’energia cinetica media di una molecola è direttamente proporzionale alla sua temperatura assoluta:
\
L’equazione \(\overline{K} = \frac{3}{2} k_BT\) è l’energia cinetica media per molecola. Si noti in particolare che nulla in questa equazione dipende dalla massa molecolare (o da qualsiasi altra proprietà) del gas, dalla pressione o da qualsiasi altra cosa tranne la temperatura. Se campioni di gas elio e xeno, con masse molecolari molto diverse, sono alla stessa temperatura, le molecole hanno la stessa energia cinetica media.
L’energia interna di un sistema termodinamico è la somma delle energie meccaniche di tutte le molecole in esso contenute. Ora possiamo dare un’equazione per l’energia interna di un gas ideale monatomico. In tale gas, l’unica energia delle molecole è la loro energia cinetica traslazionale. Pertanto, denota l’energia interna da \(E_{int}\) dobbiamo semplicemente avere \(E_{int} = N\overline{K}\), o
\
Spesso vorremmo utilizzare questa equazione in termini di moli:
\
Siamo in grado di risolvere \(\overline{K} = \frac{1}{2}m\overline{v}^2 = \frac{3}{2}k_BT\) per una velocità tipica di una molecola di un gas ideale in termini di temperatura per determinare ciò che è noto come il-root-mean-square (rms) velocità di una molecola.
RMS Velocità di una Molecola
root-mean-square (rms) velocità di una molecola, o la radice quadrata della media dei quadrati delle velocità \(\overline{v}^2\), è
\
rms velocità non è la media o la più probabile velocità delle molecole, come vedremo in Distribuzione Molecolare Velocità, ma fornisce un’facilmente calcolato stima delle molecole di velocità che è legata alla loro energia cinetica. Ancora una volta possiamo scrivere questa equazione in termini di costante del gas R e massa molare M in kg / mol:
\
Stiamo divagando per un momento per rispondere a una domanda che potrebbe esserti venuta in mente: quando applichiamo il modello agli atomi anziché alle particelle puntuali teoriche, l’energia cinetica rotazionale cambia i nostri risultati? Per rispondere a questa domanda, dobbiamo fare appello alla meccanica quantistica. Nella meccanica quantistica, l’energia cinetica rotazionale non può assumere un valore qualsiasi; è limitata a un insieme discreto di valori e il valore più piccolo è inversamente proporzionale all’inerzia rotazionale. L’inerzia rotazionale di un atomo è minuscola perché quasi tutta la sua massa è nel nucleo, che in genere ha un raggio inferiore a \(10^{-14} m\). Quindi l’energia di rotazione minima di un atomo è molto più di \(\frac{1}{2}k_BT\) per qualsiasi temperatura raggiungibile, e l’energia disponibile non è sufficiente per far ruotare un atomo. Torneremo su questo punto quando discuteremo dei gas biatomici e poliatomici nella prossima sezione.
Esempio \(\PageIndex{1}\): Calcolo dell’energia cinetica e della velocità di una molecola di gas
- Qual è l’energia cinetica media di una molecola di gas a \(20.0 ^ oC\) (temperatura ambiente)?
- Trova la velocità rms di una molecola di azoto (\(N_2\)) a questa temperatura.
Strategia
(a) Il noto nell’equazione per l’energia cinetica media è la temperatura:
\
Prima di sostituire i valori in questa equazione, dobbiamo convertire la temperatura data in kelvin: \(T = (20.0 + 273) \, K = 293 \, K\). Possiamo trovare la velocità rms di una molecola di azoto usando l’equazione
\
ma dobbiamo prima trovare la massa di una molecola di azoto. Ottenendo la massa molare di azoto \(N_2\) dalla tavola periodica, troviamo
\
Soluzione
- La sola temperatura è sufficiente per trovare l’energia cinetica traslazionale media. Sostituendo la temperatura, l’energia cinetica traslazionale equazione dà \
- Sostituendo questa massa e il valore di \(k_B\) nell’equazione \(v_{rms}\), si ottiene \
Significato
si noti che l’energia cinetica media di una molecola è indipendente dal tipo di molecola. L’energia cinetica traslazionale media dipende solo dalla temperatura assoluta. L’energia cinetica è molto piccola rispetto alle energie macroscopiche, in modo che non ci sentiamo quando una molecola d’aria sta colpendo la nostra pelle. D’altra parte, è molto più grande della tipica differenza nell’energia potenziale gravitazionale quando una molecola si sposta, ad esempio, dall’alto verso il basso di una stanza, quindi la nostra negligenza nella gravitazione è giustificata in tipiche situazioni del mondo reale. La velocità rms della molecola di azoto è sorprendentemente grande. Queste grandi velocità molecolari non producono un movimento macroscopico dell’aria, poiché le molecole si muovono in tutte le direzioni con uguale probabilità. Il percorso libero medio (la distanza che una molecola si muove in media tra le collisioni, discusso un po ‘ più avanti in questa sezione) delle molecole nell’aria è molto piccolo, quindi le molecole si muovono rapidamente ma non arrivano molto lontano in un secondo. L’alto valore per la velocità rms si riflette nella velocità del suono, che è di circa 340 m/s a temperatura ambiente. Maggiore è la velocità rms delle molecole d’aria, le vibrazioni sonore più veloci possono essere trasferite attraverso l’aria. La velocità del suono aumenta con la temperatura ed è maggiore nei gas con piccole masse molecolari, come l’elio (vedi Figura \(\PageIndex{3}\)).
Esempio \(\PageIndex{2}\): Calcolo della Temperatura: Velocità di Fuga di Atomi di Elio
Per sfuggire la gravità della Terra, un oggetto vicino alla parte superiore dell’atmosfera (a un’altitudine di 100 km) devono viaggiare lontano dalla Terra a 11.1 km/s. Questa velocità è detta velocità di fuga. A quale temperatura gli atomi di elio avrebbero una velocità rms uguale alla velocità di fuga?
Strategia
Identifica le conoscenze e le incognite e determina quali equazioni utilizzare per risolvere il problema.
Soluzione
- Identificare l’ignoto: v è la velocità di fuga, 11.1 km/s.
- Identificare le incognite: Abbiamo bisogno di risolvere per la temperatura, T. Abbiamo anche bisogno di risolvere per la massa m dell’atomo di elio.
- Determina quali equazioni sono necessarie.
- Per ottenere la massa m dell’atomo di elio, possiamo utilizzare le informazioni dalla tavola periodica: \
- Per risolvere, per la temperatura T, possiamo riorganizzare \ cedere \
- Sostituire i valori noti nelle equazioni e risolvere le incognite, \ e \
Significato
Questa temperatura è di molto superiore alla temperatura atmosferica, che è di circa 250 K (\(-25^oC\) o \(-10^di\)) d’alta quota. Pochissimi atomi di elio sono rimasti nell’atmosfera, ma molti erano presenti quando l’atmosfera si è formata, e più sono sempre creati dal decadimento radioattivo (vedi il capitolo sulla fisica nucleare). La ragione della perdita di atomi di elio è che un piccolo numero di atomi di elio ha velocità superiori alla velocità di fuga della Terra anche a temperature normali. La velocità di un atomo di elio cambia da una collisione all’altra, in modo che in qualsiasi istante, c’è una piccola ma diversa da zero possibilità che la velocità dell’atomo sia maggiore della velocità di fuga. La probabilità è abbastanza alta che nel corso della vita della Terra, quasi tutti gli atomi di elio che sono stati nell’atmosfera hanno raggiunto la velocità di fuga ad alta quota e sono fuggiti dall’attrazione gravitazionale terrestre. Le molecole più pesanti, come ossigeno, azoto e acqua, hanno velocità rms più piccole, e quindi è molto meno probabile che ognuna di esse abbia velocità superiori alla velocità di fuga. In effetti, la probabilità è così piccola che miliardi di anni sono necessari per perdere quantità significative di molecole più pesanti dall’atmosfera. La figura \(\PageIndex{4}\) mostra l’effetto della mancanza di un’atmosfera sulla Luna. Poiché l’attrazione gravitazionale della Luna è molto più debole, ha perso quasi tutta la sua atmosfera. Le atmosfere della Terra e di altri corpi sono confrontate negli esercizi di questo capitolo.

Esercizio di \(\PageIndex{2}\)
Se si considera un oggetto molto piccolo, come un granello di polline, in un gas, quindi il numero di molecole che colpisce la sua superficie sarebbe anche relativamente piccolo. Ti aspetteresti che il granello di polline subisca fluttuazioni di pressione dovute a fluttuazioni statistiche nel numero di molecole di gas che lo colpiscono in un dato periodo di tempo?
Rispondi
Sì. Tali fluttuazioni si verificano effettivamente per un corpo di qualsiasi dimensione in un gas, ma poiché il numero di molecole è immenso per i corpi macroscopici, le fluttuazioni sono una piccola percentuale del numero di collisioni e le medie di cui si parla in questa sezione variano impercettibilmente. In parole povere, le fluttuazioni sono inversamente proporzionali alla radice quadrata del numero di collisioni, quindi per i piccoli corpi possono diventare significativi. Questo è stato effettivamente osservato nel diciannovesimo secolo per i grani di polline nell’acqua ed è noto come moto browniano.
Pressione di vapore, pressione parziale e Legge di Dalton
La pressione che un gas creerebbe se occupasse il volume totale disponibile è chiamata pressione parziale del gas. Se due o più gas sono mescolati, arriveranno all’equilibrio termico a seguito di collisioni tra molecole; il processo è analogo alla conduzione di calore come descritto nel capitolo sulla temperatura e calore. Come abbiamo visto dalla teoria cinetica, quando i gas hanno la stessa temperatura, le loro molecole hanno la stessa energia cinetica media. Pertanto, ogni gas obbedisce separatamente alla legge del gas ideale ed esercita la stessa pressione sulle pareti di un contenitore che avrebbe se fosse solo. Pertanto, in una miscela di gas, la pressione totale è la somma delle pressioni parziali dei gas componenti, assumendo un comportamento del gas ideale e nessuna reazione chimica tra i componenti. Questa legge è conosciuta come legge di Dalton delle pressioni parziali, dopo lo scienziato inglese John Dalton (1766-1844) che la propose. La legge di Dalton è coerente con il fatto che le pressioni si aggiungono secondo il principio di Pascal.
In una miscela di gas ideali in equilibrio termico, il numero di molecole di ciascun gas è proporzionale alla sua pressione parziale. Questo risultato deriva dall’applicazione della legge del gas ideale a ciascuno nella forma \(p / n = RT / V\). Poiché il lato destro è lo stesso per qualsiasi gas ad una data temperatura in un contenitore di un dato volume, anche il lato sinistro è lo stesso.
- La pressione parziale è la pressione che un gas creerebbe se esistesse da solo.
- La legge di Dalton afferma che la pressione totale è la somma delle pressioni parziali di tutti i gas presenti.
- Per due gas qualsiasi (etichettati 1 e 2) in equilibrio in un contenitore, \(\frac{p_1}{n_1} = \frac{p_2}{n_2}.\)
Un’importante applicazione della pressione parziale è che, in chimica, funziona come la concentrazione di un gas nel determinare la velocità di una reazione. Qui, menzioniamo solo che la pressione parziale dell’ossigeno nei polmoni di una persona è cruciale per la vita e la salute. L’aria respirabile che ha una pressione parziale di ossigeno inferiore a 0,16 atm può compromettere la coordinazione e il giudizio, in particolare nelle persone non acclimatate ad alta quota. Pressioni parziali inferiori di \(O_2\) hanno effetti più gravi; pressioni parziali inferiori a 0,06 atm possono essere rapidamente fatali e danni permanenti sono probabili anche se la persona viene salvata. Tuttavia, la sensazione di dover respirare, come quando si trattiene il respiro, è causata molto più da alte concentrazioni di anidride carbonica nel sangue che da basse concentrazioni di ossigeno. Quindi, se una piccola stanza o un armadio è piena di aria con una bassa concentrazione di ossigeno, forse perché un cilindro che perde di un gas compresso è immagazzinato lì, una persona non sentirà alcuna sensazione di “soffocamento” e potrebbe andare in convulsioni o perdere conoscenza senza notare nulla di sbagliato. Gli ingegneri della sicurezza prestano molta attenzione a questo pericolo.
Un’altra importante applicazione della pressione parziale è la pressione di vapore, che è la pressione parziale di un vapore in cui è in equilibrio con la fase liquida (o solida, nel caso di sublimazione) della stessa sostanza. A qualsiasi temperatura, la pressione parziale dell’acqua nell’aria non può superare la pressione di vapore dell’acqua a quella temperatura, perché ogni volta che la pressione parziale raggiunge la pressione di vapore, l’acqua si condensa dall’aria. La rugiada è un esempio di questa condensazione. La temperatura alla quale si verifica la condensazione per un campione di aria è chiamata punto di rugiada. Si misura facilmente raffreddando lentamente una sfera di metallo; il punto di rugiada è la temperatura alla quale la condensa appare per la prima volta sulla sfera.
Le pressioni di vapore dell’acqua ad alcune temperature di interesse per la meteorologia sono riportate nella Tabella\(\PageIndex{1}\).
| T(\(^oC\)) | Pressione di Vapore (Pa) |
|---|---|
| 0 | 610.5 |
| 3 | 757.9 |
| 5 | 872.3 |
| 8 | 1073 |
| 10 | 1228 |
| 13 | 1497 |
| 15 | 1705 |
| 18 | 2063 |
| 20 | 2338 |
| 23 | 2809 |
| 25 | 3167 |
| 30 | 4243 |
| 35 | 5623 |
| 40 | 7376 |
The relative humidity (R.H.) ad una temperatura T è definita da
\
Un’umidità relativa di \(100\%\) significa che la pressione parziale dell’acqua è uguale alla pressione di vapore; in altre parole, l’aria è satura di acqua.
Esempio \(\PageIndex{3}\): Calcolo dell’umidità relativa
Qual è l’umidità relativa quando la temperatura dell’aria è \(25 ^ oC\) e il punto di rugiada è \(15 ^ oC\)?
Strategia
Cerchiamo semplicemente la pressione del vapore alla temperatura data e quella al punto di rugiada e troviamo il rapporto.
Soluzione
\
Significato
R. H. è importante per il nostro comfort. Il valore di \(53.8\%\) rientra nell’intervallo da \(40\%\) a \(60\%\) consigliato per il comfort in ambienti chiusi.
Come notato nel capitolo su temperatura e calore, la temperatura raramente scende al di sotto del punto di rugiada, perché quando raggiunge il punto di rugiada o il punto di gelo, l’acqua condensa e rilascia una quantità relativamente grande di calore latente di vaporizzazione.
Mean Free Path and Mean Free Time
Ora consideriamo esplicitamente le collisioni. Il solito primo passo (che è tutto ciò che prenderemo) è calcolare il percorso libero medio, \(\lambda\), la distanza media che una molecola percorre tra le collisioni con altre molecole e il tempo libero medio \(\tau\), il tempo medio tra le collisioni di una molecola. Se assumiamo che tutte le molecole siano sfere con un raggio \(r\), una molecola si scontrerà con un’altra se i loro centri si trovano a una distanza 2r l’uno dall’altro. Per una determinata particella, diciamo che l’area di un cerchio con quel raggio, \(4\pi r^2\), è la “sezione trasversale” per le collisioni. Mentre la particella si muove, traccia un cilindro con quell’area della sezione trasversale. Il percorso libero medio è la lunghezza \(\lambda\) tale che il numero atteso di altre molecole in un cilindro di lunghezza \(\lambda\) e sezione trasversale \(4 \ pi r^2\) è 1. Se vogliamo ignorare temporaneamente il movimento delle molecole di diverso da quello che stiamo osservando, il numero atteso è il numero densità di molecole, N/V, volte il volume e il volume \(4\pi r^2 \lambda\), quindi abbiamo \((N/V)4\pi r^2 \lambda = 1\), o
\
Prendere il movimento di tutte le molecole in considerazione rende il calcolo molto difficile, ma l’unico cambiamento è un fattore di \(\sqrt{2}\). Il risultato è
\
In un gas ideale, possiamo sostituire \(V/N = k_BT/p\) per ottenere
\
Il tempo libero medio \(\tau\) è semplicemente il percorso libero medio diviso per una velocità tipica, e la scelta usuale è la velocità rms. Quindi
\
Calcolo del tempo libero medio
Trova il tempo libero medio per gli atomi di argon (\(M = 39,9 \, g / mol\)) ad una temperatura di \(0^oC\) e una pressione di 1,00 atm. Prendi il raggio di un atomo di argon per essere \(1,70\volte 10^{-10} \ spazio m\).
Soluzione
- Identificare i knowns e convertire in unità SI. Sappiamo che la massa molare è 0.0399 kg / mol, la temperatura è 273 K, la pressione è \(1.01 \ volte 10 ^ 5\, Pa\), e il raggio è \(1.70 \ volte 10 ^ {-10}\, m\).
- Trova la velocità rms: \(v_{rms} = \ sqrt {\frac {3RT}{M}} = 413\, m / s\).
- Sostituisci nell’equazione il tempo libero medio: \
Significato
Difficilmente possiamo confrontare questo risultato con la nostra intuizione sulle molecole di gas, ma ci dà un’immagine di molecole che si scontrano con frequenza estremamente elevata.
Esercizio \(\PageIndex{4}\)
Che ha un percorso libero medio più lungo, acqua liquida o vapore acqueo nell’aria?
Risposta
In un liquido, le molecole sono molto vicine tra loro, costantemente in collisione tra loro. Perché un gas sia quasi ideale, poiché l’aria è in condizioni normali, le molecole devono essere molto distanti. Pertanto il percorso libero medio è molto più lungo nell’aria.
Collaboratori e attribuzioni
-
Samuel J. Ling (Truman State University), Jeff Sanny (Loyola Marymount University), e Bill Moebs con molti autori che contribuiscono. Questo lavoro è concesso in licenza da OpenStax University Physics sotto una licenza Creative Commons Attribution (by 4.0).