Orbitali molecolari di una carbocazione allilica
La stabilità della carbocazione del propene è dovuta ad un sistema di elettroni π coniugati. Un” doppio legame ” in realtà non esiste. Invece, è un gruppo di 3 orbitali p adiacenti, sovrapposti, non ibridati che chiamiamo un sistema di elettroni π coniugato. È possibile vedere chiaramente le interazioni tra tutti e tre gli orbitali p dai tre carboni risultando in un catione veramente stabile. Tutto si riduce a dove si trova la posizione del carbonio carente di elettroni.
Le descrizioni degli orbitali molecolari possono spiegare la stabilità allilica in un altro modo usando il 2-propenile. Fico.6
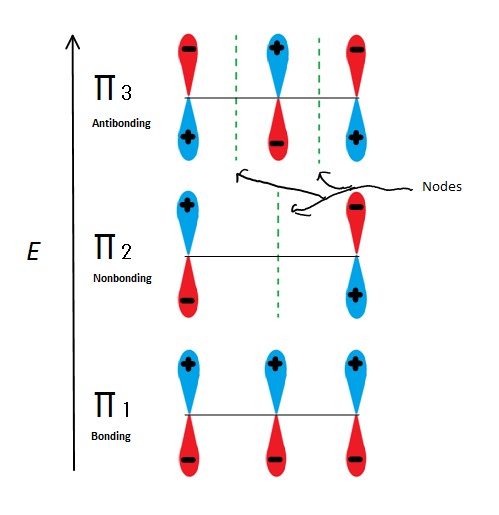
Fig.6 Mostra i 3 possibili orbitali molecolari di 2-propenil
Se prendiamo solo l’orbitale molecolare π e non uno qualsiasi degli s, ne otteniamo tre. π1 sta legando senza nodi, π2 è nonbonding (in altre parole, la stessa energia di un normale p-orbitale) con un nodo, e π3 è antibonding con 2 nodi (nessuno degli orbitali sta interagendo). I primi due elettroni entreranno nell’orbitale molecolare π1, indipendentemente dal fatto che sia un catione, un radicale o un anione. Se è un radicale o un anione, l’elettrone successivo entra nell’orbitale molecolare π2. L’ultimo elettrone anionico entra anche nell’orbitale non conduttore. Quindi non importa che tipo di centro di carbonio esiste, nessun elettrone andrà mai nell’orbitale antibonding.
Gli orbitali di legame sono gli orbitali a energia più bassa e sono favorevoli, motivo per cui vengono riempiti per primi. Anche se gli orbitali non conduttori possono essere riempiti, l’energia complessiva del sistema è ancora più bassa e più stabile a causa degli orbitali molecolari di legame riempiti.
Questa figura mostra anche che π2 è l’unico orbitale molecolare in cui l’elettrione differisce, ed è anche dove un singolo nodo passa attraverso il centro. Per questo motivo, le cariche della molecola sono principalmente sui due carboni terminali e non sul carbonio medio.
Questa descrizione orbitale molecolare può anche illustrare la stabilità dei centri di carbonio allilici in figura 7.
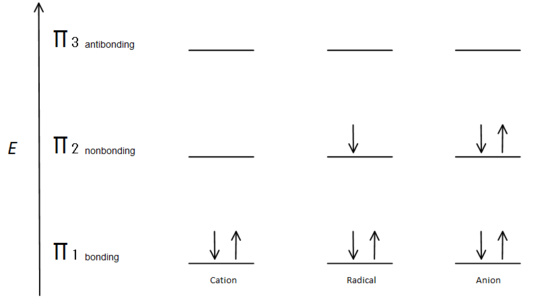
Fig.7 diagramma che mostra come gli elettroni si riempiono in base al principio di Aufbau.
L’orbitale di legame π è più basso in energia rispetto all’orbitale p non vincolante. Poiché ogni centro di carbonio mostrato ha due elettroni nell’energia inferiore, legando gli orbitali π, l’energia di ciascun sistema viene abbassata nel complesso (e quindi più stabile), indipendentemente dal catione, dal radicale o dall’anione.