Ziprasidone versus Olanzapine dans le gain de poids associé au traitement de la schizophrénie: Une étude de groupe parallèle randomisée en double aveugle de six mois
Enric Álvarez *; Miguel Bernardo **; José Ramón Gutiérrez Casares ***; ÁnGel L. Montejo ****
* Département de psychiatrie. Hôpital de la Santa Creu i Sant Pau. CIBERSAM, Université Autonome de Barcelone, IBSantpau Barcelone. Espagne
** Département de Psychiatrie, Hôpital Clinique de Barcelone, CIBERSAM, Université de Barcelone, IDIBAPS, Barcelone. Espagne
*** Complexe Hospitalier Universitaire de Badajoz. Service de santé d’Estrémadure, Badajoz. Espagne
**** Hôpital universitaire de Salamanque. École de médecine, Université de Salamanque, Salamanque. Espagne
Cette étude a été financée par Pfizer.
Correspondance
RÉSUMÉ
Contexte et objectifs: Les données antérieures issues de l’analyse de sécurité indiquent que l’olanzapine peut entraîner une prise de poids importante, alors qu’aucun changement n’a été observé avec la ziprasidone. L’obésité peut constituer une menace pour la santé et amener les sujets à cesser leur traitement antipsychotique. Afin d’évaluer plus en détail les effets différentiels de la ziprasidone et de l’olanzapine sur la prise de poids, une étude a été menée en prenant le poids corporel comme critère d’évaluation principal de l’efficacité.
Méthodes: Une étude parallèle randomisée de six mois, en double aveugle, a été réalisée chez des sujets hommes et femmes âgés de 18 à 70 ans présentant un diagnostic primaire de schizophrénie (DSM-IV-TR) et un état clinique nécessitant l’initiation d’un traitement par un nouvel antipsychotique, la ziprasidone ou l’olanzapine 1:1, pour évaluer les changements de poids liés au traitement. Cinquante patients ont été inclus. Les résultats d’efficacité ont été évalués au départ et aux semaines 1, 4, 12, 18 et 24. Le critère d’évaluation principal de l’efficacité était le pourcentage de variation du poids corporel par rapport à l’inclusion à la semaine 24. La sécurité a également été évaluée.
Résultats: À la semaine 24, il y avait une augmentation significativement plus importante du poids corporel (7,5%, p < 0,0001) chez les patients traités par olanzapine que chez ceux traités par ziprasidone et le nombre de sujets ayant eu un gain de poids > 7% était significativement plus élevé dans le groupe olanzapine par rapport au groupe ziprasidone (n = 11) vs n = 3; OU = 6,246, valeur p = 0,0150). PANNS-N a diminué de manière significative dans les deux groupes. La plupart des EI étaient modérés ou légers dans les deux groupes.
Conclusions: L’Olanzapine augmente significativement le poids corporel par rapport à la ziprasidone à la semaine 24. Cependant, le traitement par ziprasidone ou olanzapine a amélioré les scores PANSS positifs, négatifs et psychopathologiques généraux et a été bien toléré.
Mots clés: Antipsychotiques; Prise de poids; Ziprasidone; Olanzapine; Obésité.
Introduction
Les patients schizophrènes présentent une pré-valence plus élevée d’obésité, d’intolérance au glucose et de diabète sucré de type 2, avec un lien génétique avec les enzymes impliquées dans la glycolysise1,2 et un taux plus élevé d’événements cardiovasculaires 3. De plus, de nombreux antipsychotiques de deuxième génération sont associés à un risque plus élevé de prise de poids2,4, de résistance à l’insuline, d’hyperglycémie et de dyslipidémie5. La combinaison de ces différents facteurs, la susceptibilité génétique, un mode de vie sédentaire et une mauvaise alimentation et les effets secondaires indésirables du traitement antipsychotique, représentent un facteur de risque important de maladie cardiovasculaire chez les patients traités par des antipsychotiques atypiques6. Non seulement l’obésité est-elle une menace pour la santé et la longévité, mais elle peut également amener les sujets à interrompre leur traitement antipsychotique7.
La ziprasidone et l’olanzapine sont des antipsychotiques atypiques efficaces fréquemment utilisés dans le traitement de la schizophrénie et des troubles schizoïdes. Les antipsychotiques atypiques présentent une meilleure efficacité et moins d’effets secondaires indésirables que les antipsychotiques typiques8,9. Cependant, ils sont toujours susceptibles de provoquer des effets indésirables, notamment une hypotension hypostatique10, une somnolence11, un gain de poids1,2, une dyslipidémie12, une hyperglycémie et un diabète mellitus5 et une hyperprolactinémie, qui peuvent générer des problèmes de fertilité, un dysfonctionnement sexuel et une diminution de la densité minérale osseuse13,14.
Des études antérieures n’ont montré aucune modification du poids ou du métabolisme chez les sujets traités par la ziprasidone1,2,15, la ziprasidone présente une faible propension à provoquer des effets secondaires extrapyramidaux (EPS) ou des anomalies de laboratoire8,16,17 et n’affecte pas négativement la fonction sexuelle des patients schizophrènes18. Il a été rapporté que la ziprasidone entraîne une perte de poids et une réduction des taux de lipides sériques19,20.
L’olanzapine est l’un des antipsychotiques les plus fréquemment prescrits, dont l’efficacité a été prouvée pour les symptômes de la schizophrène21-23. Cependant, l’olanzapine figure parmi les antipsychotiques atypiques induisant une prise de poids24,25, étant également associée à une augmentation substantielle du cholestérol total, des triglycérides, des LDL et de l’insuline à jeun20,26,27. Dans des études antérieures comparant la ziprasidone à l’olanzapine, exclusivement ou en association avec d’autres traitements, l’olanzapine a montré une augmentation significativement plus importante du poids et de l’IMC et une probabilité de prise de poids rapide plus élevée que tout autre traitement7,20, 26,27. Cependant, toutes ces études comportaient une variable d’efficacité comme variable principale, l’évaluation du poids n’étant qu’une partie de l’étude d’innocuité.
Les traitements antipsychotiques sont souvent à long terme et il est nécessaire de prendre en compte le risque accru d’altérations métaboliques dans les soins aux patients. Par conséquent, cette étude randomisée en double aveugle a été conçue pour aborder spécifiquement la question de la prise de poids à long terme (6 mois), cette variable étant la principale. De plus, étant donné que d’autres facteurs sont liés à la disposition des patients et à l’observance du traitement, cette étude a évalué la qualité de vie, le fonctionnement général, les préférences et l’attitude à l’égard du traitement, afin de fournir plus d’informations sur les questions à aborder dans ces traitements à long terme et de discuter de leur relation avec l’objectif principal.
Méthodes
Une étude randomisée, multicentrique, parallèle et en double aveugle de six mois a été réalisée d’avril 2003 à février 2007 pour estimer et comparer les effets de la ziprasidone par rapport à l’olanzapine sur le poids corporel dans le traitement de sujets atteints de schizophrénie.
L’étude a été menée dans 11 centres à travers l’Espagne. Des sujets masculins ou féminins âgés de 18 à 70 ans présentant un diagnostic primaire de schizophrénie, selon le DSM-IV-TR28, et une condition clinique nécessitant l’initiation d’un traitement avec un nouveau médicament antipsychotique ont été inclus. Les patients, ou leur représentant légal, ont donné leur consentement éclairé. Critères d’exclusion: antécédents de maladie physique cliniquement significative ou d’anomalies ECG (par exemple QTc > 500 ms), valeurs de laboratoire anormales cliniquement significatives, épilepsie, convulsions, psychochirurgie, absence de réponse ou intolérance antérieure à l’olanzapine ou à la ziprasidone; grossesse ou allaitement; preuves sérologiques du VIH ou de l’hépatite; traitement par l’un ou l’autre médicament dans les 6 mois précédant le dépistage; patient incapable ou ayant des difficultés à se conformer au protocole d’étude; risque immédiat de nuire à soi-même ou à autrui; traitement concomitant avec des agents antipsychotiques après la randomisation; médicaments antipsychotiques de dépôt dans le mois suivant l’entrée; traitement avec des antidépresseurs ou des stabilisants de l’humeur dans les deux semaines suivant la randomisation; abus de substances dans les 3 mois précédents; maladie mentale organique; traitement avec des médicaments cliniques de recherche dans les 30 jours avant la randomisation.
L’étude a été développée en accord avec la déclaration de Helsinki29 et le protocole d’étude a été approuvé par les Comités d’Éthique correspondant aux centres concernés et par le Département des Médicaments à Usage Humain de l’Agence Espagnole du Médicament et des Produits de Santé (AEMPS).
Les sujets ont été inclus dans l’étude 12 heures après la dose d’antipsychotique précédente, à l’exception des sujets traités par un antipsychotique de dépôt (voir ci-dessus), et ont été répartis au hasard dans un rapport de 1:1.
Posologie du traitement et calendrier de visite
La posologie était flexible dans les 3 niveaux: Faible (ziprasidone 40 mg BID ou olanzapine 5 mg BID), Moyen (ziprasidone 60 mg BID ou olanzapine 15 mg QD) et Élevé (ziprasidone 80 mg BID ou olanzapine 10 mg BID). Le traitement a été initié à faible dose pendant les jours 1 à 7 et, à partir du jour 3, la dose a pu être ajustée.
La phase de traitement (6 mois) comprenait 6 visites: Jour 1 (Semaine 0), Semaine 1, Semaine 4, Semaine 12, Semaine 18 et Semaine 24. Visite de suivi (semaine 48) effectuée six mois après la fin du traitement. Des médicaments à l’étude ont été rapportés de la visite 1 à la visite 6. Les sujets ayant présenté une réponse insuffisante à tout moment au cours de l’étude, comme l’indique un score d’Impression Globale d’Amélioration clinique (IGC-I) ≥ 6, ont été retirés.
Évaluations de l’efficacité et de l’innocuité
Les résultats d’efficacité mesurés étaient le poids, l’IMC et le tour de taille (WC); la pression artérielle et le pouls; l’échelle du syndrome positif et négatif (PANSS) 30; l’échelle de l’impression globale clinique (CGI)31 et une autre pour l’amélioration (CGI-I); l’activité physique du patient; l’échelle des préférences du patient (PPS), pour mesurer la satisfaction du patient à l’égard des médicaments; la version espagnole de l’Indice des services publics de santé – Mark 3 (HUI-3) 32,22. L’appétit a été mesuré par une échelle visuelle analogique (VAS), une méthode de quantification subjective. Le patient marque son niveau d’appétit depuis la dernière visite sur une ligne horizontale marquée 0 (pas d’appétit) à gauche et 10 (extrêmement faim) à droite. La distance à partir de 0 est ensuite mesurée en cm et le niveau d’appétit quantifié.
Tous les résultats d’efficacité ont été évalués à la visite 1 (valeurs de base) et en plus: CGI-S, CGI-I et PANSS de la visite 2 à la visite 7, appétit et activité physique du patient de la visite 3 à la visite 6, PPS et HUI-3 aux visites 4 et 6
Les évaluations de sécurité comprenaient une surveillance clinique, des électrocardiogrammes, des signes vitaux, des événements indésirables (EI) et des tests de laboratoire de sécurité. Les évaluations de sécurité ont été rapportées conformément aux exigences de la Version 3 des Normes de sécurité mondiales (WSS).
Analyse statistique
Toutes les analyses ont été effectuées sur la population d’intention de traitement (ITT), en utilisant la version SAS® 8.2 ou supérieure. Les tests statistiques étaient de 2 à queue et les valeurs p de 0.05 ou moins ont été considérés comme statistiquement significatifs. Le traitement a été adapté en tant que catégorique. des intervalles de confiance (IC) de 95 % ont été construits autour de toutes les différences de traitement estimées. Tous les changements ont été analysés par analyse de la covariance (ANCOVA), y compris les effets pour le groupe de traitement et la valeur de base (le cas échéant). Des statistiques descriptives ont été utilisées pour résumer toutes les évaluations de l’innocuité. Les événements indésirables ont été codés selon le Dictionnaire médical pour les activités de réglementation (MedDRA). Aucun test statistique officiel n’a été effectué sur les paramètres de sécurité.
Résultats
Disposition du sujet et dose du médicament
Bien que l’étude était initialement destinée à 112 patients, au cours de la période d’étude, seuls 58 sujets ont été dépistés. Enfin, 50 patients ITT ont été inclus: 27 à la ziprasidone et 23 à l’olanzapine. Au cours de la période étudiée, 29 sujets au total ont arrêté leur traitement (19 dans le groupe ziprasidone et 10 dans le groupe olanzapine). Bien que la plupart des arrêts n’aient pas été liés au médicament à l’étude, 2 (un dans chaque groupe) étaient dus à un manque d’efficacité et 7 (5 dans la ziprasidone et 2 dans l’olanzapine) étaient dus à des événements indésirables liés au médicament. La durée médiane du traitement était plus faible pour la ziprasidone (52,5 jours) que pour le groupe olanzapine (164 jours; 32% des sujets du groupe ziprasidone et 58% de ceux de l’olanzapine ont terminé l’étude.
Pendant la phase de traitement, les patients sous ziprasidone ont reçu une dose moyenne de 107,4 ± 27,3 mg / jour et les patients sous olanzapine ont reçu une dose moyenne de 15 ± 3,3 mg / jour.
Caractéristiques de base
Les caractéristiques démographiques étaient homogènes entre les deux groupes et ne présentaient aucune différence significative. Les patients ITT étaient âgés de 19 à 63 ans, la majorité étant entre 18 et 44 ans. Des données démographiques détaillées sont fournies dans le tableau 1. Un nombre similaire de sujets des deux groupes de traitement a reçu des traitements médicamenteux concomitants au cours de l’étude (26 dans le groupe ziprasidone et 21 dans le groupe olanzapine). Les prises les plus fréquentes (par ≥ 5 sujets dans l’un ou l’autre groupe de traitement) dans les deux groupes de traitement étaient le lorazépam, le lorméta-zépam et la rispéridone.
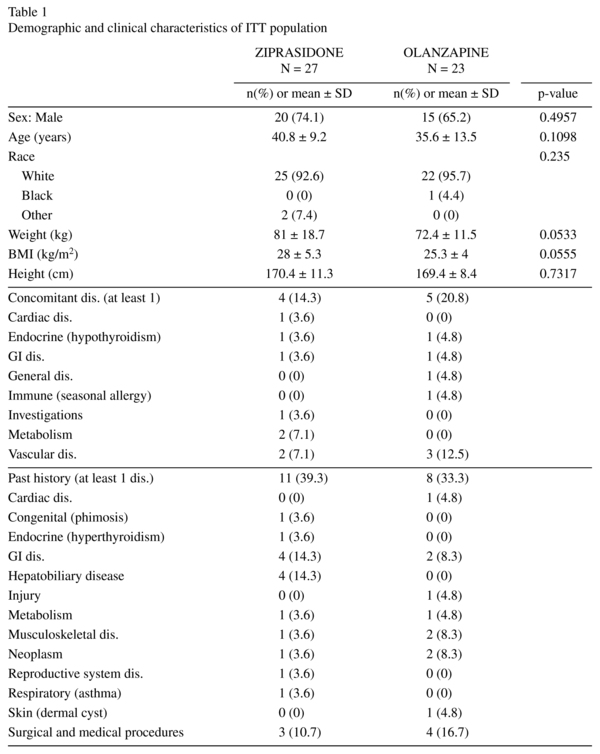
Les effets sur le gain de poids
Le poids corporel était stable à la semaine 24 dans le groupe ziprasidone, ne montrant aucune différence significative avec le poids basal (diminution de -0,1 %; n.s.) alors qu’il y avait une augmentation statistiquement significative par rapport à l’inclusion dans le groupe olanzapine (augmentation de 7,4 % du poids corporel par rapport à l’inclusion, p < 0,0001) (tableau 2). La différence entre les groupes de traitement dans l’évolution du poids corporel par rapport à l’inclusion était statistiquement significative à tous les moments et les patients traités par olanzapine ont montré une augmentation significative du poids par rapport à l’inclusion dans toutes les visites (tableau 2). Le nombre de sujets ayant eu un gain de poids ≥ 7% à la semaine 24 était significativement plus faible dans le groupe ziprasidone (n = 3) que dans le groupe olanzapine (n = 11) (OR = 6,246; p = 0.0150). La différence entre les groupes de traitement était également évidente aux semaines 12 (p = 0,0266) et 18 (p = 0,0261) (données non présentées).

Les paramètres secondaires à la semaine 24 sont résumés dans le tableau 3. Les patients traités par la ziprasidone n’ont pas présenté de changement significatif du WC et de l’IMC à 24 semaines, tandis que les patients traités par l’olanzapine ont subi une augmentation significative des deux paramètres, ce qui a entraîné une différence significative du LSM à 24 semaines (moyenne des moindres carrés) de l’une ou l’autre valeur entre les groupes.

Résultats d’efficacité
Le traitement à la ziprasidone a entraîné une diminution significative (c’est-à-dire une amélioration) du PANNS-N et de l’olanzapine dans une diminution significative de toutes les sous-échelles du PANNS. Toutes les diminutions ont été significativement plus importantes dans le groupe olanzapine que dans le groupe ziprasidone. Cependant, il n’y avait pas de différence significative dans le nombre de patients présentant une amélioration des symptômes de schizophrénie entre les groupes, telle qu’évaluée par PANS (7) ziprasidone vs 11 olanzapine; p = 0,1385). Sur l’échelle CGI-S, 19 patients dans le groupe ziprasidone et 16 dans le groupe olanzapine étaient modérément à nettement malades au début; à 24 semaines, il y avait respectivement 19 et 12 patients (données non présentées). Sur l’échelle CGI-I, 5 patients dans le groupe ziprasidone et 4 dans l’olanzapine étaient « très améliorés » et 1 dans la ziprasidone et 4 dans l’olanzapine « très améliorés » à 24 semaines (données non présentées). Les sujets traités par l’olanzapine ont eu de meilleures cotes d’exacerbation des symptômes (CGI-S) (OR : 3,321, p = 0,0286) et d’amélioration (CGI-I) (OR : 3,512, p = 0.0307) à la semaine 24 que ceux traités par la ziprasidone. Cependant, et de la même manière que les résultats PAN, il n’y a pas eu de différences significatives dans le nombre de patients présentant une amélioration de la CGI-S (4 sous ziprasidone contre 7 sous olanzapine; p = 0,2379) et de la CGI-I (6 sous ziprasidone contre 8 sous olanzapine; p = 0,2823) entre les groupes. Une meilleure satisfaction à l’égard des médicaments, mesurée en SPA, a été observée dans le groupe ziprasidone que dans le groupe olanzapine (p = 0,0161). Comme le montre le tableau 4, l’appétit a également diminué de manière significative chez les patients traités par la ziprasidone, tandis qu’il a légèrement augmenté dans le groupe olanzapine. Bien que l’augmentation de l’appétit chez ces derniers n’ait pas atteint de signification statistique, le changement était statistiquement différent entre les groupes de traitement. Il n’y avait pas de différences significatives entre la pression artérielle et la fréquence cardiaque des groupes de traitement.

Résultats de sécurité
Aucun décès n’a été signalé au cours de cette étude. Les effets indésirables au cours de cette étude et des tests de laboratoire ont été résumés dans le tableau 5. La moitié des événements d’EI dans chaque groupe étaient liés au traitement (ziprasidone: sédation, anxiété, agitation, schizophrénie et hypersomnie; olanzapine: schizophrénie, agitation). Vingt et un EI liés au traitement ont été observés chez 15 sujets (53,6%) du groupe ziprasidone et 11 chez 8 sujets (33,3 %) du groupe olanzapine.

Discussion
Selon le protocole de l’étude, 78 patients (39 dans chaque groupe) auraient dû être évalués pour une puissance statistique de 80% pour détecter une différence de 5 kg, estimant un écart-type = 7,7. Cependant, la population finale d’ITT incluse était de 50 patients. Bien que cela ait pu représenter une limitation, la différence de poids corporel entre les groupes à 24 semaines était de 7,5% (ET = 4,5). La puissance était de 99% et le résultat était meilleur que prévu initialement.
En accord avec les études précédentes, le poids corporel était stable dans le groupe ziprasidone tandis qu’il y avait une augmentation statistiquement significative par rapport à l’inclusion dans le groupe olanzapine à chaque point de temps6,7. En conséquence, les patients traités par la ziprasidone n’ont présenté aucune modification significative du WC et de l’IMC, tandis que les patients traités par l’olanzapine ont subi une augmentation significative des paramètres et du poids. Dans une étude précédente34, le pourcentage de patients traités par olanzapine avec une prise de poids ≥ 7% était encore plus élevé : 60% des patients à 3 mois, ce pourcentage passant à 80% après 1 an de traitement par olanzapine. La posologie de l’olanzapine de l’étude mentionnée était similaire ou inférieure à celle de notre étude. Ce fait n’est pas surprenant, car la dose n’a pas été liée à la prise de poids de l’olanzapine, mais à la réponse thérapeutique25. Les patients présentant un bénéfice maximal de l’olanzapine sur les symptômes sont également ceux qui présentent le risque le plus élevé de prise de poids significative.
Des variations de l’apport alimentaire ont été proposées comme cause possible de ces effets sur le poids. Dans cette étude, l’appétit a diminué de manière significative chez les patients traités par la ziprasidone tandis qu’aucun changement significatif chez les patients traités par l’olanzapine n’a été rapporté. La stimulation de l’appétit est fortement corrélée à l’affinité des médicaments antipsychotiques pour les récepteurs adrénergiques H1 et alpha135 et la diminution de l’appétit chez les patients traités par la ziprasidone est probablement associée à la faible affinité du médicament pour le récepteur H1. Les patients traités par olanzapine n’ont pas montré d’augmentation significative de l’appétit, mais ont tout de même montré une augmentation significative du poids corporel, suggérant que d’autres mécanismes pourraient être impliqués dans la prise de poids induite par l’olanzapine. Tschoner et coll. on a constaté une glycémie à jeun plus élevée et un score accru dans un modèle de résistance à l’insuline chez les patients traités par l’olanzapine, alors que cet effet n’a pas pu être observé chez les patients traités par la ziprasidone, indiquant l’implication de cet effet dans la prise de poids induite par l’olanzapine6. Des études chez l’animal ont montré que l’olanzapine, mais pas la ziprasidone, stimule la consommation de graisses 36 et que le traitement chronique par l’olanzapine altère la lipolyse par les adipocytes37. En outre, des études antérieures ont révélé une augmentation du cholestérol, des triglycérides et du cholestérol LDL chez les patients traités par l’olanzapine et non chez les personnes traitées par la ziprasidone6,38. L’activité physique est significativement réduite chez les patients traités par l’olanzapine39,40, mais le OU de l’exercice physique dans cette étude favorise significativement l’olanzapine par rapport aux patients traités par la ziprasidone et n’explique donc pas la différence de prise de poids.
Les patients traités par l’olanzapine ont montré des résultats significativement meilleurs dans les sous-échelles des PAN que ceux traités par la ziprasidone, confirmant les résultats d’une étude précédente20. Les participants à cette étude avaient interrompu un traitement précédent en raison d’une intolérance, ce qui rendait difficile la comparaison avec notre étude actuelle. La dose de ziprasidone était similaire mais la dose d’olanzapine était plus élevée. L’olanzapine présente des courbes dose-réponse croissantes pour les symptômes de la schizophrène21,41, ce qui pourrait expliquer l’amélioration plus importante des PAN par rapport à la ziprasidone dans l’étude avec une dose d’olanzapine plus élevée. Cependant, des doses d’olanzapine supérieures à 20 mg/jour ont été décrites comme présentant des risques plus élevés d’effets secondaires importants42,43.
En revanche, deux autres études n’ont trouvé aucune différence d’efficacité entre les traitements. L’étude réalisée par Lieberman et al.7 n’a montré aucune différence significative dans la variation du score total des PAN par rapport à l’inclusion ni entre l’olanzapine et la ziprasidone. De même, l’étude de Simpson et al. aucune différence n’a été observée dans l’amélioration du score des PANNS entre les groupes26,27. Ces études ont utilisé des doses flexibles similaires à celles que nous avons utilisées et ont trouvé la même efficacité avec l’olanzapine ou la ziprasidone. Une explication plausible pourrait être que, bien que la ziprasidone soit indiquée pour le traitement de la schizophrénie à une gamme de doses de 40 à 160 mg / jour, la dose optimale est plus proche de 120 mg / jour44 et la dose moyenne de notre étude, légèrement inférieure aux doses moyennes des deux autres études, pourrait ne pas avoir été optimale. De plus, la dose biodisponible aurait pu être encore plus faible. Bien que le taux plasmatique de ziprasidone montre une corrélation positive significative avec l’occupation des récepteurs, la dose ne prédit pas le taux plasmatique 44, car les aliments peuvent interférer sur l’absorption de ziprasidone 45, les effets peuvent dépendre du moment du traitement.
Il y a eu 1,6 fois plus d’arrêts de traitement dans le groupe ziprasidone que dans le groupe olanzapine, montrant une différence de pli plus élevée entre les deux traitements que dans les autres études7,20. La plupart des EI étaient légers ou modérés dans les deux groupes et comprenaient des événements indésirables habituellement observés avec ces médicaments20,34. L’échelle PPS indique que les patients ont préféré la ziprasidone à l’olanzapine.
Cette étude montre une augmentation significativement plus importante du poids corporel à la semaine 24 chez les patients traités par olanzapine que chez ceux traités par ziprasidone. La réduction progressive de l’appétit rapportée peut avoir contribué à la légère diminution du poids corporel observée chez les patients traités par la ziprasidone. D’autre part, les patients sous olanzapine ont indiqué une certaine augmentation de leur appétit, mais les changements dans ce groupe n’étaient pas significatifs et n’ont pas montré l’augmentation progressive de la variation rapportée par les patients atteints de ziprasidone. L’échelle analogique visuelle est une méthode subjective de mesure de l’appétit, et bien que les différences d’appétit soient significatives et que les résultats semblent consistants au cours de l’étude, une légère augmentation de l’appétit ou un manque d’exercice ne semblent pas responsables de la prise de poids chez les patients traités par l’olanzapine, suggérant d’autres mécanismes. La préférence pour les aliments gras et la dérégulation métabolique peuvent jouer un rôle dans la cause sous-jacente. Les groupes ziprasidone et olanzapine ont été bien tolérés et ont montré une diminution des scores PANSS à la semaine 24. Bien que la diminution ait été significativement plus importante pour tous les scores du groupe olanzapine, la possibilité d’une biodisponibilité réduite de la ziprasidone ne peut être exclue.
Chez les patients pour lesquels la prise de poids pendant le traitement de la schizophrénie peut poser problème, un traitement par ziprasidone doit être essayé, en raison de son bon profil de sécurité dans ce domaine.
Remerciements
Le soutien à la rédaction médicale a été fourni par Medical Statistics Consulting et a été financé par Pfizer.
1. Allison DB, Fontaine KR, Heo M, Mentore JL, Cappelleri JC, Chandler LP, et al. La distribution de l’indice de masse corporelle chez les individus atteints et non atteints de schizophrénie. J Clin Psychiatry 1999; 60 (4): 215-220.
2. Baptista T, De Mendoza S, Beaulieu S, Bermudez A, Martinez M. Le syndrome métabolique lors du traitement antipsychotique atypique: mécanismes et gestion. Metab Syndr Relat Disord 2004; 2(4): 290-307.
3. Enger C, Weatherby L, Reynolds RF, Glasser DB, Walker AM. Événements cardiovasculaires graves et mortalité chez les patients atteints de schizophrénie. J Nerv Ment Dis 2004; 192(1): 19-27.
4. Allison DB, Mentore JL, Heo M, Chandler LP, Cappelleri JC, Infante MC et coll. Gain de poids induit par les antipsychotiques: une synthèse de recherche complète. Am J Psychiatrie 1999; 156 (11): 1686-1696.
5. Kane JM, Barrett EJ, Casey DE, Correll CU, Gelenberg AJ, Klein S, et coll. Effets métaboliques du traitement avec des antipsychotiques atypiques. J Clin Psychiatry 2004; 65 (11): 1447-1455.
6. Tschoner A, Engl J, Rettenbacher M, Edlinger M, Kaser S, Tatarczyk T, et al. Effets de six antipsychotiques de deuxième génération sur le poids corporel et le métabolisme – évaluation des risques et résultats d’une étude prospective. Pharmacopsychiatrie 2009; 42 (1): 29-34.
7. Lieberman JA, Stroup TS, McEvoy JP, Swartz MS, Rosenheck RA, Perkins DO, et al. Efficacité des médicaments antipsychotiques chez les patients atteints de schizophrénie chronique. N Engl J Med 2005; 353 (12): 1209-1223.
8. DJ roi. Traitement médicamenteux des symptômes négatifs de la schizophrénie. Eur Neuropsychopharmacol 1998; 8(1):33-42.
9. Weiden P, Aquila R, Standard J. Médicaments antipsychotiques atypiques et résultats à long terme dans la schizophrénie. J Clin Psychiatry 1996; 57 (Suppl 11): 53-60.
10. Drici MD, Priori S. Risques cardiovasculaires d’un traitement antipsychotique atypique. Médicament pharmacoépidémiol Saf 2007; 16 (8): 882-890.
11. Gao K, Ganocy SJ, Gajwani P, Muzina DJ, Kemp DE, Calabrese JR. Un examen de la sensibilité et de la tolérabilité des antipsychotiques chez les patients atteints de trouble bipolaire ou de schizophrénie: focus sur la somnolence. J Clin Psychiatry 2008; 69 (2): 302-309.
12. Nasrallah HA. Effets secondaires métaboliques atypiques induits par les antipsychotiques: aperçu des profils de liaison aux récepteurs. Mol Psychiatry 2008; 13 (1): 27-35.
13. Baldwin D, Mayers A. Effets secondaires sexuels des antidépresseurs et des antipsychotiques. Traitement psychiatrique Adv 2003; 9 (3): 202-210.
14. Montejo AL. Sensibilisation à la prolactine: une considération essentielle pour la santé physique dans la schizophrénie. Eur Neuropsychopharmacol 2008; 18 (Suppl 2): S108-114.
15. Keck PE, Jr., McElroy SL, Arnold LM. Ziprasidone : un nouvel antipsychotique atypique. Expert Opin Pharmacother 2001; 2 (6): 1033-1042.
16. Kane JM, Khanna S, Rajadhyaksha S, Giller E. Efficacité et tolérabilité de la ziprasidone chez les patients atteints de schizophrénie résistante au traitement. Int Clin Psychopharmacol 2006; 21 (1): 21-28.
17. Keck P, Jr., Buffenstein A, Ferguson J, Feighner J, Jaffe W, Harrigan EP, et al. Ziprasidone 40 et 120 mg / jour dans l’exacerbation aiguë de la schizophrénie et du trouble schizo-affectif: un essai contrôlé par placebo de 4 semaines. Psychopharmacologie (Berl) 1998; 140(2): 173-184.
18. Montejo AL, Rico – Villademoros F. Modifications de la fonction sexuelle chez les patients ambulatoires atteints de schizophrénie ou d’autres troubles psychotiques traités avec de la ziprasidone en milieu de pratique clinique: une étude prospective et observationnelle de 3 mois. J Clin Psychopharmacol 2008; 28 (5): 568-570.
19. Kingsbury SJ, Fayek M, Trufasiu D, Zada J, Simpson GM. Les effets apparents de la ziprasidone sur les lipides plasmatiques et le glucose. J Clin Psychiatry 2001; 62 (5): 347-349.
20. Stroup TS, Lieberman JA, McEvoy JP, Swartz MS, Davis SM, Rosenheck RA, et al. Efficacité de l’olanzapine, de la quétiapine, de la rispéridone et de la ziprasidone chez les patients atteints de schizophrénie chronique après l’arrêt d’un antipsychotique atypique antérieur. Am J Psychiatry 2006; 163 (4): 611-622.
21. Beasley CM, Jr., Tollefson G, Tran P, Satterlee W, Sanger T, Hamilton S. Olanzapine versus placebo et halopéridol: résultats en phase aiguë de l’essai nord-américain en double aveugle sur l’olanzapine. Neuropsychopharmacologie 1996; 14 (2): 111-123.
22. Conley RR, Mahmoud R. Une étude randomisée en double aveugle de la rispéridone et de l’olanzapine dans le traitement de la schizophrénie ou du trouble schizo-affectif. Am J Psychiatry 2001; 158 (5): 765-774.
23. Gomez JC, Crawford SUIS. Efficacité supérieure de l’olanzapine par rapport à l’halopéridol: analyse de patients atteints de schizophrénie à partir d’un essai international multicentrique. J Clin Psychiatry 2001; 62 (Suppl 2): 6-11.
24. Bobes J, Rejas J, Garcia-Garcia M, Rico-Villademoros F, Garcia-Portilla MP, Fernandez I, et al. Prise de poids chez les patients schizophrènes traités par rispéridone, olanzapine, quétiapine ou halopéridol: résultats de l’étude EIRE. Schizophr Res 2003; 62 (1-2): 77-88.
25. Kinon BJ, Kaiser CJ, Ahmed S, Rotelli MD, Kollack-Walker S. Association entre un gain de poids précoce et rapide et un changement de poids sur un an de traitement par l’olanzapine chez les patients atteints de schizophrénie et de troubles associés. J Clin Psychopharmacol 2005; 25 (3): 255-258.
26. Simpson GM, Glick ID, Weiden PJ, Romano SJ, Siu CO. Comparaison multicentrique randomisée, contrôlée et en double aveugle de l’efficacité et de la tolérabilité de la ziprasidone et de l’olanzapine chez les patients hospitalisés gravement malades atteints de schizophrénie ou de trouble schizo-affectif. Am J Psychiatry 2004; 161 (10): 1837-1847.
27. Simpson GM, Weiden P, Pigott T, Murray S, Siu CO, Romano SJ. Étude de continuation multicentrique de six mois en aveugle de la ziprasidone par rapport à l’olanzapine dans la schizophrénie. Am J Psychiatrie 2005; 162 (8): 1535-1538.
28. Association Américaine de Psychiatrie., Association Américaine de Psychiatrie. Groupe de travail sur le DSM-IV. Manuel diagnostique et statistique des troubles mentaux: DSM-IV-TR. 4e éd. Washington, DC : Association américaine de psychiatrie; 2000.
29. AMM. Déclaration d’Helsinki de l’Association Médicale Mondiale: principes éthiques pour la recherche médicale impliquant des sujets humains. J Postgrad Med. 2002; 48(3): 206-208.
30. Kay SR, Fiszbein A, Opler LA. L’échelle du syndrome positif et négatif (PANSS) pour la schizophrénie. Schizophr Bull 1987; 13 (2): 261-276.
31. Guy W, Institut national de la santé mentale (États-Unis). Direction de la recherche en Psychopharmacologie., Programme d’Évaluation Clinique Précoce des Médicaments. Manuel d’évaluation ECDEU pour la psychopharmacologie. Rév. ed. La ville de Rockville, dans le Maryland.: Département des États-Unis de la Santé, de l’Éducation et du Bien-être, du Service de Santé Publique, de l’Administration de l’alcoolisme, de l’abus de Drogues et de la Santé mentale, Institut National de la Santé mentale, Direction de la Recherche en Psychopharmacologie, Division des Programmes de recherche extra-muros; 1976.
32. Feeny D, Furlong W, Boyle M, Torrance GW. Systèmes de classification de l’état de santé à attributs multiples. Indice des services publics de santé. Pharmacoéconomie 1995; 7 (6): 490-502.
33. Ruiz M, Rejas J, Soto J, Pardo A, Rebollo I. Adaptation et validation de l’indice des services de santé Mark 3 en espagnol et normes de correction pour la population espagnole. Med Clin (Barc) 2003; 120(3): 89-96.
34. McEvoy JP, Lieberman JA, Perkins DO, Hamer RM, Gu H, Lazarus A, et al. Efficacité et tolérance de l’olanzapine, de la quétiapine et de la rispéridone dans le traitement de la psychose précoce : comparaison randomisée en double aveugle sur 52 semaines. Am J Psychiatrie 2007; 164 (7): 1050-1060.
35. Baptista T, Zarate J, Joober R, Colasante C, Beaulieu S, Paez X, et al. Prise de poids induite par les médicaments, un obstacle à une pharmacothérapie réussie: concentrez-vous sur les antipsychotiques. Curr Drug Targets 2004; 5(3): 279-299.
36. Hartfield AW, Moore NA, Clifton PG. Effects of atypical antipsychotic drugs on intralipid intake and cocaine-induced hyperactivity in rats. Neuropsychopharmacologie 2006; 31 (9): 1938-1945.
37. Minet-Ringuet J, Même PC, Valet P, Carpène C, Visentin V, Prévot D, et al. Altérations du métabolisme lipidique et de l’expression génique dans les adipocytes de rat pendant le traitement chronique par l’olanzapine. Mol Psychiatry 2007; 12 (6): 562-571.
38. Rettenbacher MA, Ebenbichler C, Hofer A, Kemmler G, Baumgartner S, Edlinger M, et al. Changements précoces des lipides plasmatiques pendant le traitement par antipsychotiques atypiques. Int Clin Psychopharmacol 2006; 21 (6): 369-372.
39. Il s’agit de l’un des principaux organismes de recherche et de développement du Canada. The distinct effects of subchronic antipsychotic drug treatment on macronutrient selection, body weight, adiposity, and metabolism in female rats. Psychopharmacologie (Berl) 2007; 194(2): 221-231.
40. Fleischhaker C, Heiser P, Hennighausen K, Herpertz-Dahlmann B, Holtkamp K, Mehler-Wex C, et al. Surveillance clinique des médicaments en psychiatrie de l’enfant et de l’adolescent: effets secondaires des neuroleptiques atypiques. J Enfant Adolesc Psychopharmacol 2006; 16 (3): 308-316.
41. Fanous A, Lindenmayer JP. Schizophrénie et trouble schizo-affectif traités par des doses élevées d’olanzapine. J Clin Psychopharmacol 1999; 19 (3): 275-276.
42. Farah A. Atypicité des antipsychotiques atypiques. Prim Care Companion J Clin Psychiatry 2005; 7 (6): 268-274.
43. Reich J. Utilisation de l’olanzapine à haute dose dans la psychose réfractaire. Am J Psychiatrie 1999; 156(4): 661.
44. Mamo D, Kapur S, Shammi CM, Papatheodorou G, Mann S, Therrien F, et al. A TEP study of dopamine D2 and serotonin 5-HT2 receptor occupation in patients with schizophrenia treated with therapeutic doses of ziprasidone. Am J Psychiatry 2004; 161 (5): 818-825.
45. Hamelin B.A., Allard S., Laplante L., Miceli J., Wilner K.D., Tremblay J., et coll. L’effet de la synchronisation d’un repas standard sur la pharmacocinétique et la pharmacodynamique du nouvel antipsychotique atypique ziprasidone. Pharmacothérapie 1998; 18 (1): 9-15.