Objectifs d’apprentissage
À la fin de cette section, vous pourrez:
- Examiner le transfert de chaleur.
- Calculez la température finale à partir du transfert de chaleur.
Jusqu’à présent, nous avons discuté du changement de température dû au transfert de chaleur. Aucun changement de température ne se produit par transfert de chaleur si la glace fond et devient de l’eau liquide (c.-à-d. lors d’un changement de phase). Par exemple, considérez l’eau qui coule des glaçons qui fondent sur un toit réchauffé par le soleil. Inversement, l’eau gèle dans un bac à glace refroidi par un environnement à basse température.

Figure 1. La chaleur de l’air se transfère sur la glace, la faisant fondre. (crédit: Mike Brand)
L’énergie est nécessaire pour faire fondre un solide car les liaisons cohésives entre les molécules du solide doivent être brisées de sorte que, dans le liquide, les molécules puissent se déplacer à des énergies cinétiques comparables; ainsi, il n’y a pas d’élévation de température. De même, l’énergie est nécessaire pour vaporiser un liquide, car les molécules d’un liquide interagissent les unes avec les autres via des forces d’attraction. Il n’y a pas de changement de température tant qu’un changement de phase n’est pas terminé. La température d’une tasse de soda initialement à 0ºC reste à 0ºC jusqu’à ce que toute la glace ait fondu. Inversement, l’énergie est libérée lors de la congélation et de la condensation, généralement sous forme d’énergie thermique. Le travail est effectué par des forces de cohésion lorsque les molécules sont réunies. L’énergie correspondante doit être dégagée (dissipée) pour leur permettre de rester ensemble Figure 2.
L’énergie impliquée dans un changement de phase dépend de deux facteurs majeurs : le nombre et la force des liaisons ou paires de forces. Le nombre de liaisons est proportionnel au nombre de molécules et donc à la masse de l’échantillon. La force des forces dépend du type de molécules. La chaleur Q nécessaire pour changer la phase d’un échantillon de masse m est donnée par
Q= mLf(fusion/congélation,
Q=mLv (vaporisation/condensation),
où la chaleur latente de fusion, Lf, et la chaleur latente de vaporisation, Lv, sont des constantes matérielles qui sont déterminées expérimentalement. Voir (Tableau 1).

Figure 2. (a) L’énergie est nécessaire pour surmonter partiellement les forces d’attraction entre les molécules dans un solide pour former un liquide. Cette même énergie doit être retirée pour que la congélation ait lieu. (b) Les molécules sont séparées par de grandes distances lorsqu’elles passent du liquide à la vapeur, ce qui nécessite une énergie importante pour surmonter l’attraction moléculaire. La même énergie doit être éliminée pour que la condensation ait lieu. Il n’y a pas de changement de température tant qu’un changement de phase n’est pas terminé.
La chaleur latente est mesurée en unités de J/kg. Lf et Lv dépendent tous deux de la substance, en particulier de la force de ses forces moléculaires comme indiqué précédemment. Lf et Lv sont collectivement appelés coefficients de chaleur latente. Ils sont latents, ou cachés, car lors des changements de phase, l’énergie entre ou sort d’un système sans provoquer de changement de température dans le système; ainsi, en effet, l’énergie est cachée. Le tableau 1 énumère les valeurs représentatives de Lf et de Lv, ainsi que les points de fusion et d’ébullition.
Le tableau montre que des quantités importantes d’énergie sont impliquées dans les changements de phase. Regardons, par exemple, la quantité d’énergie nécessaire pour faire fondre un kilogramme de glace à 0ºC pour produire un kilogramme d’eau à 0 ° C. En utilisant l’équation pour un changement de température et la valeur pour l’eau du tableau 1, nous trouvons que Q = mLf = (1.0 kg) (334 kJ/kg) = 334 kJ est l’énergie nécessaire pour faire fondre un kilogramme de glace. C’est beaucoup d’énergie car cela représente la même quantité d’énergie nécessaire pour élever la température de 1 kg d’eau liquide de 0ºC à 79,8ºC. Encore plus d’énergie est nécessaire pour vaporiser l’eau; il faudrait 2256 kJ pour changer 1 kg d’eau liquide au point d’ébullition normal (100ºC à pression atmosphérique) en vapeur (vapeur d’eau). Cet exemple montre que l’énergie pour un changement de phase est énorme par rapport à l’énergie associée aux changements de température sans changement de phase.
| Table 1. Heats of Fusion and Vaporization | ||||||
|---|---|---|---|---|---|---|
| Lf | Lv | |||||
| Substance | Melting point (ºC) | kJ/kg | kcal/kg | Boiling point (°C) | kJ/kg | kcal/kg |
| Helium | −269.7 | 5.23 | 1.25 | −268.9 | 20.9 | 4.99 |
| Hydrogen | −259.3 | 58.6 | 14.0 | −252.9 | 452 | 108 |
| Nitrogen | −210.0 | 25.5 | 6.09 | −195.8 | 201 | 48.0 |
| Oxygen | −218.8 | 13.8 | 3.30 | −183.0 | 213 | 50.9 |
| Ethanol | −114 | 104 | 24.9 | 78.3 | 854 | 204 |
| Ammonia | −75 | 108 | −33.4 | 1370 | 327 | |
| Mercury | −38.9 | 11.8 | 2.82 | 357 | 272 | 65.0 |
| Water | 0.00 | 334 | 79.8 | 100.0 | 2256 | 539 |
| Sulfur | 119 | 38.1 | 9.10 | 444.6 | 326 | 77.9 |
| Lead | 327 | 24.5 | 5.85 | 1750 | 871 | 208 |
| Antimony | 631 | 165 | 39.4 | 1440 | 561 | 134 |
| Aluminum | 660 | 380 | 90 | 2450 | 11400 | 2720 |
| Silver | 961 | 88.3 | 21.1 | 2193 | 2336 | 558 |
| Gold | 1063 | 64.5 | 15.4 | 2660 | 1578 | 377 |
| Copper | 1083 | 134 | 32.0 | 2595 | 5069 | 1211 |
| Uranium | 1133 | 84 | 20 | 3900 | 1900 | 454 |
| Tungsten | 3410 | 184 | 44 | 5900 | 4810 | 1150 |
Phase changes can have a tremendous stabilizing effect even on temperatures that are not near the melting and boiling points, because evaporation and condensation (conversion of a gas into a liquid state) occur even at temperatures below the boiling point. Prenons, par exemple, le fait que les températures de l’air dans les climats humides dépassent rarement 35,0 ºC, ce qui est dû au fait que la majeure partie du transfert de chaleur se fait dans l’évaporation de l’eau dans l’air. De même, les températures par temps humide tombent rarement en dessous du point de rosée car une chaleur énorme est libérée lorsque la vapeur d’eau se condense.
Nous examinons plus précisément les effets du changement de phase en considérant l’ajout de chaleur dans un échantillon de glace à − 20ºC (Figure 3). La température de la glace augmente linéairement, absorbant la chaleur à un taux constant de 0,50 cal / gººC jusqu’à ce qu’elle atteigne 0ºC. Une fois à cette température, la glace commence à fondre jusqu’à ce que toute la glace ait fondu, absorbant 79,8 cal/ g de chaleur. La température reste constante à 0ºC pendant ce changement de phase. Une fois que toute la glace a fondu, la température de l’eau liquide augmente, absorbant la chaleur à un nouveau taux constant de 1,00 cal / gººC. À 100ºC, l’eau commence à bouillir et la température reste à nouveau constante tandis que l’eau absorbe 539 cal / g de chaleur pendant ce changement de phase. Lorsque tout le liquide est devenu de la vapeur de vapeur, la température augmente à nouveau, absorbant la chaleur à un taux de 0,482 cal / gººC.
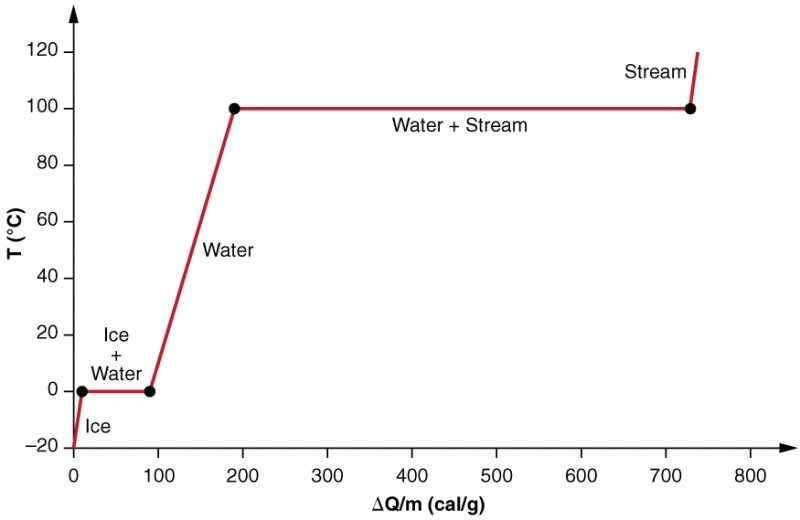
Figure 3. Un graphique de la température par rapport à l’énergie ajoutée. Le système est construit de telle sorte qu’aucune vapeur ne s’évapore pendant que la glace se réchauffe pour devenir de l’eau liquide, et de telle sorte que, lors de la vaporisation, la vapeur reste dans le système. Les longues étendues de valeurs de température constante à 0ºC et 100ºC reflètent la grande chaleur latente de fusion et de vaporisation, respectivement.
L’eau peut s’évaporer à des températures inférieures au point d’ébullition. Plus d’énergie est nécessaire qu’au point d’ébullition, car l’énergie cinétique des molécules d’eau à des températures inférieures à 100ºC est inférieure à celle à 100ºC, donc moins d’énergie est disponible à partir de mouvements thermiques aléatoires. Prenons, par exemple, le fait qu’à température corporelle, la transpiration de la peau nécessite un apport de chaleur de 2428 kJ / kg, ce qui est environ 10% plus élevé que la chaleur latente de vaporisation à 100ºC. Cette chaleur provient de la peau et fournit ainsi un mécanisme de refroidissement efficace par temps chaud. Une humidité élevée inhibe l’évaporation, de sorte que la température corporelle pourrait augmenter, laissant une sueur non évaporée sur votre front.
Exemple 1. Calculer la température finale à partir du changement de phase: Refroidissement de la soude avec des glaçons
Trois glaçons sont utilisés pour refroidir une soude à 20ºC avec une masse msoda = 0,25 kg. La glace est à 0ºC et chaque glaçon a une masse de 6,0 g. Supposons que la soude soit conservée dans un récipient en mousse afin que la perte de chaleur puisse être ignorée. Supposons que le soda ait la même capacité calorifique que l’eau. Trouvez la température finale lorsque toute la glace a fondu.
Stratégie
Les glaçons sont à la température de fusion de 0ºC. La chaleur est transférée de la soude à la glace pour la fusion. La fonte de la glace se fait en deux étapes: d’abord le changement de phase se produit et le solide (glace) se transforme en eau liquide à la température de fusion, puis la température de cette eau augmente. La fusion donne de l’eau à 0ºC, donc plus de chaleur est transférée de la soude à cette eau jusqu’à ce que le système eau plus soude atteigne l’équilibre thermique, Qice =−Qsoda.
La chaleur transférée à la glace est
Qice=mice Lf + micecW (Tf−0ºC).
La chaleur dégagée par la soude est Qsoda = msodacW (Tf−20ºC). Comme aucune chaleur n’est perdue, Qice =−Qsoda, de sorte que
souris Lf + micecW(Tf−0ºC) =–msodacW(Tf−20ºC).
Apportez tous les termes impliquant Tf du côté gauche et tous les autres termes du côté droit. Résoudre pour la quantité inconnue Tf:
\displaystyle{T}_{\text{f}}=\frac{m_{\text{soda}}c_{\text{W}}\left(20^{\circ}\text{C}\right)-m_{\text{ice}}L_{\text{f}}}{\left(m_{\text{soda}}+m_{\text{ice}}\right)c_{\text{W}}}\\
Solution
- Identifiez les quantités connues. La masse de glace est de souris = 3 × 6,0 g = 0,018 kg et la masse de soude est de msoda = 0,25 kg.
- Calculez les termes au numérateur: m sodacW (20ºC) = (0,25 kg) (4186 J / kg º ºC) (20ºC) = 20 930 J et miceLf = (0,018 kg) (334 000 J / kg) = 6012 J.
- Calculez le dénominateur: (msoda + souris) cW = (0,25 kg + 0.018 kg) (4186 K/(kgººC) = 1122 J/ºC.
- Calculez la température finale : \displaystyle{T}_{\text{f}} = \frac{20,930\text{J}-6012\text{J}}{1122\text{J/}^{\circ}\text{C}} =13^{\circ}\text{C}\\
Discussion
Cet exemple illustre les énormes énergies impliquées lors d’un changement de phase. La masse de glace représente environ 7% de la masse d’eau, mais entraîne un changement notable de la température de la soude. Bien que nous ayons supposé que la glace était à la température de congélation, cela est incorrect: la température typique est de −6ºC. Cependant, cette correction donne une température finale qui est essentiellement identique au résultat que nous avons trouvé. Pouvez-vous expliquer pourquoi?

Figure 4. Condensation sur un verre de thé glacé. (crédit: Jenny Downing)
Nous avons vu que la vaporisation nécessite un transfert de chaleur vers un liquide de l’environnement, de sorte que l’énergie est libérée par l’environnement. La condensation est le processus inverse, augmentant la température de l’environnement. Cette augmentation peut sembler surprenante, car nous associons la condensation à des objets froids — le verre de la figure, par exemple. Cependant, l’énergie doit être retirée des molécules de condensation pour faire condenser une vapeur. L’énergie est exactement la même que celle nécessaire pour effectuer le changement de phase dans l’autre sens, du liquide à la vapeur, et elle peut donc être calculée à partir de Q = mLv.
La condensation se forme sur la figure 4 parce que la température de l’air à proximité est réduite au-dessous du point de rosée. L’air ne peut pas contenir autant d’eau qu’à température ambiante, et donc l’eau se condense. L’énergie est libérée lorsque l’eau se condense, accélérant la fonte de la glace dans le verre.
Application dans le monde réel
L’énergie est également libérée lorsqu’un liquide gèle. Ce phénomène est utilisé par les producteurs de fruits en Floride pour protéger les oranges lorsque la température est proche du point de congélation (0ºC). Les producteurs pulvérisent de l’eau sur les plantes dans les vergers afin que l’eau gèle et que la chaleur soit libérée sur les oranges en croissance sur les arbres. Cela empêche la température à l’intérieur de l’orange de descendre en dessous du point de congélation, ce qui endommagerait le fruit.

Figure 14.11. La glace sur ces arbres a libéré de grandes quantités d’énergie lorsqu’elle a gelé, aidant à empêcher la température des arbres de descendre en dessous de 0ºC. L’eau est intentionnellement pulvérisée sur les vergers pour aider à prévenir les gelées dures. (crédit: Hermann Hammer)
La sublimation est la transition de la phase solide à la phase vapeur. Vous avez peut-être remarqué que la neige peut disparaître dans l’air sans trace d’eau liquide ou la disparition de glaçons dans un congélateur. L’inverse est également vrai: du givre peut se former sur des fenêtres très froides sans passer par l’étape liquide. Un effet populaire est la fabrication de ”fumée » à partir de glace carbonique, qui est du dioxyde de carbone solide. La sublimation se produit parce que la pression de vapeur d’équilibre des solides n’est pas nulle. Certains désodorisants utilisent la sublimation d’un solide pour injecter un parfum dans la pièce. Les boules de mites sont un exemple légèrement toxique d’un phénol (un composé organique) qui se sublime, tandis que certains solides, tels que le tétroxyde d’osmium, sont si toxiques qu’ils doivent être conservés dans des récipients scellés pour éviter l’exposition humaine à leurs vapeurs produites par sublimation.

Figure 5. Les transitions directes entre le solide et la vapeur sont courantes, parfois utiles et même belles. a) La glace carbonique se sublime directement en dioxyde de carbone. La vapeur visible est constituée de gouttelettes d’eau. (crédit: Windell Oskay) (b) Le givre forme des motifs sur une fenêtre très froide, un exemple de solide formé directement à partir d’une vapeur. (crédit: Liz West)
Toutes les transitions de phase impliquent de la chaleur. Dans le cas de transitions directes solide-vapeur, l’énergie requise est donnée par l’équation Q = mLs, où Ls est la chaleur de sublimation, qui est l’énergie nécessaire pour changer 1.00 kg d’une substance de la phase solide à la phase vapeur. Ls est analogue à Lf et Lv, et sa valeur dépend de la substance. La sublimation nécessite un apport d’énergie, de sorte que la glace carbonique est un liquide de refroidissement efficace, tandis que le processus inverse (c’est-à-dire le glaçage) libère de l’énergie. La quantité d’énergie nécessaire à la sublimation est du même ordre de grandeur que celle des autres transitions de phase.
Le matériel présenté dans cette section et dans la section précédente nous permet de calculer un nombre quelconque d’effets liés à la température et au changement de phase. Dans chaque cas, il est nécessaire d’identifier les changements de température et de phase en cours, puis d’appliquer l’équation appropriée. Gardez à l’esprit que le transfert de chaleur et le travail peuvent provoquer à la fois des changements de température et de phase.
Stratégies de résolution de problèmes pour les effets du transfert de chaleur
- Examinez la situation pour déterminer s’il y a un changement de température ou de phase. Y a-t-il un transfert de chaleur dans ou hors du système? Lorsque la présence ou l’absence d’un changement de phase n’est pas évidente, vous pouvez d’abord résoudre le problème comme s’il n’y avait pas de changement de phase, et examiner le changement de température obtenu. S’il suffit de dépasser un point d’ébullition ou de fusion, vous devez ensuite revenir en arrière et faire le problème par étapes — changement de température, changement de phase, changement de température ultérieur, etc.
- Identifiez et répertoriez tous les objets qui changent de température et de phase.
- Identifiez exactement ce qui doit être déterminé dans le problème (identifiez les inconnues). Une liste écrite est utile.
- Faites une liste de ce qui est donné ou de ce qui peut être déduit du problème comme indiqué (identifiez les knowns).
- Résolvez l’équation appropriée pour la quantité à déterminer (l’inconnue). En cas de changement de température, la chaleur transférée dépend de la chaleur spécifique (voir Tableau 1 en Changement de température et Capacité Calorifique) alors que, pour un changement de phase, la chaleur transférée dépend de la chaleur latente. Voir Tableau 1.
- Remplacez les knowns avec leurs unités dans l’équation appropriée et obtenez des solutions numériques complètes avec des unités. Vous devrez le faire par étapes s’il y a plus d’une étape dans le processus (comme un changement de température suivi d’un changement de phase).
- Vérifiez la réponse pour voir si elle est raisonnable: Est-ce que cela a du sens? A titre d’exemple, assurez-vous que le changement de température ne provoque pas non plus un changement de phase que vous n’avez pas pris en compte.
Vérifiez votre compréhension
Pourquoi la neige reste-t-elle sur les pentes des montagnes même lorsque les températures diurnes sont supérieures à la température de congélation?
Solution
La neige est formée de cristaux de glace et constitue donc la phase solide de l’eau. Parce qu’une chaleur énorme est nécessaire pour les changements de phase, il faut un certain temps pour que cette chaleur s’accumule dans l’air, même si l’air est supérieur à 0ºC. Plus l’air est chaud, plus cet échange de chaleur se produit rapidement et plus la neige fond rapidement.
Résumé de la section
- La plupart des substances peuvent exister sous forme solide, liquide et gazeuse, appelées » phases « . »
- Les changements de phase se produisent à des températures fixes pour une substance donnée à une pression donnée, et ces températures sont appelées points d’ébullition et de congélation (ou de fusion).
- Lors des changements de phase, la chaleur absorbée ou libérée est donnée par : Q = mL où L est le coefficient de chaleur latente.
Questions conceptuelles
- Le transfert de chaleur peut provoquer des changements de température et de phase. Quoi d’autre peut provoquer ces changements?
- Comment la chaleur latente de fusion de l’eau aide-t-elle à ralentir la baisse des températures de l’air, empêchant peut-être que les températures descendent nettement en dessous du ºC, à proximité de grandes étendues d’eau?
- Quelle est la température de la glace juste après sa formation par le gel de l’eau?
- Si vous placez de la glace ºC dans de l’eau ºC dans un récipient isotherme, que se passera-t-il? Une partie de la glace fondra-t-elle, plus d’eau gèlera-t-elle ou n’aura-t-elle pas lieu?
- Quel effet la condensation sur un verre d’eau glacée a-t-elle sur la vitesse à laquelle la glace fond? La condensation accélérera-t-elle le processus de fusion ou le ralentira-t-elle?
- Dans les climats très humides où il y a de nombreuses étendues d’eau, comme en Floride, il est inhabituel que les températures dépassent environ 35ºC (95ºF). Dans les déserts, cependant, les températures peuvent s’élever bien au-dessus de cela. Expliquez comment l’évaporation de l’eau aide à limiter les températures élevées dans les climats humides.
- En hiver, il fait souvent plus chaud à San Francisco que dans la ville voisine de Sacramento, à 150 km à l’intérieur des terres. En été, il fait presque toujours plus chaud à Sacramento. Expliquez comment les plans d’eau entourant San Francisco modèrent ses températures extrêmes.
- Mettre un couvercle sur une casserole en ébullition réduit considérablement le transfert de chaleur nécessaire pour la maintenir en ébullition. Expliquez pourquoi.
- Les aliments lyophilisés ont été déshydratés sous vide. Pendant le processus, les aliments gèlent et doivent être chauffés pour faciliter la déshydratation. Expliquez à la fois comment le vide accélère la déshydratation et pourquoi les aliments gèlent en conséquence.
- Lorsque l’air se refroidit encore en rayonnant la nuit, il est inhabituel que les températures descendent en dessous du point de rosée. Expliquez pourquoi.
- Dans une démonstration en classe de physique, un instructeur gonfle un ballon par la bouche puis le refroidit dans de l’azote liquide. Lorsqu’il fait froid, le ballon rétréci contient une petite quantité de liquide bleu clair, ainsi que des cristaux ressemblant à de la neige. Au fur et à mesure qu’il se réchauffe, le liquide bout et une partie des cristaux se sublime, certains cristaux s’attardant pendant un certain temps et produisant ensuite un liquide. Identifiez le liquide bleu et les deux solides dans le ballon froid. Justifiez vos identifications à l’aide des données du tableau 1.
Problèmes &Exercices
- Combien de transfert de chaleur (en kilocalories) est nécessaire pour décongeler un paquet de 0,450 kg de légumes surgelés à l’origine à 0ºC si leur chaleur de fusion est la même que celle de l’eau?
- Un sac contenant de la glace à 0ºC est beaucoup plus efficace pour absorber l’énergie qu’un sac contenant la même quantité d’eau à 0ºC. (a) Combien de transfert de chaleur est nécessaire pour élever la température de 0,800 kg d’eau de 0ºC à 30,0ºC? (b) Combien de transfert de chaleur est nécessaire pour la première fusion 0.800 kg de glace de 0ºC et ensuite augmenter sa température? (c) Expliquez en quoi votre réponse appuie l’affirmation selon laquelle la glace est plus efficace.
- (a) Combien de transfert de chaleur est nécessaire pour élever la température d’un pot en aluminium de 0,750 kg contenant 2,50 kg d’eau de 30,0 ºC au point d’ébullition, puis faire bouillir 0,750 kg d’eau? (b) Combien de temps cela prend-il si le taux de transfert de chaleur est de 500 W 1 watt = 1 joule / seconde (1 W = 1 J/ s)?
- La formation de condensation sur un verre d’eau glacée fait fondre la glace plus rapidement qu’elle ne le ferait autrement. Si 8.00 g de condensation se forme sur un verre contenant à la fois de l’eau et 200 g de glace, combien de grammes de glace fondront en conséquence? Supposons qu’aucun autre transfert de chaleur ne se produise.
- Lors d’un voyage, vous remarquez qu’un sac de glace de 3,50 kg dure en moyenne une journée dans votre glacière. Quelle est la puissance moyenne en watts entrant dans la glace si elle commence à 0ºC et fond complètement à 0ºC en exactement un jour 1 watt = 1 joule/ seconde (1 W = 1 J/s)?
- Par une certaine journée sèche et ensoleillée, la température d’une piscine augmenterait de 1,50 ºC sans évaporation. Quelle fraction de l’eau doit s’évaporer pour emporter précisément assez d’énergie pour maintenir la température constante?
- (a) Combien de transfert de chaleur est nécessaire pour élever la température d’un morceau de glace de 0,200 kg de -20,0 ºC à 130 ºC, y compris l’énergie nécessaire pour les changements de phase? b) Combien de temps est-il nécessaire pour chaque étape, en supposant une vitesse constante de transfert de chaleur de 20,0 kJ/s? (c) Faire un graphique de la température par rapport au temps pour ce processus.
- En 1986, un iceberg gargantuesque s’est détaché du plateau glaciaire de Ross en Antarctique. C’était environ un rectangle de 160 km de long, 40.0 km de large et 250 m d’épaisseur. a) Quelle est la masse de cet iceberg, étant donné que la densité de la glace est de 917 kg/m3? (b) Combien de transfert de chaleur (en joules) est nécessaire pour le faire fondre? c) Combien d’années faudrait-il à la lumière du soleil pour faire fondre de la glace aussi épaisse, si la glace absorbe en moyenne 100 W/m2, 12,00 h par jour?
- Combien de grammes de café doivent s’évaporer de 350 g de café dans une tasse en verre de 100 g pour refroidir le café de 95,0 ºC à 45,0ºC? Vous pouvez supposer que le café a les mêmes propriétés thermiques que l’eau et que la chaleur moyenne de vaporisation est de 2340 kJ / kg (560 cal / g). (Vous pouvez négliger le changement de masse du café au fur et à mesure qu’il refroidit, ce qui vous donnera une réponse légèrement plus grande que correcte.)
- (a) Il est difficile d’éteindre un incendie sur un pétrolier, car chaque litre de pétrole brut libère 2,80 × 107 J d’énergie lorsqu’il est brûlé. Pour illustrer cette difficulté, calculez le nombre de litres d’eau à dépenser pour absorber l’énergie libérée par la combustion de 1,00 L de pétrole brut, si la température de l’eau est élevée de 20,0 ºC à 100 ºC, elle bout et la vapeur résultante est élevée à 300 ºC. b) Discuter des complications supplémentaires causées par le fait que le pétrole brut a une densité plus faible que l’eau.
- L’énergie libérée par la condensation dans les orages peut être très importante. Calculez l’énergie libérée dans l’atmosphère pour une petite tempête de rayon 1 km, en supposant que 1,0 cm de pluie soit précipité uniformément sur cette zone.
- Pour prévenir les dommages causés par le gel, 4,00 kg d’eau à 0ºC sont pulvérisés sur un arbre fruitier. a) Combien de transfert de chaleur se produit lorsque l’eau gèle? b) Dans quelle mesure la température de l’arbre de 200 kg diminuerait-elle si cette quantité de chaleur était transférée de l’arbre? Prenez la chaleur spécifique à 3,35 kJ / kg · ºC et supposez qu’aucun changement de phase ne se produit.
- Un bol en aluminium de 0,250 kg contenant 0,800 kg de soupe à 25,0 ºC est placé dans un congélateur. Quelle est la température finale si 377 kJ d’énergie sont transférés du bol et de la soupe, en supposant que les propriétés thermiques de la soupe sont les mêmes que celles de l’eau?
- Un glaçon de 0,0500 kg à -30,0 ºC est placé dans 0,400 kg d’eau de 35,0 ºC dans un récipient très bien isolé. Quelle est la température finale ?
- Si vous versez 0,0100 kg d’eau de 20,0 ºC sur un bloc de glace de 1,20 kg (qui est initialement à -15,0 ºC), quelle est la température finale? Vous pouvez supposer que l’eau se refroidit si rapidement que les effets de l’environnement sont négligeables.
- Les Autochtones cuisinent parfois dans des paniers étanches en plaçant des roches chaudes dans l’eau pour la porter à ébullition. Quelle masse de roche de 500ºC doit être placée dans 4,00 kg d’eau de 15,0ºC pour porter sa température à 100ºC, si 0,0250 kg d’eau s’échappe sous forme de vapeur du grésillement initial? Vous pouvez négliger les effets de l’environnement et prendre la chaleur spécifique moyenne des roches pour être celle du granit.
- Quelle serait la température finale de la casserole et de l’eau dans le Calcul de la Température Finale Lorsque la Chaleur Est Transférée Entre Deux Corps: Verser de l’eau Froide dans une Casserole Chaude si 0,260 kg d’eau était placé dans la casserole et que 0,0100 kg d’eau s’évaporait immédiatement, laissant le reste à une température commune avec la casserole?
- Dans certains pays, l’azote liquide est utilisé sur les camions laitiers au lieu des réfrigérateurs mécaniques. A 3.le voyage de livraison de 00 heures nécessite 200 L d’azote liquide, d’une densité de 808 kg / m3. (a) Calculer le transfert de chaleur nécessaire pour évaporer cette quantité d’azote liquide et élever sa température à 3,00 ºC. (Utilisez cp et supposez qu’il est constant sur la plage de température.) Cette valeur est la quantité de refroidissement des réserves d’azote liquide. b) Quel est ce taux de transfert de chaleur en kilowattheures? c) Comparer la quantité de refroidissement obtenue par la fusion d’une masse identique de glace de 0ºC avec celle obtenue par l’évaporation de l’azote liquide.
- Certains amateurs d’armes à feu fabriquent leurs propres balles, ce qui implique de faire fondre et de lancer les limaces de plomb. Combien de transfert de chaleur est nécessaire pour augmenter la température et faire fondre 0,500 kg de plomb, à partir de 25,0 ºC?
Glossaire
chaleur de sublimation : énergie nécessaire pour faire passer une substance de la phase solide à la phase vapeur
coefficient de chaleur latente : constante physique égale à la quantité de chaleur transférée pour chaque 1 kg d’une substance lors du changement de phase de la substance
sublimation: la transition de la phase solide à la phase vapeur
Solutions sélectionnées aux problèmes &Exercices
1. 35,9 kcal
3. (a) 591 kcal; (b) 4,94 × 103 s
5. 13,5 W
7. (a) 148 kcal; (b) 0,418 s, 3,34 s, 4,19 s, 22,6 s, 0,456 s
9. 33,0 g
10. (a) 9,67 L; (b) Le pétrole brut est moins dense que l’eau, de sorte qu’il flotte au-dessus de l’eau, l’exposant ainsi à l’oxygène de l’air qu’il utilise pour brûler. De plus, si l’eau est sous l’huile, elle absorbe moins efficacement la chaleur générée par l’huile.
12. (d) 319 kcal; b) 2,00 ºC
14. 20,6 ºC
16. 4,38 kg
18. (a) 1,57 × 104 kcal; (b) 18,3 kW ⋅ h; (c) 1,29 × 104 kcal
- Valeurs indiquées aux températures normales de fusion et d’ébullition à la pression atmosphérique standard (1 atm). ↵
- À 37,0 ºC (température corporelle), la chaleur de vaporisation Lv pour l’eau est de 2430 kJ/kg ou 580 kcal/kg
- À 37,0ºC (température corporelle), la chaleur de vaporisation Lv pour l’eau est de 2430 kJ/kg ou 580 kcal/kg ↵