Modifications Dégénératives Maculaires Humides versus Sèches
Accueil/ Revue de base en Ophtalmologie / Rétine
Titre: Modifications Dégénératives Maculaires Humides versus Sèches
Auteur: Nina Boal, MSIV, Université Thomas Jefferson
Photographe: James Gilman, CRA, FOPS
Emplacement: Aperçu de l’éducation des étudiants en médecine >II. Approche anatomique de la maladie oculaire >RÉTINE >2. Modifications dégénératives maculaires sèches ouhumides
Aperçu
La dégénérescence maculaire liée à l’âge (DMLA) est la principale cause de cécité irréversible dans les pays industrialisés chez les personnes de 50 ans et plus. Il s’agit d’une maladie dégénérative de la macula (partie centrale de la rétine), qui entraîne une perte de vision centrale. Cliniquement, il est divisé en sec (atrophique) ou humide (exsudatif ou néovasculaire). Le risque de passer de la DMLA sèche à la DMLA humide est estimé à 1 à 4,7% en un an et à 13 à 18% en trois ans.
Dégénérescence maculaire liée à l’âge sec
Les modifications maculaires de la DMLA sèche sont caractérisées par des dépôts de drusen sous-rétiniens, une atrophie de l’épithélium pigmentaire rétinien (EPR), des détachements épithéliaux pigmentaires et une agglutination épithéliale pigmentaire sous-rétinienne. Il y a une absence de néovascularisation. La DMLA sèche affecte 85 à 90% des personnes atteintes de DMLA.
- Les Drusen sont des dépôts de matériel extracellulaire qui apparaissent sous forme de taches jaune vif en ophtalmoscopie, visibles sur la figure 1. Le risque de progression vers la DMLA humide augmente avec le nombre et la taille croissants de drusen et la présence d’anomalies pigmentaires de l’EPR. Quelques petits drusen sont typiques chez les personnes de plus de 50 ans et sont considérés comme une partie normale du vieillissement.
- L’atrophie de l’épithélium pigmentaire rétinien (EPR) apparaît sous forme d’amas d’hyperpigmentation ou de zones atrophiques dépigmentées lors de l’ophtalmoscopie. Les zones de perte de tissu et d’amincissement peuvent être focales ou plus largement dispersées sur la macula, appelées atrophie géographique visible à la figure 2.

Figure 1. Drusen dans la DMLA sèche
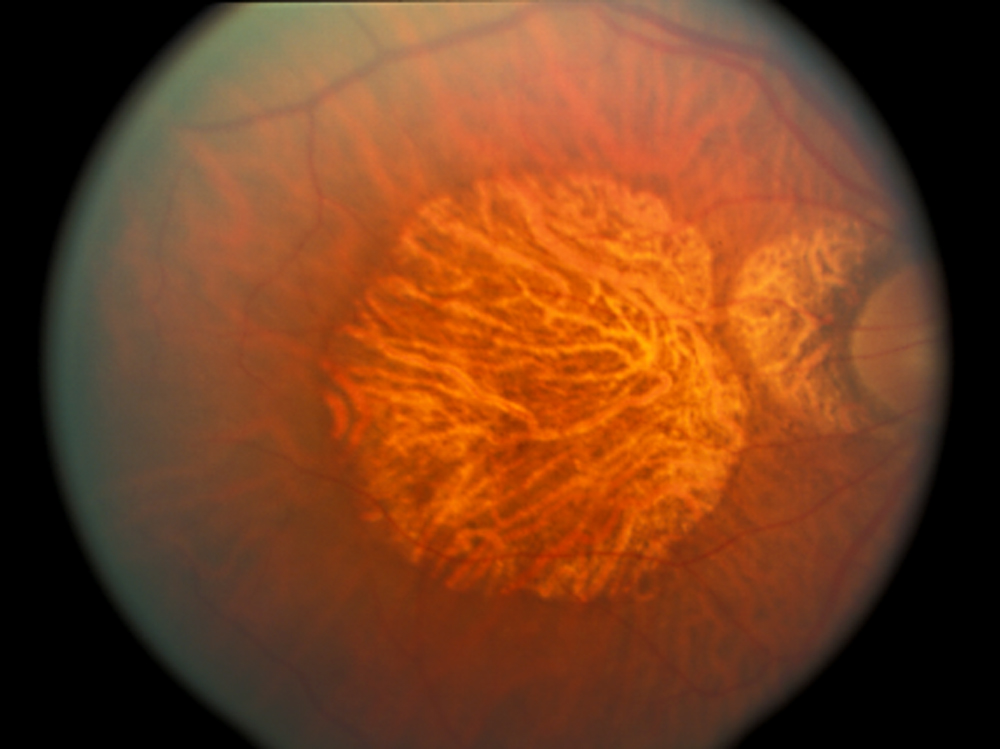
Figure 2. Atrophie géographique dans la DMLA sèche
Dégénérescence maculaire liée à l’âge humide
Dans la DMLA humide (ou néovasculaire), des vaisseaux anormaux se développent dans l’espace sous-rétinien à partir de la circulation choroïdienne. Ces vaisseaux peuvent fuir et entraîner une hémorragie sous-rétinienne, visible à la figure 3, et des collectes de liquide sous-rétinien, indiquant une néovascularisation choroïdienne. L’objectif est de reconnaître ces nouveaux vaisseaux avant qu’ils ne saignent et provoquent un décollement hémorragique de l’épithélium pigmentaire rétinien. La DMLA humide est moins fréquente que la DMLA sèche, affectant seulement 10 à 15% des personnes atteintes de DMLA. Cependant, il représente plus de 80% des patients présentant une perte visuelle sévère ou une cécité légale.

Figure 3A. Hémorragie sous-rétinienne dans la DMLA humide

Figure 3B. Angiographie rétinienne à colorant à la fluorescéine chez un patient atteint de DMLA humide, la zone de fuite correspond à une hémorragie dans la figure 3A
Présentation
Le principal symptôme de la DMLA est la perte de la vision centrale, mais initialement la DMLA peut être asymptomatique. Les patients atteints de DMLA sèche décrivent une perte progressive de la vision au centre de leur champ visuel. Les patients atteints de DMLA humide peuvent décrire une distorsion visuelle plus aiguë ou une perte de vision centrale lorsque du liquide ou du sang s’accumule sous la rétine.
Bilan
- Acuité visuelle
- Examen de la vue dilatée
- Grille d’Amsler
- Un outil utile, vu sur la figure 4, pour évaluer le fonctionnement de la macula.
- Le patient se concentre un œil à la fois sur le point central de la grille à 1 pied de distance, puis note des irrégularités dans les lignes.
- Ce test teste spécifiquement la métamophopsie (distorsion des lignes droites), un changement précoce de la DMLA humide.
- L’angiographie rétinienne à colorant à la fluorescéine
- Peut être utile pour identifier la néovascularisation dans la DMLA humide
- Le colorant à la fluorescéine est injecté par voie intraveineuse et une séquence de photographies est prise. Les vaisseaux néovasculaires choroïdiens nouvellement formés fuient la fluorescéine comme le montre la figure 3B.
- La tomographie par cohérence optique (OCT)
- Produit des images en coupe transversale de la rétine et peut être utilisée pour identifier le drusen, l’œdème rétinien et le liquide sous-rétinien.

Figure 4 Grille Amsler
Traitement de la DMLA sèche
Il n’existe aucun traitement efficace prouvé pour la DMLA sèche, cependant ces patients peuvent éventuellement développer une DMLA humide. Pour prévenir cette progression, il peut être conseillé aux patients d’arrêter de fumer et de prendre une combinaison de vitamines et de minéraux qui composent la formule AREDS (Age-Related Eye Disease Study). Il a été démontré qu’une combinaison de vitamines antioxydantes et de zinc protégeait l’œil contre d’autres dommages causés par la DMLA chez les patients présentant une DMLA sèche et humide plus étendue.
Traitement de la DMLA humide
En plus de l’utilisation d’antioxydants et de zinc, le traitement de la DMLA humide tente d’arrêter et de prévenir la néovascularisation par:
- Inhibiteurs du VEGF
- Au cœur du traitement de la DMLA humide, des thérapies anti-VEGF telles que le bevacizumab, le ranibizumab et l’aflibercept sont injectées dans le vitré mensuellement ou bimensuellement
- Le VEGF joue un rôle important dans le traitement de la DMLA humide néovascularisation. En inhibant le VEGF, la progression de la DMLA humide est arrêtée et la perte de vision peut être stabilisée ou améliorée.
- La thérapie photodynamique (PDT)
- Généralement utilisée si le traitement anti-VEGF n’est pas efficace
- Implique l’injection intraveineuse du colorant de photosensibilisation verteporfine avant de traiter l’œil avec un laser photo-activant. Le rôle de cette thérapie a diminué avec l’utilisation croissante de la thérapie anti-VEGF.
- Photocoagulation au laser thermique
- L’utilisation est limitée aux lésions plus petites en dehors de la macula centrale en raison du risque de scotome et de perte de vision.
Summary Table
| Dry AMD | Wet AMD | |
| 85 to 90% of patients with AMD | 10 to 15% of patients with AMD | |
| Absence of neovascularization | Choroidal neovascularization– subretinal hemorrhage and subretinal fluid collections | |
| Drusen, RPE atrophy, pigment epithelial | Drusen, atrophie de l’EPR, détachements épithéliaux pigmentaires, agglutination épithéliale pigmentaire sous-rétinienne | |
| Progression lente | Perte rapide de l’épithélium pigmentaire sous-rétinien | vision centrale sur des semaines à des mois |
| Perte de vision centrale légère à sévère | Perte de vision plus grave ou cécité légale | |
| Traitement:
– Surveillez la progression vers la DMLA humide avec la grille Amsler – Arrêt du tabac – Antioxydants AREDS et suppléments de zinc (plus efficaces pour la DMLA sèche étendue) |
Traitement:
– Arrêt du tabac – antioxydants AREDS et suppléments de zinc – Thérapie anti-VEGF – Si la thérapie anti-VEGF le fait ne fonctionne pas envisager la photocoagulation par PDT ou par laser thermique |
Examinateur de la faculté: Griffin Jardine, MD
- Hyman L. Épidémiologie des maladies oculaires chez les personnes âgées. Oeil (Lond) 1987; 1 (Pt 2): 330.
- Bressler NM. La dégénérescence maculaire liée à l’âge est la principale cause de cécité J JAMA 2004; 291:1900.
- Lietman MW. Manuel pour l’examen de la vue et le diagnostic. 9e Hoboken, New Jersey: John Wiley &Fils Inc.; 2017.
- Jager RD, Mieler WF, Miller JW. Dégénérescence maculaire liée à l’âge. En anglais J Med 2008; 358:2606.
- Groupe de recherche sur les maladies oculaires Liées à l’âge. Un essai clinique randomisé, contrôlé par placebo, de supplémentation à forte dose de vitamines C et E, de bêta-carotène et de zinc pour la dégénérescence maculaire liée à l’âge et la perte de vision: rapport AREDS no 8. Arch Ophthalmol 2001; 119:1417.
- Tan JS, Mitchell P, Kifley A, et al. Smoking and the long-term incidence of age-related macular degeneration: the Blue Mountains Eye Study. Arch Ophthalmol 2007; 125:1089.
- Solomon SD, Lindsley K, Vedula SS, et al. Facteur de croissance endothélial anti-vasculaire pour la dégénérescence maculaire liée à l’âge néovasculaire. Système de base de données Cochrane Rev 2014.
Identifiant : Moran_CORE_24645