Nom générique: fluocinonide
Forme posologique: Pommade
Revue médicale par Drugs.com . Dernière mise à jour le 22 déc. 2020.
- Aperçu
- Effets secondaires
- Posologie
- Professional
- Interactions
- Plus
Rx Only
Le nom de marque Lidex a été arrêté aux États-Unis. Si des versions génériques de ce produit ont été approuvées par la FDA, il peut y avoir des équivalents génériques disponibles.
Lidex Description
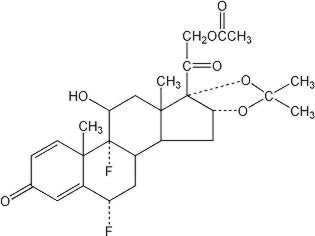
La pommade Lidex® (fluocinonide) 0,05% est destinée à une administration topique. Le composant actif est le corticostéroïde fluocinonide, qui est l’ester 21-acétate de l’acétonide de fluocinolone et porte le nom chimique pregna-1,4-diène-3,20-dione, 21- (acétyloxy) -6,9-difluoro-11-hydroxy-16,17–, (6α, 11β, 16α) -. Il a la structure chimique suivante:
La pommade Lidex contient du fluocinonide 0.5 mg / g dans une base de pommade spécialement formulée composée de monostéarate de glycéryle, de vaseline blanche, de carbonate de propylène, de propylène glycol et de cire blanche. Il fournit les effets occlusifs et émollients souhaitables dans une pommade.
Dans cette formulation, le principe actif est totalement en solution.
Lidex – Pharmacologie clinique
Les corticostéroïdes topiques ont des actions anti-inflammatoires, anti-prurigineuses et vasoconstrictrices.
Le mécanisme de l’activité anti-inflammatoire des corticostéroïdes topiques n’est pas clair. Diverses méthodes de laboratoire, y compris des dosages vasoconstricteurs, sont utilisées pour comparer et prédire les puissances et / ou l’efficacité clinique des corticostéroïdes topiques. Certaines preuves suggèrent qu’il existe une corrélation reconnaissable entre la puissance vasoconstrictrice et l’efficacité thérapeutique chez l’homme.
Pharmacocinétique
L’ampleur de l’absorption percutanée des corticostéroïdes topiques est déterminée par de nombreux facteurs, notamment le véhicule, l’intégrité de la barrière épidermique et l’utilisation de pansements occlusifs.
Les corticostéroïdes topiques peuvent être absorbés à partir d’une peau normale intacte. L’inflammation et / ou d’autres processus pathologiques de la peau augmentent l’absorption percutanée. Les pansements occlusifs augmentent considérablement l’absorption percutanée des corticostéroïdes topiques. Ainsi, les pansements occlusifs peuvent être un complément thérapeutique précieux pour le traitement des dermatoses résistantes (voir POSOLOGIE ET ADMINISTRATION).
Une fois absorbés par la peau, les corticostéroïdes topiques sont traités par des voies pharmacocinétiques similaires aux corticostéroïdes administrés par voie systémique. Les corticostéroïdes sont liés aux protéines plasmatiques à des degrés divers. Les corticostéroïdes sont métabolisés principalement dans le foie et sont ensuite excrétés par les reins. Certains des corticostéroïdes topiques et leurs métabolites sont également excrétés dans la bile.
Indications et utilisation de Lidex
La pommade Lidex est indiquée pour le soulagement des manifestations inflammatoires et prurigineuses des dermatoses sensibles aux corticostéroïdes.
Contre-indications
Les corticostéroïdes topiques sont contre-indiqués chez les patients ayant des antécédents d’hypersensibilité à l’un des composants de la préparation.
Précautions
Généralités
L’absorption systémique de corticostéroïdes topiques a entraîné une suppression réversible de l’axe hypothalamo-hypophyso-surrénalien (HPA), des manifestations du syndrome de Cushing, une hyperglycémie et une glucosurie chez certains patients.
Les conditions qui augmentent l’absorption systémique comprennent l’application des stéroïdes les plus puissants, l’utilisation sur de grandes surfaces, une utilisation prolongée et l’ajout de pansements occlusifs.
Par conséquent, les patients recevant une forte dose d’un stéroïde topique puissant appliqué sur une grande surface ou sous un pansement occlusif doivent être évalués périodiquement pour rechercher des signes de suppression de l’axe HPA en utilisant les tests de stimulation du cortisol libre urinaire et de l’ACTH. Si la suppression de l’axe HPA est notée, une tentative doit être faite pour retirer le médicament, pour réduire la fréquence d’application ou pour remplacer un stéroïde moins puissant.
La récupération de la fonction de l’axe HPA est généralement rapide et complète à l’arrêt du médicament. Rarement, des signes et des symptômes de sevrage des stéroïdes peuvent survenir, nécessitant des corticostéroïdes systémiques supplémentaires.
Les enfants peuvent absorber des quantités proportionnellement plus importantes de corticostéroïdes topiques et donc être plus sensibles à la toxicité systémique (voir PRÉCAUTIONS – Usage pédiatrique). En cas d’irritation, les corticostéroïdes topiques doivent être arrêtés et un traitement approprié doit être instauré.
Comme pour tout produit corticostéroïde topique, une utilisation prolongée peut entraîner une atrophie de la peau et des tissus sous-cutanés. Lorsqu’il est utilisé sur les zones intertrigineuses ou fléchissantes, ou sur le visage, cela peut se produire même avec une utilisation à court terme.
En présence d’infections dermatologiques, l’utilisation d’un agent antifongique ou antibactérien approprié doit être instituée. Si une réponse favorable ne se produit pas rapidement, le corticostéroïde doit être arrêté jusqu’à ce que l’infection ait été correctement contrôlée.
Information Pour le patient
Les patients utilisant des corticostéroïdes topiques doivent recevoir les informations et instructions suivantes:
- Ce médicament doit être utilisé selon les directives du médecin. Il est destiné à un usage externe uniquement. Évitez le contact avec les yeux.
- Il est conseillé aux patients de ne pas utiliser ce médicament pour tout trouble autre que celui pour lequel il a été prescrit.
- La zone cutanée traitée ne doit pas être bandée, ni autrement recouverte ou enveloppée de manière à être occlusive, sauf indication contraire du médecin.
- Les patients doivent signaler tout signe d’effets indésirables locaux, en particulier sous pansement occlusif.
- Il est conseillé aux parents de patients pédiatriques de ne pas utiliser de couches moulantes ou de pantalons en plastique sur un enfant traité dans la zone de la couche, car ces vêtements peuvent constituer des pansements occlusifs.
Tests de laboratoire
Les tests suivants peuvent être utiles pour évaluer la suppression de l’axe HPA:
Test de cortisol libre urinaire
Test de stimulation par l’ACTH
Carcinogenèse, Mutagenèse et Altération de la fertilité
Aucune étude à long terme sur l’animal n’a été réalisée pour évaluer le potentiel cancérogène ou l’effet sur la fertilité des corticostéroïdes topiques.
Des études visant à déterminer la mutagénicité avec la prednisolone et l’hydrocortisone ont révélé des résultats négatifs.
Grossesse Catégorie C
Les corticostéroïdes sont généralement tératogènes chez les animaux de laboratoire lorsqu’ils sont administrés par voie systémique à des doses relativement faibles. Les corticostéroïdes les plus puissants se sont révélés tératogènes après application cutanée chez des animaux de laboratoire. Il n’existe pas d’études adéquates et bien contrôlées chez la femme enceinte sur les effets tératogènes des corticostéroïdes appliqués par voie topique. Par conséquent, les corticostéroïdes topiques ne doivent être utilisés pendant la grossesse que si le bénéfice potentiel justifie le risque potentiel pour le fœtus. Les médicaments de cette classe ne doivent pas être largement utilisés sur les patientes enceintes, en grandes quantités ou pendant des périodes prolongées.
Mères allaitantes
On ne sait pas si l’administration topique de corticostéroïdes pourrait entraîner une absorption systémique suffisante pour produire des quantités détectables dans le lait maternel. Les corticostéroïdes administrés par voie systémique sont sécrétés dans le lait maternel en quantités peu susceptibles d’avoir un effet délétère sur le nourrisson. Néanmoins, des précautions doivent être prises lorsque des corticostéroïdes topiques sont administrés à une femme qui allaite.
Utilisation pédiatrique
Les patients pédiatriques peuvent présenter une plus grande sensibilité à la suppression de l’axe hypothalmique-hypophyso-surrénalien (HPA) induite par des corticostéroïdes topiques et au syndrome de Cushing que les patients matures en raison d’un rapport surface cutanée / poids corporel plus important.
Une suppression de l’axe HPA, un syndrome de Cushing et une hypertension intracrânienne ont été rapportés chez des enfants recevant des corticostéroïdes topiques. Les manifestations de la suppression surrénale chez les enfants comprennent un retard de croissance linéaire, un gain de poids retardé, de faibles niveaux de cortisol plasmatique et une absence de réponse à la stimulation par l’ACTH. Les manifestations de l’hypertension intracrânienne comprennent des fontanelles bombées, des maux de tête et un œdème papillaire bilatéral.
L’administration de corticostéroïdes topiques aux enfants doit être limitée à la quantité la moins compatible avec un régime thérapeutique efficace. La corticothérapie chronique peut interférer avec la croissance et le développement des enfants.
Effets indésirables
Les effets indésirables locaux suivants sont rarement rapportés avec des corticostéroïdes topiques, mais peuvent survenir plus fréquemment avec l’utilisation de pansements occlusifs. Ces réactions sont répertoriées dans un ordre décroissant approximatif d’occurrence:
| Burning | Perioral dermatitis |
| Itching | Allergic contact dermatitis |
| Irritation | Maceration of the skin |
| Dryness | Secondary infection |
| Folliculitis | Skin atrophy |
| Hypertrichosis | Striae |
| Acneiform eruptions | Miliaria |
| Hypopigmentation |
Overdosage
Topically applied corticosteroids can be absorbed in sufficient amounts to produce systemic effects (see PRECAUTIONS).
Posologie et administration de Lidex
La pommade Lidex est généralement appliquée sur la zone touchée sous forme de film mince de deux à quatre fois par jour en fonction de la gravité de la maladie.
Les pansements occlusifs peuvent être utilisés pour la prise en charge du psoriasis ou des affections récalcitrantes.
Si une infection se développe, l’utilisation des pansements occlusifs doit être interrompue et un traitement antimicrobien approprié doit être instauré.
Comment est fourni Lidex
Pommade Lidex® (fluocinonide) 0.05% est fourni dans
15 g Tube –NDC 99207-514-13
30 g Tube–NDC 99207-514-14
60 g Tube–NDC 99207-514-17
120 g Tube–NDC 99207-514-22
Conserver à température ambiante. Éviter une température supérieure à 30 °C (86 °F).
Brevet américain n ° 4 017 615
Fabriqué pour:
MEDICIS, The Dermatology Company®
Scottsdale, AZ 85258
par: Patheon, Inc.
Mississauga, Ontario
Canada L5N 7K9
IN-5070/S
| Lidex fluocinonide ointment |
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
Labeler – MEDICIS
Frequently asked questions
- Is it used for hair loss?
- What is a substitute for fluocinonide cream?
- Is fluocinonide an antifungal cream?
- How long should you use fluocinonide for?
- What is fluocinonide cream good for?
- Le fluocinonide peut-il être utilisé pour traiter une éruption cutanée?
- Est-ce un stéroïde?
- Est-ce un antibiotique?
En savoir plus sur Lidex (fluocinonide topique)
- Effets secondaires
- Pendant la grossesse ou l’allaitement
- Informations posologiques
- Interactions médicamenteuses
- 8 Avis
- Disponibilité générique
- Classe de médicaments: stéroïdes topiques
Ressources pour les consommateurs
- Lecture avancée
- Lidex Mild (Lecture Avancée)
- Lidex Regular (Lecture Avancée)
Ressources professionnelles
- Informations sur la prescription
- Solution Topique Lidex (FDA)
- Gel Lidex (FDA)
Autres marques Vanos, Lidex-E
Guides de traitement connexes
- Dermatite atopique
- Eczéma
- Dermatite
- Psoriasis
Avertissement médical