Chemguide: Chimie du noyau 14-16
Liaisons covalentes doubles et triples
Cette page présente la possibilité de liaisons covalentes multiples (doubles ou triples) entre des atomes utilisant l’oxygène, l’azote, le dioxyde de carbone et l’éthène comme exemples. Ceux-ci sont choisis parce qu’ils sont tous couramment spécifiés sur les programmes britanniques pour les 14-16 ans.
Je suppose que vous avez lu la page présentant la liaison covalente et que vous avez accès à un tableau périodique tel que celui que vous pouvez télécharger sur ce site.
Double liaison dans l’oxygène
Si vous recherchez de l’oxygène dans le Tableau périodique, vous constaterez qu’il a un numéro atomique de 8 – et que l’atome neutre a donc 8 protons et 8 électrons. Ceux-ci seront disposés 2,6.
Donc vous avez deux atomes comme ceci:
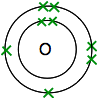
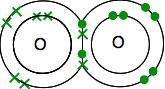
Chacun a deux électrons non appariés. Pour obtenir la stabilité énergétique maximale, tous ces éléments devront être jumelés.
Les oxygènes partagent donc deux paires d’électrons:
Ceci est beaucoup plus facile à voir en utilisant des lignes pour représenter des paires d’électrons partagés:
![]()
Triple liaison dans l’azote
Si vous trouvez azote dans le tableau périodique, vous pourrez déterminer que sa structure électronique est 2,5. En le comparant à l’oxygène, il a donc une paire d’électrons et trois électrons non appariés dans son niveau extérieur.
Pour le rendre aussi stable énergétiquement que possible, il faudra coupler tous ces éléments en liaisons covalentes. Deux atomes d’azote vont donc se combiner de cette manière :
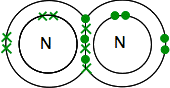
Encore une fois, c’est beaucoup plus facile à voir en utilisant des lignes pour représenter des paires d’électrons partagés:
![]()
Double liaison dans le dioxyde de carbone
La structure électronique du carbone est de 2,4 avec 4 électrons non appariés dans le niveau extérieur.
L’oxygène est de 2,6 avec 2 paires d’électrons et 2 électrons non appariés dans le niveau extérieur.
Vous devez vous retrouver avec tous les électrons appariés – et il n’y a qu’une seule façon de le faire.
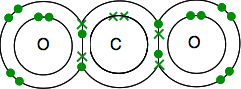
Comme précédemment, la liaison est plus facile à voir en utilisant des lignes pour lier des paires d’électrons.
![]()
S’il y a deux paires d’électrons de liaison entre deux atomes, on parle, sans surprise, de double liaison. Ainsi, chaque oxygène est relié à l’atome de carbone au milieu par une double liaison.
La double liaison dans l’éthène, le C2H4
L’éthène et d’autres composés similaires avec des doubles liaisons entre atomes de carbone sont des substances importantes en chimie. Vous les rencontrerez plus en détail plus tard dans le cours.
Regardez attentivement le diagramme en points et en croix et assurez-vous de comprendre comment tout cela s’intègre. Il doit en être ainsi pour que tous les électrons simples des carbones et des hydrogènes soient appariés en paires de liaison.
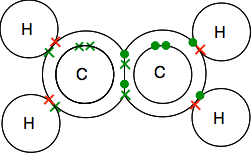
Si vous rencontrez des diagrammes montrant les paires de liaison sous forme de lignes, vous pouvez trouver l’une des deux versions.
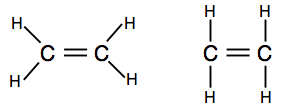
Le premier montre mieux la forme réelle de la molécule, mais le second est également parfaitement acceptable à ce niveau.
Où voulez-vous aller maintenant?
À la page suivante de cette section sur la liaison covalente. . .
Dans le menu Structure atomique et liaison. . .
Au menu Chimie 14-16. . .
Au Menu principal de Chemguide. . .