L’addition d’hydrogène à une double liaison carbone-carbone est appelée hydrogénation. L’effet global d’une telle addition est l’élimination réductrice du groupe fonctionnel à double liaison. La régiosélectivité n’est pas un problème, car le même groupe (un atome d’hydrogène) est lié à chacun des carbones à double liaison. La source la plus simple de deux atomes d’hydrogène est l’hydrogène moléculaire (H2), mais le mélange d’alcènes avec de l’hydrogène n’entraîne aucune réaction perceptible. Bien que la réaction d’hydrogénation globale soit exothermique, une énergie d’activation élevée l’empêche de se produire dans des conditions normales. Cette restriction peut être contournée par l’utilisation d’un catalyseur, comme le montre le schéma suivant.
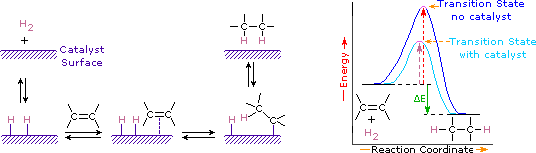
Les catalyseurs sont des substances qui modifient la vitesse (vitesse) d’une réaction chimique sans être consommées ni faire partie du produit. Les catalyseurs agissent en abaissant l’énergie d’activation des réactions, mais ils ne modifient pas l’énergie potentielle relative des réactifs et des produits. Les métaux finement divisés, tels que le platine, le palladium et le nickel, sont parmi les catalyseurs d’hydrogénation les plus utilisés. L’hydrogénation catalytique se déroule en au moins deux étapes, comme représenté sur le schéma. Tout d’abord, l’alcène doit être adsorbé à la surface du catalyseur avec une partie de l’hydrogène. Ensuite, deux hydrogènes se déplacent de la surface métallique vers les carbones de la double liaison, et l’hydrocarbure saturé résultant, qui est plus faiblement adsorbé, quitte la surface du catalyseur. La nature exacte et le calendrier des derniers événements ne sont pas bien compris.
Comme le montre le diagramme d’énergie, l’hydrogénation des alcènes est exothermique, et la chaleur est libérée correspondant au ΔE (de couleur verte) du diagramme. Cette chaleur de réaction peut être utilisée pour évaluer la stabilité thermodynamique d’alcènes ayant différents nombres de substituants alkyles sur la double liaison. Par example, le tableau suivant répertorie les chaleurs d’hydrogénation pour trois alcènes C5H10 qui donnent le même produit alcane (2-méthylbutane). Comme une chaleur de réaction importante indique un réactif à haute énergie, ces chaleurs sont inversement proportionnelles aux stabilités des isomères d’alcènes. En approximation approximative, nous voyons que chaque substituant alkyle sur une double liaison stabilise ce groupe fonctionnel d’un peu plus de 1 kcal/ mole.
| Isomère d’alcène | (CH3) 2CHCH=CH2 3-méthyl-1-butène |
CH2=C(CH3) CH2CH3 2-méthyl-1-butène |
(CH3) 2C = CHCH3 2-méthyl-2-butène |
|---|---|---|---|
| Chaleur de réaction (ΔHº) |
-30,3 kcal/mole | -28,5 kcal/mole | -26,9 kcal/mole |
D’après le mécanisme montré ici, nous nous attendons à ce que l’addition d’hydrogène se produise avec une syn-stéréosélectivité. C’est souvent vrai, mais les catalyseurs d’hydrogénation peuvent également provoquer une isomérisation de la double liaison avant l’addition d’hydrogène, auquel cas la stéréosélectivité peut être incertaine.
La formation de complexes de métaux de transition avec des alcènes a été démontrée de manière convaincante par l’isolement de complexes de platine stables tels que le sel de Zeise, K.H2O, et le platine éthylènebis (triphénylphosphine), 2Pt (H2C = CH2). Dans ce dernier cas, le platine est à trois coordonnées et à valence nulle, tandis que le sel de Zeise est un dérivé du platine (II). Un modèle du sel de Zeise et une discussion sur la liaison inhabituelle dans de tels complexes peuvent être consultés en cliquant ici. Des complexes similaires ont été rapportés pour le nickel et le palladium, des métaux qui fonctionnent également comme catalyseurs pour l’hydrogénation des alcènes.
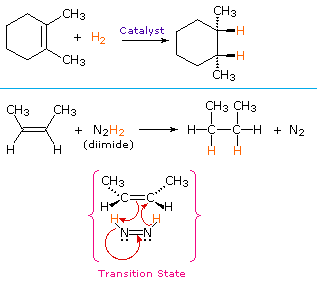
Une procédure non catalytique pour l’addition syn d’hydrogène utilise le composé instable diimide, N2H2. Ce réactif doit être fraîchement généré dans le système réactionnel, généralement par oxydation de l’hydrazine, et la réaction fortement exothermique est favorisée par l’élimination de l’azote gazeux (un composé très stable). Le diimide peut exister sous forme d’isomères cis-trans; seul l’isomère cis sert d’agent réducteur. Des exemples de réductions d’alcènes par les deux procédures sont présentés ci-dessous.
Contributeurs
- William Reusch, Professeur émérite (Michigan State U.), Manuel virtuel de Chimie organique