Les composés Antiaromatiques Sont Inhabituellement instables
Quels sont les facteurs clés qui déterminent si une molécule est antiaromatique?
Dans nos articles précédents de notre série sur l’aromaticité, nous avons vu que les molécules aromatiques sont inhabituellement stables. Ils ont des énergies de résonance particulièrement importantes, ont tendance à subir des réactions de substitution plutôt que d’addition et ont des électrons pi délocalisés (toutes les longueurs de liaison C-C dans le benzène sont égales, par exemple).
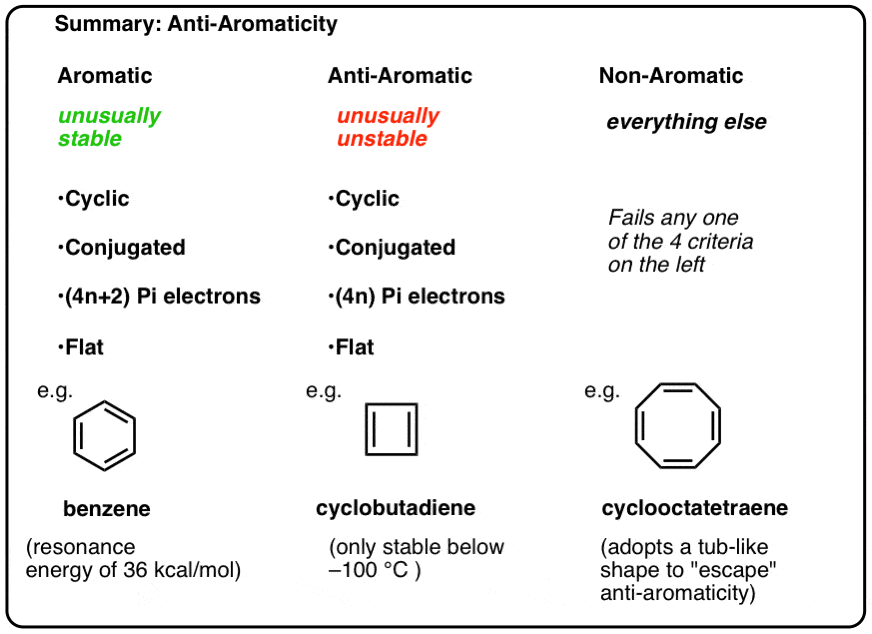
Pour être aromatique, une molécule doit posséder les quatre caractéristiques structurelles suivantes :
- cyclique
- conjuguée tout autour du cycle
- avoir des électrons pi
- plat (planaire)
Si ces quatre conditions sont remplies, la molécule est aromatique.
S’il échoue même une question sur le test, il est non aromatique.
Cela semble assez clair. Ou est-ce?
Vous pouvez deviner d’après la façon dont je pose cette question que la réponse n’est « pas tout à fait”. 🙂
Table Des Matières
- Certaines Molécules Sont Si Spectaculairement Et Inhabituellement Instables Et Difficiles À Isoler Qu’Elles Méritent Leur Propre Catégorie: Antiaromatique
- Cation Cyclopentadiényle: Le Carbocation « Stabilisé Par Résonance” Qui N’Est Pas Stable
- Cycles Antiaromatiques À Trois Chaînons: Oxirène, 1H–Azirène, Thiirène
- Le Cyclobutadiène Est Antiaromatique
- Un Exemple à 8 Électrons Pi d’un Composé Antiaromatique: Pentalène
- Qu’Est-Ce Qui Rend Une Molécule Anti-Aromatique?
- Le Cyclooctatétraène « Échappe » À l’Anti-Aromaticité Par Torsion Hors de La Planéité
- Conclusion: Composés Antiaromatiques
- Notes
- Avancé: Références et Lectures complémentaires
1. Des Molécules Spectaculairement Instables Qui Forment Une Catégorie À Elles Seules : ”Anti-Aromatiques »
Voici la chose. Il y a un petit nombre de molécules qui échouent au test d’aromaticité qui ne sont pas seulement non aromatiques: ils ont la propriété d’être si spectaculaires et inhabituellement instables et difficiles à isoler qu’ils méritent un autre nom.
On appelle ces molécules « anti-aromatiques ».
Ce qui est intéressant, c’est que dans de nombreux cas, les molécules elles-mêmes ne semblent pas particulièrement instables dès les premiers principes, contrairement à, disons, le cubane. Assez drôle, vous pouvez acheter du cubane (plus ou moins) chez Aldrich, mais la plupart des molécules anti-aromatiques dont nous parlerons ci–dessous ne sont stables qu’à des températures extrêmement basses – si elles peuvent être isolées du tout!
2. Cation Cyclopentadiényle: Le Carbocation « Stabilisé par Résonance » Qui n’est pas Stable
Commençons notre voyage dans le trou du lapin avec un exemple simple qui devrait sembler familier de la chimie organique du premier semestre.
Rappelez-vous la réaction SN1? Le chat qui quitte la chaise confortable en premier?
Revue rapide: Commencez par un halogénure d’alkyle. Laissant des feuilles de groupe, formant un carbocation. Attaques nucléophiles. On l’appelle SN1 car l’étape de détermination de la vitesse (formation de carbocation) est unimoléculaire. Bottom line: plus le carbocation est stable, plus la réaction se déroule rapidement. Par conséquent, la vitesse de réaction pour les halogénures d’alkyle est tertiaire >secondaire >primaire, et le carbocation obtient des points bonus spéciaux s’il est stabilisé par résonance.
Regardez ces deux réactions SN1. Selon vous, laquelle se produirait plus rapidement – la réaction SN1 qui passe par un carbocation secondaire (A), ou la réaction SN1 qui passe par un carbocation secondaire et peut former de multiples formes de résonance (B)?
D’après tout ce que vous avez appris jusqu’à présent, vous vous attendez à ce que la réponse soit B).
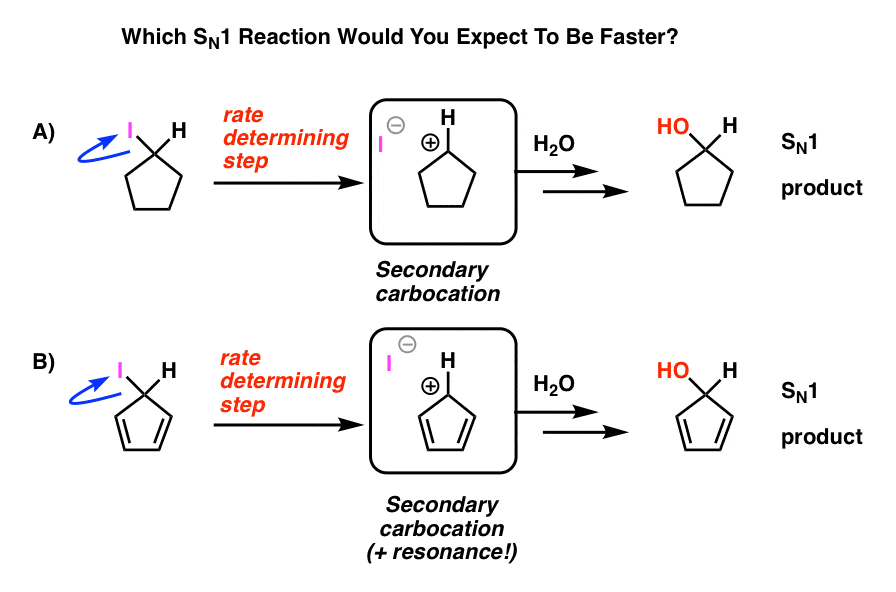
Ce n’est pas le cas.
La réponse est que la réaction A) se produit plus rapidement. La réaction B ne se produit pas du tout.
Cela devrait vous sembler profondément bizarre.
C’est!
Comment se fait-il que ce carbocation soi-disant stabilisé par résonance soit moins stable qu’un carbocation secondaire ?
Après tout, combien de fois est-il percé dans votre tête que la résonance stabilise les molécules, en particulier les carbocations?
Mais ici, cela semble déstabilisant. C’est… c’est

Mais instable il l’est! Le cation cyclopentadiényle est incroyablement instable et difficile à fabriquer – et ce n’est pas faute d’essayer. Il y a quelque chose de très étrange dans la structure du cation cyclopentadiényle qui lui confère une instabilité inhabituelle.

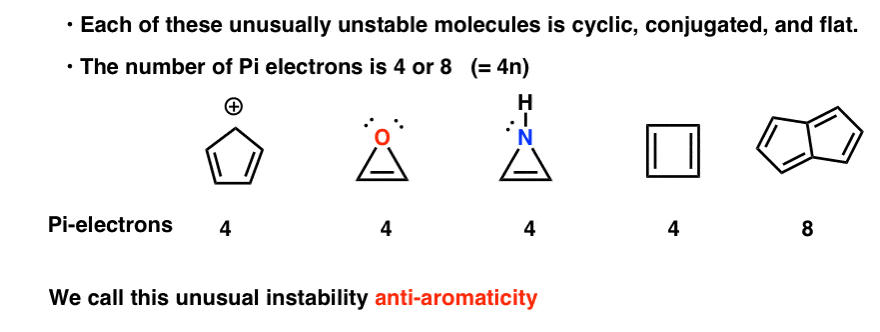
Cycliques, conjugués, plats…. et a 4 électrons pi. Intéressant!
3. Cycles antiaromatiques à trois chaînons: Oxirène, 1H-Azirène, Thiirène
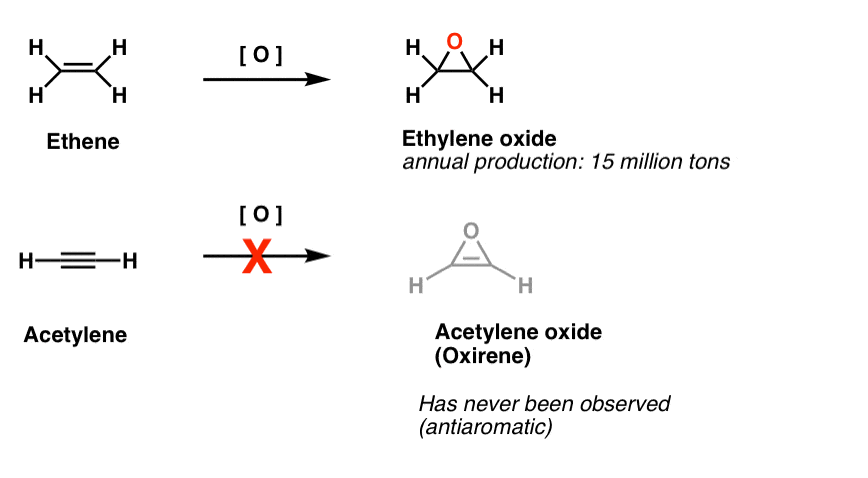
Une autre classe de molécules « insaisissables” est une famille de cycles à trois chaînons. Vous vous souvenez peut-être d’Org 1 qu’il est facile de fabriquer des époxydes à partir d’alcènes en utilisant un oxydant comme le m-CPBA.
Vous êtes-vous déjà demandé pourquoi nous n’avions jamais couvert la même réaction pour les alcynes?
Eh bien, ce n’est pas faute d’essayer. Les chimistes ont essayé toutes sortes de méthodes pour époxyder les alcynes, et vous savez quoi? La réaction ne fonctionne tout simplement pas.
Par exemple, l’époxydation de l’acétylène donnerait la molécule ci-dessous (oxirène).
L’oxirène lui-même n’a jamais été observé, bien qu’il existe des traces alléchantes de son existence éphémère. Et en passant, ni l’analogue azoté, le 1H-azirène, ni le thiirène.
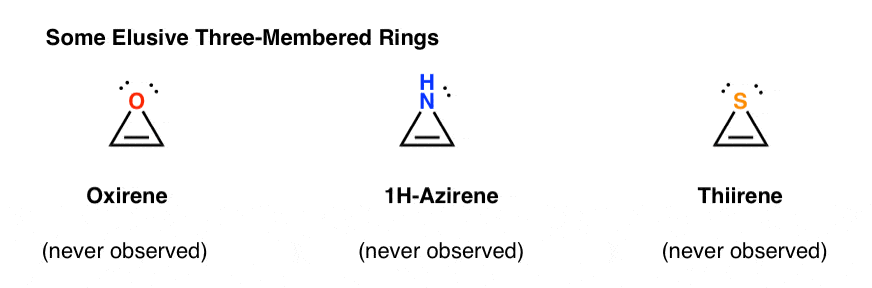
Pourquoi pas? Quelle est la particularité de chacun de ces cas?
Vous remarquerez peut-être que, comme le cation cyclopentadiényle, ces molécules sont cycliques, conjuguées, plates et possèdent 4 électrons pi (deux dans la liaison pi et deux dans une paire isolée).
OK. Quoi d’autre pourrait être cyclique, conjugué, plat et avoir 4 électrons pi?
4. Le cyclobutadiène est Antiaromatique
Le cyclobutadiène ressemble à une molécule assez simple, mais il n’a été réellement synthétisé qu’en 1965. Et même alors, il a été constaté qu’il n’est pas stable à des températures supérieures à 35 Kelvins.
La question est, pourquoi?

Bien sûr, c’est un cycle à quatre chaînons, et oui, il a beaucoup de contrainte de cycle, mais des molécules plus tendues ont été fabriquées qui sont en fait stables à température ambiante.
Vous pouvez également noter que, comme les exemples ci-dessus, le cyclobutadiène est un autre exemple de molécule cyclique, conjuguée, à 4 électrons pi et plate.
Ce qui est encore plus intéressant, c’est ce qu’on a appris sur la géométrie du cyclobutadiène. Plutôt que d’être une molécule avec des longueurs de liaison identiques (comme le benzène), le cyclobutadiène a une forme rectangulaire, indiquant que les électrons n’étaient pas délocalisés.
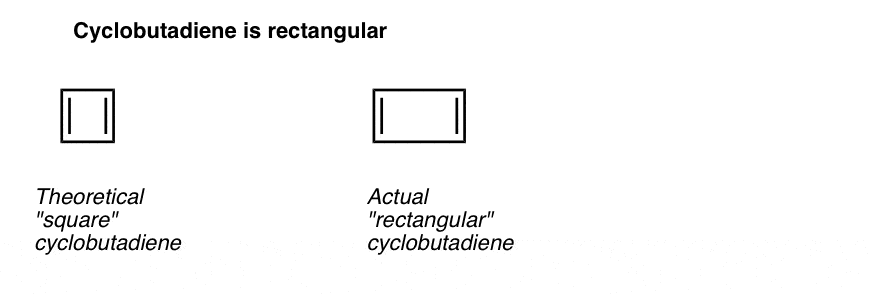
Ce que cela nous dit, c’est que même lorsqu’une molécule remplit toutes les conditions (électrons cycliques, conjugués, plats, 4 pi), la géométrie symétrique est particulièrement instable. . Très intéressant!
Un Exemple à 8 électrons Pi d’un composé Antiaromatique: le Pentalène
Jusqu’à présent, tous les exemples que nous avons vus jusqu’à présent avaient 4 électrons pi. Vous vous demandez peut-être: existe-t-il des exemples de molécules anti-aromatiques qui ont plus de 4 électrons pi? Pourquoi, oui.
La molécule ci-dessous est appelée « Pentalène”. Il a été synthétisé, mais n’est stable qu’en dessous de -100 °C. Au-dessus de cette température, il se combine avec une autre molécule d’elle-même (référence). Un autre exemple d’instabilité spectaculaire.

Le pentalène a 8 électrons pi. Cela pourrait déclencher des sonnettes d’alarme de reconnaissance. Rappelez-vous comment le nombre d’électrons pi dans les molécules aromatiques a suivi la séquence (2, 6, 10, 14….) ?
Cet exemple suggère que le nombre d’électrons pi dans les molécules anti-aromatiques suit la séquence (4, 8, 12…)
Qu’Est-Ce Qui Rend Une Molécule Anti-Aromatique ?
Qu’ont donc en commun toutes ces molécules de cette galerie de voleurs ?
Chacun d’eux est cyclique, conjugué et plat – et lorsque vous comptez le nombre d’électrons pi, ce sont des multiples de 4. Ainsi, alors que les molécules aromatiques ont (4n + 2) électrons pi, la « règle” pour les molécules anti-aromatiques est (4n). (une autre façon de le regarder: le nombre d’électrons pi sera deux fois pair).
Cette instabilité inhabituelle est appelée « anti-aromaticité”.
Cela signifie que nous pouvons maintenant établir trois catégories de molécules selon les critères suivants:
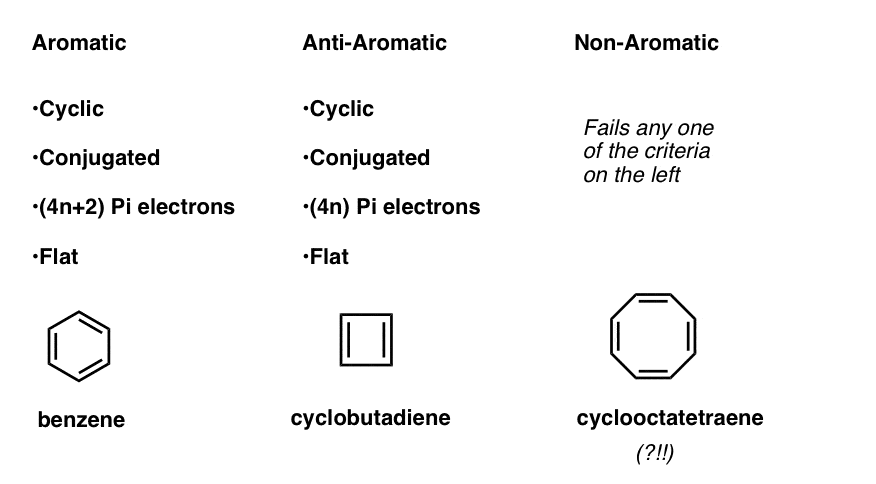
- Les molécules aromatiques sont cycliques, conjuguées, ont des électrons (4n + 2) pi et sont plates.
- Les molécules anti-aromatiques sont cycliques, conjuguées, ont des électrons (4n) pi et sont plates.
- Les molécules non aromatiques sont toutes les autres molécules qui échouent à l’une de ces conditions.
Attendez une seconde – vous vous demandez peut-être pourquoi le cyclooctatétraène est classé comme « non aromatique”. Avec 8 électrons pi (deux fois un nombre pair) ne devrait-il pas être « anti-aromatique”?
Le cyclooctatétraène « Échappe » à l’Anti-Aromaticité En Se Tordant De Planéité
Pensez à remplir les conditions d' »anti-aromaticité” comme un peu comme se qualifier pour un impôt sur le revenu extrêmement pénalisant. Étant donné la possibilité de trouver une échappatoire pour sortir de l’impôt, le feriez-vous? Sûrement.
Le cyclooctatétraène n’est anti-aromatique que s’il est plat. Cependant, la structure relativement « souple” du cyclooctatétraène permet une certaine flexibilité. Les liaisons peuvent s’éloigner de la planéité de telle sorte que la molécule adopte une forme « en forme de cuve”, évitant ainsi la « taxe antiaromaticité” de 18 12 kcal / mol qui serait payée si toutes les orbitales p de la molécule étaient conjuguées les unes aux autres.
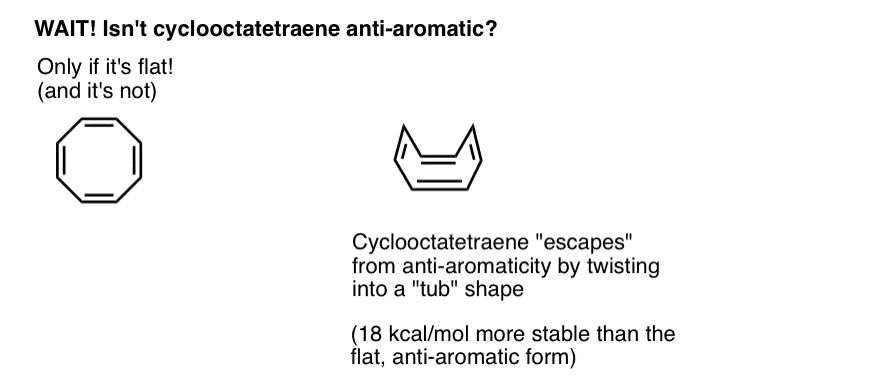
Il s’avère que le cyclooctatétraène a été synthétisé, est stable (vous pouvez l’acheter ici, par exemple) et se comporte comme un alcène ”normal », subissant des réactions d’addition, d’hydrogénation, etc.
Le pentalène (ci-dessus), qui a également 8 électrons pi, a une structure bicyclique très rigide qui empêche la rotation des liaisons loin de la planéité. Par conséquent, il est coincé dans sa conformation anti-aromatique.
L’anti-aromaticité pour les molécules ayant plus de 8 électrons pi est connue, mais très inhabituelle. (Voici un exemple amusant d’une autre « évasion » de l’aromaticité pour une molécule avec 18 électrons pi.)
Conclusion: Composés Antiaromatiques
Jusqu’à présent, notre traitement de l’aromaticité et de l’anti-aromaticité a été purement descriptif et empirique. Nous avons montré beaucoup d’exemples et donné beaucoup de règles, mais il manque dans la discussion une explication approfondie du « pourquoi ».
Quelle est la particularité du cycle benzénique qui le rend si stable ? Pourquoi est-il stable?
Quelle est la particularité du système cyclobutadiène qui le rend si instable. Pourquoi est-il instable?
Pour répondre à ces questions plus profondes, nous allons devoir prendre du recul et examiner les orbitales moléculaires de ces deux molécules, puis en venir à une compréhension plus profonde de l’aromaticité et de l’anti-aromaticité.
C’est ce que nous ferons dans notre prochain post.
Merci à Matthew Knowe pour son aide dans la préparation de ce post.
Notes
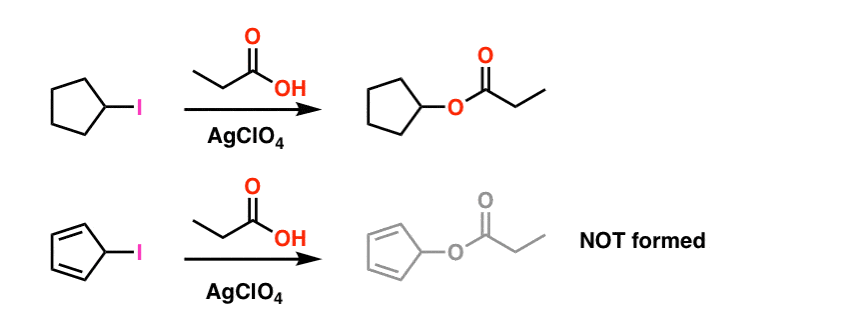
Note de bas de page 1. Pour plus de simplicité, l’image présentée dans l’article principal fude sur les conditions de réaction réelles. Les conditions expérimentales réelles sont présentées ci-dessous. Le solvant est l’acide propionique et le perchlorate d’argent de l’acide de Lewis est ajouté pour aider à retirer l’iode. .
Même dans ces conditions, le carbocation cyclopentadiényle ne se forme pas, ce qui témoigne de son extrême instabilité.
Note de bas de page 2. L’époxydation sur l’éthène (aka éthylène) se fait à hauteur de 15 millions de tonnes par an. L’époxydation de l’acétylène en oxirène est inconnue.
Des preuves éphémères de l’existence d’oxirènes ont été trouvées. Les études de marquage isotopique montrent bien que les oxirènes sont des intermédiaires éphémères dans certains réarrangements de Wolff. Il existe également deux exemples d’oxirènes piégés à une température extrêmement basse, mais décomposés au-dessus de 35 Kelvins.
L’existence éphémère d’une 1H-azirine a été postulée dans l’addition d’un nitrène à un acétylène, qui se réarrange rapidement en un 2H-azirène (stable) (ci-dessous).
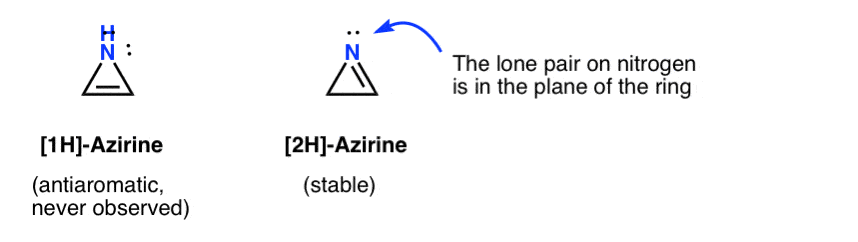
Notez que dans le 2H-azirène, la seule paire sur l’azote est perpendiculaire au système pi, ce système est donc non aromatique par opposition à anti-aromatique.
Pour plus de discussion, voir March’s Advanced Organic Chemistry. J’ai travaillé sur la 5ème édition, pages 62-63.
. Note de bas de page 3. Une expérience très intelligente a déterminé que le 1,2-dideutéro cyclobutadiène a deux isomères, pas un (voir ci-dessous). Cela indique que les doubles liaisons dans le cyclobutadiène ne sont pas délocalisées comme dans le benzène, mais ressemblent davantage à des doubles liaisons dans un diène conventionnel.
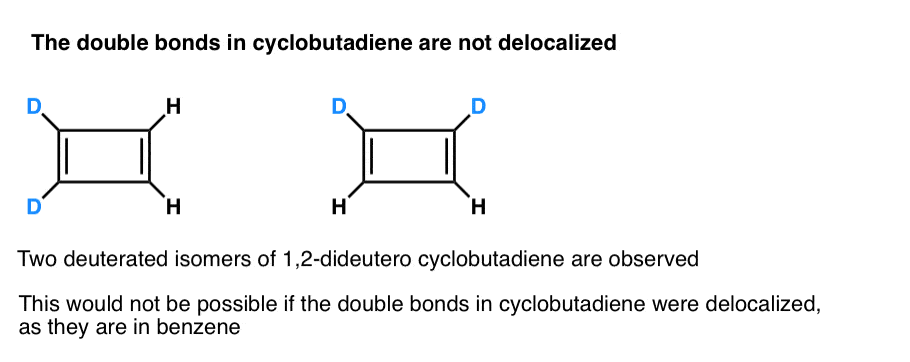
Le cyclobutadiène réagit avec lui-même à 35 K pour former un « dimère”, dans un exemple de réaction de Diels-Alder.
Note de bas de page 4. Oui, il est vrai que la seule paire d’azirène peut être placée dans une orbitale hybride sp3 (ci-dessous). Cela réduit probablement quelque peu la « pénalité » anti-aromatique, mais la molécule reste incroyablement instable. L’anti-aromaticité est le moyen le plus simple d’en rendre compte.

Note de bas de page 5. La géométrie rectangulaire est due à un effet connu sous le nom d’effet Jahn-Teller. Rappelez-vous le principe d’exclusion de Pauli, où les électrons ne peuvent pas avoir le même nombre quantique? Eh bien, comme nous le verrons en regardant le diagramme des orbitales moléculaires du cyclobutadiène, le cyclobutadiène « carré » a deux électrons ”dégénérés », c’est-à-dire qu’ils ont les mêmes énergies et les mêmes nombres quantiques. Cela conduit à un phénomène connu sous le nom de « répulsion de Pauli”, où l’allongement des liaisons se produit jusqu’à ce que les niveaux d’énergie des deux électrons soient différenciés. Certainement un sujet avancé.
(Avancé)Références et lectures complémentaires
- Spectroscopie d’état de transition du Cyclooctatétraène
Paul G. Wenthold, David A. Hrovat, Weston T. Borden, W. C. Lineberger.
Science, 1996, 272, 1456-1459.
DOI: 10.1126/ science.272.5267.1456
Cette étude est à la base de l’affirmation selon laquelle l’état fondamental non aromatique du cyclooctatétraène est de 12 kcal / mol en dessous de la conformation « antiaromatique”. - L’apprivoisement du Cyclobutadiène
Donald J. Cram, Martin E. Tanner, Robert Thomas
Chem. Int. Ed. 1991, 30(8), 1024-1027
DOI: 10.1002/anie.199110241
Cet article du Professeur Donald J. Cram (UCLA), lauréat du Prix Nobel, décrit la première caractérisation spectroscopique du cyclobutadiène. Ceci est accompli en enfermant le précurseur dans un hémicarcère (complexe de cage), puis en l’irradiant avec de la lumière UV, créant ainsi du cyclobutadiène, qui ne peut rien faire car il est piégé. - Cyclobutadiène
Thomas Bally, Satoru Masamune
Tetrahedron 1980, 36(3), 343-370
DOI: 1016/0040- 4020 (80) 87003-7
Cet article de 1980 passe en revue les travaux effectués sur le cyclobutadiène jusqu’à cette époque. Ceci est divisé en 2 parties – efforts synthétiques expérimentaux et calculs théoriques. - Tétraédrique et Cyclobutadiène
Günther Maier
Chem. Int. Ed. 1988, 27(3), 309-332
DOI: 10.1002/anie.198803093
Cet article passe en revue les efforts de synthèse vers le tétraédrique et le cyclobutadiène – les deux molécules ont une formule de C4H4. Seuls les tétraédranes substitués (tétra t-butyle et tétra triméthylsilyle) ont été synthétisés et isolés avec succès à ce jour. - Complexes Cyclobutadiène- et Benzocyclobutadiène-Tricarbonyle de Fer
F. Emerson, L. Watts et R. Pettit
Journal of the American Chemical Society 1965, 87 (1), 131-133
DOI: 10.1021/ja01079a032 - Cyclobutadièneiron Tricarbonyl. Un Nouveau Système Aromatique
D. Fitzpatrick, L. Watts, G. F. Emerson et R. Pettit
Journal of the American Chemical Society 1965, 87 (14), 3254-3255
DOI: 10.1021 / ja01092a050
Un sujet bonus: le cyclobutadiène peut être stabilisé avec des métaux – le complexe organométallique cyclobutadiène fer tricarbonyle est un solide cristallin stable. Comme le mentionnent les auteurs, il est peu probable que du cyclobutadiène libre soit généré dans la synthèse. - https://www.asu.edu/courses/chm233/notes/aromatic/aromaticRL1/antiaromatic.html
L’antipsychotique olanzapine adopte une forme ”papillon » pour éviter les effets antiaromatiques, similaires au cyclooctatétraène. Ceci est apparemment essentiel à sa fonction. - Antiaromaticité
Ronald Breslow
Accounts of Chemical Research 1973, 6 (12), 393-398
DOI:1021/ar50072a001
Il est intéressant de noter que le professeur Breslow (Columbia) déclare dans ce compte rendu qu’il a été le premier à suggérer le terme « antiaromatique” pour les composés cycliques particulièrement déstabilisés avec des électrons 4n p. Il cite également d’autres travaux du Prof. M. J. S. Dewar et d’autres où la déstabilisation antiaromatique du cyclobutadiène est calculée entre 18 et 33 kcal/mol par rapport au butadiène linéaire. - Détermination expérimentale de l’Antiaromaticité du Cyclobutadiène
Ashok A. Deniz, Kevin S. Peters, Gary J. Snyder
Science 1999, 286 (5442), 1119-1122
DOI: 1126/science.286.5442.1119
Il s’agit d’un article très rigoureux qui utilise de nouvelles techniques spectroscopiques pour déterminer la déstabilisation antiaromatique du cyclobutadiène. Par rapport à une référence hypothétique de diène conjugué sans souche, le cyclobutadiène est déstabilisé par un total de 87 kcal/mol, dont 32 kcal/mol peuvent être attribués à la souche du cycle et 55 kcal/mol à l’antiaromaticité (contre 21 kcal/mol pour la stabilisation aromatique du benzène). - Cation cyclopentadiényle non substitué, un triplet d’état fondamental
Saunders, R. Berger, A. Jaffe, J. M. McBride, J. O’Neill, R. Breslow, J. M. Hoffmann, C. Perchonock, E. Wasserman, R. S. Hutton, V. J. Kuck
Journal of the American Chemical Society 1973, 95 (9), 3017-3018
DOI: 10.1021/ja00790a049
Le cation cyclopentadiényle ne peut être préparé que difficilement, comme le décrit cet article. Une fois formé, il a un état fondamental électronique triplet (avec 2 électrons non appariés), et peut être caractérisé par spectroscopie EPR (résonance paramagnétique électronique). - Oxirènes
Errol G. Lewars
Chemical Reviews 1983, 83(5), 519-534
DOI: 10.1021/cr00057a002