A Microbial Biorealm page on the genus Enterococcus faecalis
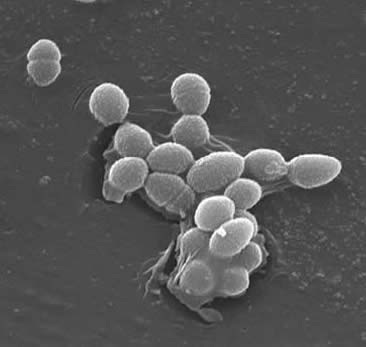
Classification
Higher order taxa
Bacteria; Firmicutes; Bacilli; Lactobacillales; Enterococcaceae; Enterococcus
Espèce
Enterococcus faecalis
Description et signification
Les entérocoques sont des cocci à Gram positif qui peuvent survivre à des conditions difficiles dans la nature. Ils peuvent être trouvés dans le sol, l’eau et les plantes. Certaines souches sont utilisées dans la fabrication d’aliments tandis que d’autres sont la cause d’infections humaines et animales graves (par exemple, elles sont connues pour coloniser les voies gastro-intestinales et génitales de l’homme). Ils sont associés à des infections acquises dans la communauté et à l’hôpital. Les entérocoques peuvent se développer à une température comprise entre 10 et 42 ° C et dans des environnements à pH large. Certains sont connus pour être mobiles. Bien qu’il existe plus de 15 espèces du genre Enterococcus, 80 à 90% des isolats cliniques sont E. faecalis (8). Les entérocoques forment généralement de courtes chaînes ou sont disposés par paires. Cependant, dans certaines conditions de croissance, ils s’allongent et apparaissent cocobacillaires. En général, les entérocoques sont alpha-hémolytiques. Certains possèdent l’antigène de Lancefield du groupe D et peuvent être détectés à l’aide de tests d’agglutination à base d’anticorps monoclonaux.Les entérocoques sont généralement des catalases négatives et sont anaérobies. Ils sont capables de croître dans 6,5% de NaCl, peuvent hydrolyser l’esculine en présence de 40% de sels biliaires et sont positifs à la pyrrolidonyl arylamidase et à la leucine arylamidase (8). Les entérocoques présentent un défi thérapeutique en raison de leur résistance à de nombreux médicaments antimicrobiens, « y compris les agents actifs de la paroi cellulaire; les aminoglycosides, la pénicilline et l’ampicilline et la vancomycine” (1). Les entérocoques ont la capacité d’acquérir une grande variété de facteurs de résistance aux antimicrobiens, qui posent de graves problèmes dans la prise en charge des patients atteints d’infections à entérocoques (8). En général, les isolats entérococciques présentant une sensibilité réduite à la vancomycine peuvent être classés comme vanA, vanB et vanC. vanA et vanB représentent la plus grande menace car ils sont les plus résistants et les gènes de résistance sont portés sur un plasmide. Les gènes de résistance étant portés sur un plasmide, ils sont facilement transférables, E. faecalis peut transférer ces plasmides par conjugaison (2). E. les fécales sont également résistantes à la teicoplanine. Des souches d’entérocoques dépendantes de la vancomycine ont été trouvées, mais elles sont rares et moins fréquentes que les souches résistantes à la vancomycine (appelées » entérocoques résistants à la vancomycine ” ou » ERV ”) (1).
Structure du génome

En raison de nombreux dangers pour la santé publique, les données de séquence du génome d’une souche d’entérocoque étaient nécessaires. La souche choisie pour le séquençage de l’ADN génomique était E. faecalis V583, le premier isolat résistant à la vancomycine aux États-Unis. Le génome de la souche V583 a été séquencé par l’Institute for Genome Research (TIGR). Le génome entérococcique montre qu’E. faecalis est métaboliquement diversifié et contient un large éventail de systèmes de régulation. La souche V583 contient quatre molécules d’ADN: le chromosome bactérien principal de la paire de 3 218 030 bases et trois plasmides circulaires. Le chromosome contient environ 3 500 cadres de lecture ouverts (ORF), environ 1/3 de ces ORF n’ont pas de fonction assignable (8). Les trois plasmides sont des molécules d’ADN circulaires identifiées comme Plasmide-1, Plasmide-2 et Plasmide-3. Le plasmide-1 contient 66 320 pb, le plasmide-2 contient 17 963 pb et le plasmide-3 contient 57 660 pb. Les plasmides codent pour un certain nombre de gènes, y compris des transposases, des protéines multirésistantes aux médicaments et un inhibiteur de croissance régulé par le ppGpp (8). La composition moyenne en G + C du chromosome E. faecalis est de 37,38%. Étant donné que la molécule d’ADN est si grande, des écarts régionaux par rapport à la moyenne se produisent. L’un de ces emplacements est le grand segment associé au « groupe de gènes de résistance à la vancomycine positionné près de 2,22 Mb”, montrant une forte augmentation du pourcentage de teneur en G + C (8). Ces différences associées à la résistance aux antibiotiques ou à la virulence suggèrent l’acquisition de matériel génétique d’une espèce étrangère par transfert horizontal. On ignore encore si les transferts sont responsables des variations de la composition de l’ADN. Les informations contenues dans le génome de E. faecalis V583 aidera grandement à comprendre comment l’organisme s’est adapté pour devenir un agent pathogène humain polyvalent. Grâce à la génomique comparative, le rôle des différents éléments régulateurs sera mieux compris dans la façon dont ils réagissent aux différents stress environnementaux et dans l’expression des facteurs de virulence potentiels (8). D’autres études comme celles-ci suggéreront de nouveaux médicaments contre les infections bactériennes causées par les entérocoques.Le génome contient également 3 opérons Ebp (codant pour les pili associés au biofilm de l’endocardite) qui sont importants pour la production de biofilm de la souche OG1RF d’E. faecalis. Cette souche utilise ces opérons pour produire des pili de surface. . Les pili de surface sont utilisés pour « la fixation aux surfaces hôtes et sont antigéniques chez l’homme pendant l’endocardite” (9).
Le TIGR contient une liste complète des gènes des chromosomes d’E. faecalis.
Structure cellulaire et métabolisme
Métabolisme cellulaire
Les entérocoques vivent dans des environnements difficiles, comme les voies intestinales des humains et des animaux. La croissance dans ces conditions hostiles nécessite que E. faecalis ait un métabolisme flexible. E. les faecalis sont capables non seulement de fermenter pour produire de l’acide lactique, mais aussi de « cataboliser un spectre de sources d’énergie à partir de glucides, de glycérol, de lactate, de malate, de citrate, d’acides diamino et d’acides manya-céto” (3). Il a été démontré que dans certaines conditions de croissance, E. faecalis peut améliorer la croissance par phosphorylation oxydative en utilisant une force motrice du proton établie par le transport d’électrons. Une conséquence de « la respiration naissante est la production d’oxydants puissants” (par exemple, le superoxyde et le peroxyde d’hydrogène), un stress oxydatif que l’E. faecalis peut tolérer (3). La tolérance de ce stress, combinée à d’autres conditions de croissance sévères, permet à E. faecalis de croître à 10 à 45 ° C, dans les sels biliaires, et à des pH extrêmement bas et élevés. De plus, E. faecalis peut résister à l’azoture, aux détergents, aux métaux lourds et à l’éthanol. Comme E. faecalis peut utiliser diverses sources de sucre, elle peut vivre dans divers environnements, en particulier dans l’intestin où les nutriments sont limités (2). Dans l’intestin, E. faecalis tire la majeure partie de son énergie de la fermentation des sucres non absorbés. E. faecalis peut également obtenir de l’énergie en dégradant les mucines, un glucide fortement glycosylé et produit par les cellules caliciformes intestinales (2).L’E. faecalis utilise un « système de phosphoénolypyruvate phosphotransférase (PTS) pour détecter les sucres en dehors de la cellule et coupler l’absorption des sucres avec la phosphorylation » (2). Ce faisant, moins d’énergie (ATP) est gaspillée par rapport à la façon dont le sucre est accumulé par les systèmes non PTS. Les sucres métabolisés par E. faecalis sont les suivants: D-glucose, D-fructose, lactose, maltose (tous substrats PTS). Chez les entérocoques, le PTS régule également le métabolisme du glycérol, l’expulsion de l’inducteur et la répression des catabolites (8). E. faecalis est l’une des rares bactéries à Gram positif à faible teneur en G + C qui expulsent le sucre pendant la croissance sur le glucose, un phénomène connu sous le nom d’expulsion d’inducteur (8). E. faecalis peut même fermenter le glycérol dans des conditions aérobies et microaérophiles. E. faecalis peut également se développer sur le glycérol dans des conditions anaérobies car il « exprime un gène de l’activité anaérobie de la glycérol déshydrogénase liée au NAD+ » (8). Le glycérol peut traverser la membrane cellulaire à l’aide d’une protéine appelée facilitateur de diffusion du glycérol (GlpF). Le GlpF rend la concentration de glycérol à l’intérieur et à l’extérieur de la cellule égale, la protéine est inhibée par la glycolyse. E. faecalis est capable de vivre dans un pH alcalin extrême et une concentration élevée en sel. Ces caractères nécessitent un transport de cations pour maintenir la composition d’ions cytosoliques constante essentielle à l’homéostasie. Toutes les cellules doivent expulser l’excès de sodium pour maintenir les concentrations cytosoliques dans la plage qui favorise l’homéostasie. E. faecalis exprime à la fois un antiporteur Na+/H+ et une ATPase de type vacuolaire (2). Le potassium est un cation intracellulaire majeur. La concentration de potassium dans E. faecalis de 0,4 à 0,6 M est essentielle au métabolisme cellulaire normal, elle « neutralise les anions intracellulaires, active diverses enzymes et régule le pH cytosolique” (8). E. faecalis exprime au moins deux transporteurs de potassium pour effectuer la régulation, KtrI et KtrII avec le système Kep pour l’extrusion K+ (8). Bien qu’il soit connu que KtrI et KtrII sont des systèmes d’absorption K+ (ce sont des symporteurs K + / H +), on en sait peu plus sur les protéines.
Structure cellulaire
Les entérocoques sont des cocci à Gram positif qui forment généralement de courtes chaînes ou sont disposés par paires (3). Dans certaines conditions de croissance, ils peuvent s’allonger et apparaître coccobacillaires. La paroi cellulaire d’E. faecalis représente 20 à 38% du poids des cellules sèches (dans les cellules en phase exponentielle et stationnaire). Étant donné que l’E. faecalis est une bactérie à Gram positif, sa paroi cellulaire est constituée de trois composants principaux: peptidoglycane, acide teichoïque et polysaccharide. 40% de la paroi cellulaire est constituée de peptidoglycane, tandis que le reste de la paroi cellulaire est constitué d’un « polysaccharide contenant du rhamnose et d’un acide teichoïque contenant du ribitol” (3). Le peptidioglycane fonctionne (comme dans la plupart des cellules à Gram positif) pour résister à l’éclatement induit par une pression osmotique cytoplasmique élevée. E. faecalis est généralement considéré comme un organisme non encapsulé, démontré par « l’absence de phénotype mucoïde détectable” (3). Cependant, des sous-ensembles d’isolats d’E. faecalis possèdent un polysaccharide capsulaire. E. les faecalis peuvent échanger du matériel génétique (plasmides) par des processus de conjugaison induits par de petites phéromones peptidiques (2). Protéines de surface » les substances d’agrégation qui reconnaissent un ligand spécifique sur les cellules réceptrices » assurent des connexions réussies pour la conjugaison (2).E. faecalis a également la capacité de fabriquer des pili de surface qui peuvent conduire à la formation d’un biofilm. Les souches d’E. faecalis qui causent l’endocardite contiennent de grandes quantités de ces pili. Les pili permettent la fixation aux surfaces hôtes (par exemple, le tissu cardiaque). Les souches de E. les matières fécales responsables de l’endocardite produisent le « biofilm beaucoup plus souvent et également dans une plus grande mesure que les isolats non endocardiques” (9).
Ecologie
E. faecalis est une espèce d’entérocoques très diversifiée. Il interagit avec de nombreux autres organismes et a des effets sur l’environnement. Les entérocoques sont des membres de la communauté bactérienne habitant le gros intestin chez l’homme. Ils sont également une partie naturelle de la flore intestinale chez la plupart des autres mammifères et oiseaux (8). Les entérocoques se trouvent également dans le sol, les plantes et l’eau. Lorsqu’ils sont trouvés dans l’eau, c’est généralement parce que l’eau avait été contaminée par des matières fécales. Bien que l’E. faecalis n’apparaisse pas trop souvent dans les plantes, d’autres souches d’entérocoques ont été trouvées parmi les plantes et sont très probablement présentes dans une source d’eau contaminée (8).L’écologie de la résistance aux antibiotiques et du transfert de gènes de virulence dans l’environnement n’est toujours pas bien comprise. Les insectes, comme les mouches domestiques (HF), qui se développent dans des matières organiques en décomposition peuvent transmettre des bactéries résistantes aux antibiotiques provenant du fumier d’animaux et d’autres substrats organiques en décomposition aux milieux résidentiels (7). Les HF sont des transmetteurs parfaits en raison des communautés microbiennes vivantes présentes dans les habitats où elles se développent (par exemple, les fèces). Aux bonnes qualités de transfert s’ajoutent la manière dont HF nourrit ses petits (régurgitation) et leur attirance pour la nourriture humaine. Comme HF peut voler sur de longues distances, cet insecte est très bon pour propager des bactéries fécales, y compris des agents pathogènes humains et animaux, et éventuellement des souches d’entérocoques résistantes aux antibiotiques (7). Une étude récente a examiné la résistance aux antibiotiques et les gènes de virulence des entérocoques provenant de HF dans les restaurants fast-food de Kanasas. Cette étude a montré que « les mouches domestiques dans les installations de manutention et de service des aliments peuvent être porteuses d’entérocoques résistants aux antibiotiques et potentiellement virulents qui ont la capacité de transférer horizontalement des gènes de résistance aux antibiotiques à d’autres bactéries” (7).Les effets que E. faecalis a sur l’environnement ont tendance à être plus négatifs. Ils contaminent généralement les réserves d’eau qui peuvent entraîner des plantes infectées ainsi que des infections chez l’homme (8). Les facteurs antibiotiques peuvent également être transportés par divers insectes (par exemple, les mouches domestiques) et les animaux, ce qui entraîne un nombre croissant d’E. faecalis virulents.
Pathologie
Les entérocoques sont apparus comme une cause majeure d’infections nosocomiales, et au sein de ce groupe, Enterococcus faecalis cause la majorité des infections à entérocoques humaines. Ces infections peuvent être locales ou systématiques et comprennent des infections des voies urinaires et abdominales, des infections des plaies, une bactériémie et une endocardite (2). Étant donné que les E. faecalis sont capables de survivre à de nombreux défis environnementaux (tels que des températures extrêmes et la présence de sels biliaires) et parce qu’elles peuvent acquérir une résistance à de multiples antibiotiques, ces bactéries sont devenues un problème de santé majeur. Le système national de surveillance des infections nosocomiales (SNSN) a signalé une augmentation de l’incidence des infections dues aux entérocoques résistants à la vancomycine (ERV) depuis 1989 (1). Cela peut entraîner de graves problèmes de santé, notamment le manque d’antibiothérapie disponible pour les infections à ERV, car la plupart des souches d’ERV présentent une résistance à plusieurs antibiotiques en plus de la vancomycine (par exemple, les aminoglyscoides et l’ampicilline). Le transfert de gènes résistants à la vanocmycine d’ERV à d’autres pathogènes à Gram positif est un grave problème de santé publique. La façon la plus courante d’infecter E. faecalis dans un hôpital ou un établissement de soins de longue durée est la transmission d’E. faecalis entre patients (8). Les entérocoques peuvent être portés sur les mains des agents de santé et être transportés (transférés) d’un patient à un autre. Il a été démontré que l’ERV sur les mains peut persister jusqu’à 60 minutes (8). La transmission des mains d’un travailleur de la santé au patient pourrait avoir lieu au contact des cathéters intraveineux ou urinaires du patient. Les thermomètres rectaux, mal nettoyés après utilisation, peuvent également transmettre l’ERV d’un patient à l’autre. Parfois, la transmission peut entraîner une colonisation du tractus gastro-intestinal du patient par la souche acquise. La nouvelle souche fait alors partie de la flore endogène du patient (8). La souche acquise, porteuse de gènes de résistance aux antibiotiques, est capable de vivre dans le tractus gastro-intestinal. Les infections proviennent alors de ces souches nouvellement acquises d’E. faecalis.E. faecalis peut causer de nombreuses infections dans le corps humain. L’infection la plus fréquente causée par les entérocoques est l’infection des voies urinaires. E. faecalis peut provoquer des infections des voies urinaires inférieures (IVU), telles que la cystite, la prostatite et l’épididymite (8). E. faecalis se trouve également dans les infections intra-abdominales, pelviennes et des tissus mous. Le E. faecalis peut provoquer une bactériémie nosocomiale. La source de bactériémie est le plus souvent les voies urinaires, provenant d’un cathéter intraveineux infecté. L’endocardite est l’infection entérococcique la plus grave, car elle provoque une inflammation des valves cardiaques. Dans de nombreux cas d’endocardite, le traitement antibiotique échoue et une intervention chirurgicale pour retirer la valve infectée est nécessaire (8). Les infections moins courantes causées par E. faecalis comprennent la méningite, l’hématogène, l’ostéomyélite, l’arthrite septique et (très rarement) la pneumonie. En raison de la résistance des entérocoques à de nombreux antibiotiques, le traitement de ces infections est difficile.
Application à la biotechnologie
Les entérocoques ont été étudiés pour une utilisation possible en tant que probiotique (un complément alimentaire contenant des cellules microbiennes vivantes non virulentes qui, lorsqu’elles sont ingérées, auraient un effet bénéfique sur la composition de la microflore intestinale). Il a été démontré que l’administration de la souche E. faecalis réduit la diarrhée. Les probiotiques E. faecalis sont utilisés dans l’alimentation des poulets/porcs/bovins pour réduire la diarrhée chez les animaux (8).
En raison des propriétés pathogènes élevées d’E. faecalis, beaucoup plus de recherches ont été menées sur la façon d’arrêter la virulence d’E. faecalis que sur l’utilisation bénéfique d’E. faecalis.
Recherche actuelle
1.) Espoir pour les infections causées par Enterococcus faecalis (4)
On sait que les bactéries résistantes à la vancomycine (par exemple E. faecalis) posent de nombreux problèmes à la société, provoquant des infections bactériennes chez l’homme difficiles à traiter. Les infections à entérocoques sont difficiles car les organismes ont la capacité d’acquérir et de diffuser rapidement des gènes de résistance. Le ceftobiprole (BPR) a été utilisé comme céphalosporine expérimentale contre les cocci à Gram positif. BPR est une céphalosporine parentérale à large spectre avec des affinités élevées avec des protéines de liaison à la pénicilline Gram-positives et Gram-négatives. Il montre également une stabilité contre l’hydrolyse par les β-lactamases.Cette étude a examiné l’activité de BRP contre une grande collection d’E. faecalis, en examinant l’activité bactéricide de BPR contre les isolats résistants à la vancomycine. L’étude a révélé que la sensibilité à la BPR chez E. faecalis n’est pas affectée par la présence de résistance à la vancomycine ou par la production de β-lactamase. Chez les souches d’E. faecalis présentant soit une résistance à la vancomycine (phénotypes VanA et VanB), soit une résistance à l’ampiciliine, le BPR était bactéricide. Les chercheurs ont montré que BPR présentait une activité bactéricide contre E. faecalis à une dose de 750 mg, inhibant 100% de l’activité d’E. faecalis. Bien que la présence de l’enzyme β-lactamase soit rare chez E. faecalis, sa présence compromet l’utilisation des β-lactames anti-entérococciques les plus efficaces (par exemple l’ampicilline). La BPR est un substrat pauvre pour l’enzyme β-lactamase, ce qui explique son excellente activité contre la β-lactamase produisant E. faecalis.Cette recherche a démontré que BPR a une activité puissante contre une très grande collection d’E. faecalis. L’activité du BPR n’a pas été affectée par la résistance à la vancomycine ou la production de β-lactamase. Par conséquent, BPR est un agent prometteur pour le traitement des infections à E. faecalis productrices de β-lactamase et résistantes à la vancomycine chez l’homme.
2.) Examinant comment Enterococcus faecalis devient résistant au linézolide médicamenteux (5)
Lorsque des antibiotiques sont utilisés dans le traitement d’une infection bactérienne, ils peuvent avoir un impact sur la flore intestinale. Des bactéries résistantes peuvent être sélectionnées pendant le traitement, comme les entérocoques, et sont potentiellement pathogènes. L’émergence d’une résistance est un problème pour les nouveaux antibiotiques car elle pourrait compromettre l’utilité des antibiotiques.Cette étude a examiné l’émergence d’une résistance aux antibiotiques par E. faecalis. Plus précisément, les chercheurs se sont penchés sur la résistance au linézolide (le premier d’une nouvelle classe d’antibiotiques connus sous le nom d' »oxazolidinones”). Le linézolide peut être utilisé contre les cocci Gram positifs multirésistants, y compris les ERV. Il inhibe la synthèse des protéines bactériennes en se liant spécifiquement à un domaine de la sous-unité ribosomique des années 50 et n’est pas affecté par les mécanismes de résistance qui affectent d’autres antibiotiques. Cette étude a examiné le taux d’émergence de mutants E. faecalis résistants aux linézolides dans le tube digestif de souris gnotobiotiques. Le do de linézolide a été introduit dans de l’eau avec des doses variant de 0,5, 0,005 à 0,005 g/L. Les mutants étaient tous dépendants du linézolide donné, les niveaux de résistance augmentant avec la durée d’exposition. Aucun mutant n’a été isolé en l’absence de linézolide, ce qui suggère que la résistance de novo au linézolide était rare chez les entérocoques.La recherche a révélé qu’une mutation dans un seul gène de l’ARNr 23S était l’étape critique dans l’émergence de la résistance aux linézolides. Une colonisation primaire par des mutants à mutation unique a été observée dès 5 jours après l’initiation du traitement chez la souris.Ces expériences sur des souris aident à expliquer le schéma d’émergence de la résistance au linézolide observé dans les isolats cliniques. L’équipe de recherche a montré que la dose est essentielle à la dynamique de la résistance. Ces résultats devraient aider à définir les meilleures stratégies thérapeutiques pour minimiser l’émergence de la résistance en milieu clinique, ce qui pourrait sauver de nombreuses vies.
3.(6)
Enterococcus faecalis est à l’origine de nombreuses infections résistantes aux antibiotiques dans les hôpitaux, conséquence de sa résistance inhérente à certains antibiotiques et de sa capacité à survivre et à proliférer dans le tractus intestinal.La base génétique de la résistance observée chez E. faecalis n’est pas bien connu, cette recherche tente d’identifier une cause de la résistance. Les chercheurs ont montré que la PrkC, une protéine de signalisation à un composant contenant un domaine kinase Ser/ Thr de type eucaryote, permettait une résistance antimicrobienne inhérente et une persistance intestinale d’E. faecalis. Ils ont constaté qu’un mutant d’E. faecalis dépourvu de PrkC se développait à un rythme de type sauvage en l’absence de stress antimicrobien, mais montrait une sensibilité accrue aux composés actifs dans l’enveloppe cellulaire, y compris les antibiotiques qui ciblaient la biogenèse de la paroi cellulaire et les détergents biliaires.Le PrkC régule les processus physiologiques chez E. faecalis qui sont la clé de son succès en tant qu’agent pathogène nosocomial. La structure prédite par les chercheurs du PrkC était un domaine de kinase cytoplasmique séparé par un segment transmembranaire censé lier le peptidoglycane non réticulé. Cela suggère que le PrkC est un récepteur transmembranaire qui surveille l’intégrité de la paroi cellulaire d’E. faecalis et médie les réponses adaptatives pour maintenir cette intergrité. PrKC est important pour E. faecalis pour provoquer des infections nosocomiales, suggérant que la protéine de signalisation est une cible pour le développement de thérapies pour prévenir les infections par des entérocoques résistants aux antibiotiques.
1.) I. T. Paulsen, L. Banerjei, G. S. A. Myers, K. E. Nelson, R. Seshadri, T. D. Read, D. E. Fouts, J. A. Eisen, S. R. Gill, J. F. Heidelberg, H. Tettelin, R. J. Dodson, L. Umayam, L. Brinkac, M. Beanan, S. Daugherty, R. T. DeBoy, S. Durkin, J. Kolonay, R. Il s’agit d’une espèce de plantes de la famille des » Poaceae « , sous-famille des » Pooideae « , sous-famille des » Pooidaceae « , sous-famille des » Pooideae « , sous-famille des » Pooideae « , sous-famille des » Pooideae « , sous-famille des » Pooideae « , sous-famille des » Pooideae « , sous-famille des » Pooideae « , sous-famille des » Pooideae « , sous-famille des » Pooideae « , sous-famille des » Pooideae « . Fraser. « Rôle de l’ADN mobile dans l’évolution d’Enterococcus faecalis résistant à la vancomycine. » Sciences. Mars 2003. Vol. 299, No 5615. p. 2071-2074
2.) Murrary BE. Mai 1998. » Diversité parmi les entérocoques multirésistants. »Maladies infectieuses émergentes. Vol. 4, No 1. p. 46 à 65.
3.) De la Maza, Luis M., Marie T. Pezzlo et Janet T. Shigei. Atlas des couleurs de Bactériologie médicale. Washington, DC: American Society for Microbiology Press, 2004.
4.) Arias C., Singh K., Panesso D., Murray BE. « Time-Kill and Synergism Studies of Ceftobiprole against Enterococcus faecalis, Including ß-Lactamase-Producing and Vancomycin-Resistant Isolates. »Agents antimicrobiens et chimiothérapie. Juin 2007. Vol. 51, No 6. p. 2043-2047.
5.) Bourgeois-Nicolaos N., Massias L., Couson B., Butel MJ, Andremont A., Doucet-Populaire F. « Dose Dependence of Emergence of Resistance to Linezolid in Enterococcus faecalis In Vivo. »Le Journal des maladies infectieuses. 2007. Vol. 195. p. 1480-1488.
6.) Kristich C., Wells C., Dunny G. « Une kinase Ser/Thr de type eucaryote chez Enterococcus faecalis médie la résistance aux antimicrobiens et la persistance intestinale. » Proceedings of the National Academy of Sciences of the United States of America. Février 2007. Vol. 104, No 9. p. 3508 à 3513.
7.) Macovei, L., Zurek, L. « Ecology of Antibiotic Resistance Genes: Characterization of Enterococci from Houseflies Collected in Food Settings. »Microbiologie appliquée et environnementale. Juin 2006. Vol. 72, No 6. p. 4028-4035.
8.) Gilmore, Michael. Les Entérocoques: Pathogenèse, Biologie Moléculaire et Résistance aux antibiotiques. Washington, DC: American Society for Microbiology Press, 2002.
9.) Nallapareddy SR, Singh KV, Sillanpää J, Garsin DA, Höök M, Erlandsen SL, Murray BE.. « Endocardite et pili associés au biofilm d’Enterococcus faecalis. » Le Journal d’investigation clinique. Octobre 2006. Numéro 116. p. 2799 à 2807.
Édité par Richard A. Martinez de l’UC San Diego, élève de Rachel Larsen.