Qu’est-ce que la Liaison Ionique?
Des liaisons chimiques se forment lorsque l’énergie totale des atomes liés est inférieure à l’énergie totale des atomes séparés.La forme que prend la liaison est déterminée par la disposition des électrons qui minimise l’énergie.
Dans certains cas, les électrons sont partagés entre les atomes – c’est ce qu’on appelle la liaison covalente.
Dans d’autres cas, il y a un transfert complet d’un ou plusieurs électrons d’un atome à un autre.L’atome qui perd des électrons devient un ion chargé positivement.L’atome qui reçoit des électrons devient un ion chargé négativement.
Cela conduit à une liaison ionique – l’attraction électrostatique mutuelle du positif et du négatif charges.In sa forme la plus pure, la liaison ionique n’est pas directionnelle. Elle peut être considérée comme une simple attraction coulombique entre charges ponctuelles.Ceci est différent de la liaison covalente, dans laquelle le partage des électrons entraîne des liaisons directionnelles.
Transfert d’électrons
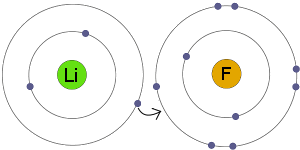
Li transfère un électron à F. Le résultat est que les deux ions résultants devenir électriquement chargé et avoir des coquilles d’électrons complètes et stables.
Attraction électrostatique
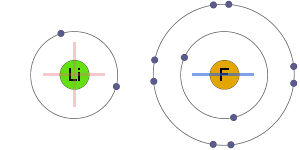
Le les ions positifs et négatifs sont attirés électrostatiquement les uns par les autres, ce qui entraîne une liaison ionique.
La force coulombique n’a pas de direction préférée, de sorte que les composés ioniques ont tendance à exister sous forme de structures de réseau cristallin géant d’ions emballés ensemble.
Un échantillon du Réseau cristallin du fluorure de lithium

Électronégativité et liaison ionique
Deux éléments auront tendance à se lier ioniquement lorsqu’ils diffèrent largement en électronégativité.
Tableau périodique de l’électronégativité
Plus la nuance de vert est claire, plus l’électronégativité est élevée. Le gris signifie qu’aucune valeur n’est connue. (Cliquez sur l’image pour l’agrandir.)

Caractère de liaison covalente
Les composés absolument purs liés ioniquement n’existent pas vraiment, car l’ion chargé positivement polarise le nuage d’électrons de l’ion négatif.Ceci est particulièrement visible lorsqu’il s’agit d’ions métalliques petits et fortement chargés tels que Al3 +, bien que l’effet polarisant soit présent dans une certaine mesure dans tous les composés ioniques.La polarisation est effectivement un effet directionnel de partage d’électrons, par conséquent elle introduit une petite quantité de covalence dans les composés ioniques.
La proportion de comportement ionique / covalent dans une liaison peut être évaluée très grossièrement en utilisant l’échelle de Pauling de l’électronégativité.Linus Pauling a estimé qu’une différence d’électronégativité de 1,7 entre les éléments conduit à une liaison ionique de 50%.
Les valeurs inférieures à 1 correspondent à la dominance de la liaison covalente et les valeurs supérieures à 2 à la dominance de la liaison ionique.
Electronegativity of Selected Elements (Pauling Scale)
| Element | Electronegativity |
|---|---|
| hydrogen | 2.20 |
| lithium | 0.98 |
| sodium | 0.93 |
| aluminum | 1.61 |
| carbon | 2.55 |
| oxygen | 3.44 |
| chlorine | 3.16 |
| iodine | 2.66 |
La liaison C-H avec une différence de 0,35 sera covalente, tandis que la liaison NaCl à 2,23 sera ionique.La liaison HCl à 0,96 sera covalente polaire et la liaison LiI à 1,68 sera ionique / covalente 50/50.
La plus grande différence d’électronégativité est de 3,19, entre le césium (0,79) et le fluor (3,98). La liaison résultante est d’environ 95% de caractère ionique.
