Un homme de 49 ans ayant des antécédents d’abus d’alcool se présente à l’urgence avec des plaintes de douleurs abdominales généralisées et de vomissements au cours des 36 dernières heures. Le patient est bien connu du service pour les visites liées à l’alcool et continue de boire quotidiennement. À son arrivée, il est tachycardique et tachypnéique, et les résultats de l’examen physique incluent des muqueuses sèches, une diminution de la turgescence de sakin, une sensibilité épigastrique et un tremblement des deux mains. Les études en laboratoire montrent un bicarbonate sérique de 10 mEq / L, un écart anionique de 30, une glycémie de 95 mg / dL, une acidose lactique à pH 7,2, une hypophosphatémie et une cétonurie à l’état de traces. La tomodensitométrie abdominale est normale. Il nie les antécédents de diabète sucré, l’ingestion d’alcools toxiques ou une maladie récente.
Ce patient pourrait potentiellement avoir l’un des nombreux diagnostics, mais sa présentation et les résultats de laboratoire sont les plus compatibles avec l’acidocétose alcoolique (AKA). L’AKA peut être un diagnostic de dysfonction érectile courant et survient généralement chez les buveurs d’alcool chroniques qui ont un arrêt brutal de leur consommation d’alcool associé à une diminution de l’apport glycémique et à un épuisement du volume intravasculaire.1
Dans la majorité des cas, un événement précipitant tel qu’une pancréatite, une gastrite ou une pneumonie par aspiration entraîne une baisse brutale de la prise orale. Environ 24 à 72 heures après l’arrêt de la prise de PO, AKA peut se développer.2 Ces patients ont généralement une concentration sérique d’alcool faible ou absente et peuvent présenter des degrés variables de sevrage alcoolique. Cependant, un sensorium clair est une caractéristique de cette condition. La présence d’une altération de la conscience suggère fortement qu’un autre processus est présent.3
Bien que la physiopathologie sous-jacente soit complexe, une bonne compréhension facilite grandement le diagnostic et la prise en charge de cette affection.
Il existe trois concepts généraux qui animent AKA:
- L’ingestion d’alcool, associée à une diminution de l’apport calorique et à une déshydratation, favorise un état cétotique.
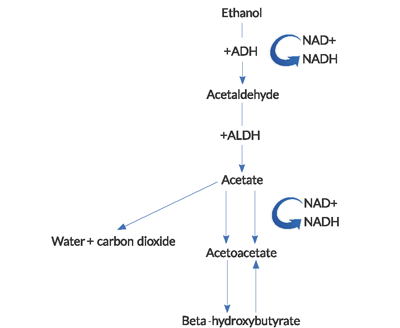
L’acidocétose est causée par une combinaison de facteurs, notamment l’hypoinsulinémie induite par la famine, l’oxydation de l’alcool en ses différents métabolites cétoniques, la lipolyse avec libération d’acide gras libre (AFF) et la contraction du volume intravasculaire. L’état de famine relative chez AKA entraîne une sécrétion excessive de glucagon et une réduction des concentrations périphériques d’insuline, ce qui joue un rôle clé dans le développement de l’acidocétose. Le métabolisme des graisses par lipolyse produit du bêta-hydroxybutyrate (BHB) et de l’acytyl-acétate (ACA). Ces cétones sont utilisées pour la respiration cellulaire afin de fournir de l’énergie par la production d’adénosine triphosphate (ATP), mais s’ajoutent à l’acidose de l’espace anionique observée chez AKA.
- Pendant le métabolisme de l’éthanol, des quantités élevées de NADH (la forme réduite du dinucléotide nicotinamide-adénine) sont générées.4
Le NAD+ est une coenzyme utilisée pour transporter des électrons dans les réactions redox intracellulaires. La réduction du NAD + et l’accumulation et le déséquilibre consécutifs du NADH dans le métabolisme de l’éthanol ont plusieurs conséquences importantes. La génération de BHB prédomine sur la production d’ACA dans ce rapport NADH/ NAD + élevé. Ce rapport anormal conduit à une inhibition du cycle de l’acide citrique et de la gluconéogenèse hépatique, ce qui explique en partie pourquoi l’hyperglycémie est rare chez ces patients.De manière presque contre-intuitive, il y a un échec de la régénération des niveaux normaux de NAD + et d’ACA dans AKA. La réoxydation du NADH en NAD+ semble être limitée par une combinaison de facteurs, y compris une hypophosphatémie et un bloc fonctionnel au sein des mitochondries.2l’acidose lactique observée chez AKA est due à un état rédox anormal. Le pyruvate est un substrat utilisé dans de nombreuses voies productrices d’énergie, mais dans l’acidocétose alcoolique, il est déplacé de ses voies métaboliques normales vers d’autres qui augmentent la production de lactate. De plus, la régénération du pyruvate à partir de l’acide lactique est altérée.
- Un état adrénergique accru et une déplétion volumique aggravent la cétose et inhibent la gluconéogenèse, créant un état qui favorise la création et le maintien d’un milieu cétotique.
Le corps réagit à la famine, à la déshydratation et à l’hypoglycémie par la libération d’hormones contre-régulatrices. Ces hormones augmentent le tonus sympathique, diminuent la libération d’insuline et augmentent la concentration de cétone grâce à la libération d’AGF et à une diminution du métabolisme cétonique périphérique. Tous ces changements perpétuent l’état cétotique jusqu’à ce que le glucose soit réintroduit dans le système. Une déshydratation importante due à des vomissements et une diminution de la prise orale entraînent une altération de la clairance cétonique rénale, aggravant encore la situation.2Le diagnostic différentiel de l’AKA devrait inclure la cétose de famine et l’acidocétose diabétique (ACD). Bien qu’une histoire approfondie puisse aider à réduire le différentiel, un panel métabolique est essentiel pour confirmer le diagnostic. Des lacunes d’anions de 30 mEq / L ou plus peuvent être observées dans AKA, bien que l’écart puisse être masqué par une alcalose métabolique primaire concomitante due à des vomissements. En fait, il existe des cas de patients atteints d’AKA qui ont un pH sérique alcalémique dû à des vomissements excessifs.L’écart anionique dans la cétose de famine est généralement beaucoup plus faible, avec des niveaux de bicarbonate rarement inférieurs à 18 mEq / L et un pH sérique généralement supérieur à 7,30.2 En DKA, en revanche, l’écart d’anions peut être assez élevé, les niveaux de bicarbonate atteignant fréquemment les chiffres simples. L’hyperglycémie avec glycosurie, généralement observée dans l’acidocétose diabétique (ACD), est rare avec AKA.4 La malnutrition chronique entraîne de faibles réserves de glycogène et l’augmentation du tonus adrénergique entraîne une inhibition de la gluconéogenèse hépatique. La cétonurie, présente dans ces trois conditions, peut confondre la gravité de l’AKA.La cétonurie est mesurée par le test au nitroprussiate, dans lequel un changement de couleur indique la concentration relative d’acétone et d’ACA dans l’urine. La présence de BHB, la cétone la plus importante présente dans l’AKA, n’est pas reflétée par le test au nitroprussiate. Ceci explique pourquoi les patients atteints d’AKA peuvent ne présenter aucune cétonurie ou seulement une légère cétonurie lors de la présentation initiale, avec une augmentation paradoxale lorsque la condition est inversée. Au fur et à mesure que le rapport ACA: BHB se normalise, l’ACA et le BHB détectables sont éliminés dans l’urine.
Diagnostic différentiel
D’autres conditions potentiellement mortelles pouvant entraîner une acidose significative de l’écart anionique doivent également être prises en compte dans le diagnostic différentiel. Les alcools toxiques, en particulier le méthanol et l’éthylène glycol, peuvent être ingérés intentionnellement ou accidentellement dans cette population de patients. Ces ingestions peuvent entraîner une morbidité et une mortalité importantes si elles ne sont pas prises en charge de manière appropriée.5 L’altération de l’état mental est une caractéristique courante de l’ingestion d’alcool toxique, mais elle n’est généralement pas observée chez AKA.5
Les patients présentent généralement un gap osmolaire initial qui se transforme en un gap anionique accru lorsque l’alcool toxique est métabolisé. Une concentration sérique élevée de BHB peut être assez élevée dans l’AKA, mais cela n’exclut pas nécessairement la possibilité d’ingestion d’alcool toxique; l’absence d’un écart osmolaire ou anionique n’exclut pas non plus le diagnostic. Alors que les patients atteints d’AKA présentent une légère acidose lactique, la présence d’un taux de lactate significativement élevé devrait inciter à rechercher une maladie sous-jacente. Rarement, une combinaison d’AKA et de l’un de ces autres événements peut se produire et présenter une énigme diagnostique. Une considération réfléchie du moment, du type et de la quantité d’ingestion, et des symptômes associés, en combinaison avec des études d’observation et de laboratoire, doit être utilisée pour faire cette différenciation s’il manque un historique clair et précis.
Traitement
L’inversion de la cétose et une réhydratation vigoureuse sont centrales dans la prise en charge de l’AKA. En plus du remplacement du liquide isotonique, des liquides intraveineux contenant du dextrose sont nécessaires. Typiquement, 5% de dextrose avec une solution saline à moitié normale à raison de 150 mL par heure fournit suffisamment de glucose pour stimuler le pancréas à sécréter de l’insuline, permettant aux tissus périphériques de métaboliser les cétones et d’inhiber la libération de FFA.2 Il permet également au corps de régénérer le NAD +, qui est inhibé par les altérations métaboliques causées par l’AKA. Les perfusions intraveineuses de liquide contenant du dextrose doivent être arrêtées une fois que les niveaux de bicarbonate ont atteint 18-20 mEq / L et que le patient tolère une prise orale. Cela se produit généralement 8 à 16 heures après le début du traitement.2 Le sevrage alcoolique chez ces patients doit être géré de manière agressive avec des benzodiazépines intraveineuses. La thiamine, le folate et d’autres électrolytes, notamment le phosphate et le potassium, peuvent nécessiter une réplication chez ces patients.6 Fait intéressant, la majorité de la morbidité observée chez AKA est due au processus sous-jacent qui a provoqué l’arrêt de l’alcool.
Conclusion du cas
Le patient a reçu 4 litres de solution saline normale et a été commencé à J5-1/2 NS avant l’admission. On lui a donné du valium IV pour le sevrage alcoolique, et de la thiamine, du folate et du phosphate ont été replés. Il a été hospitalisé pendant trois jours pour une prise en charge de l’AKA et du sevrage alcoolique, puis est sorti une fois toléré la prise orale et en bon état. Il a été vu trois semaines plus tard au service des urgences pour une présentation similaire.
Tableau 1. Characteristics of Common Ketoacidoses
| Diabetic Ketoacidosis | Alcoholic Ketoacidosis | Starvation Ketoacidosis | |
| Bicarbonate | Can reach single digits | Can reach single digits | > 18 |
| Glucose | Elevated | Low to mildly elevated | Low to normal |
| Measurable ketonuria | Present | Absent or present | Present |
Figure 1. Voie du métabolisme de l’alcool
(ADH = alcool déshydrogénase, ALDH = acétaldéhyde déshydrogénase).
- Palmer, Jerry P. Acidocétose alcoolique: Présentation clinique et de laboratoire, physiopathologie et traitement. Cliniques en endocrinologie et métabolisme 12.2 (1983): 381-389.
- Duffens K, Marx JA. Examen de l’acidocétose alcoolique.Le Journal de médecine d’urgence 5.5 (1987): 399-406.
- Wrenn KD, Slovis CM, Minion GE, et al. Le syndrome d’acidocétose alcoolique. The American journal of Medicine 91.2 (1991): 119-128.
- Marx JA, Hockberger RS, Walls RM, et al., EDS. Médecine d’urgence Rosens™: Concepts et pratique clinique. Philadelphie, Pennsylvanie : Mosby/ Elsevier; 2013. Chapitre 185 Maladie liée à l’alcool par John T. Finnell.
- Kraut JA, Kurtz I. â € Œtoxic alcohol ingestions: clinical features, diagnosis, and management. Journal clinique de la Société américaine de Néphrologie 3.1 (2008): 208-225.
- Miller PD, Heinig R, Waterhouse C. Traitement de l’acidose alcoolique: le rôle du dextrose et du phosphore. Archives de médecine interne 138.1 (1978): 67-72.