Propriétés des Composés Covalents
Lorsque nous avons parlé des composés ioniques solides dans les Composés ioniques, nous avons constaté que leurs propriétés dérivent souvent de la forte attraction de charges électriques opposées. Il ne faut pas s’étonner de constater que les propriétés des composés covalents sont en grande partie dues à la nature des liaisons covalentes.
L’une des choses les plus importantes à retenir sur les composés covalents est qu’ils ne sont pas ioniques. Cela semble évident, mais la différence est en fait plus subtile que vous ne l’imaginez. Pour illustrer ce concept, regardez la figure suivante:
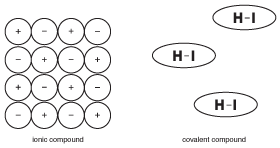
Figure 9.5Les propriétés des composés ioniques solides sont basées sur le fait que de nombreux ions sont maintenus rigidement en place avec des forces électriques. Les molécules des composés covalents, cependant, fonctionnent avec une relative indépendance par rapport aux molécules voisines.
Contrairement aux composés ioniques, où tous les ions d’un grand cristal aident à se maintenir ensemble, les molécules d’un composé covalent sont maintenues ensemble par des forces appelées « forces intermoléculaires », qui sont beaucoup plus faibles que les liaisons chimiques (plus sur les forces intermoléculaires dans les Solides). En conséquence, les molécules d’un composé covalent ne sont pas attirées les unes par les autres autant que les ions des composés ioniques. Cette différence de structure est importante pour comprendre les propriétés des composés covalents.
Les composés covalents Ont de Faibles Points de Fusion et d’ébullition
Comme mentionné dans les Composés ioniques, une grande quantité d’énergie est nécessaire pour faire fondre un composé ionique en raison des fortes interactions entre les cations et les anions dans un cristal ionique. Cependant, dans les composés covalents, toutes les molécules ne sont liées que faiblement aux molécules voisines; par conséquent, il faut très peu d’énergie pour séparer les molécules covalentes les unes des autres.
De nombreux étudiants débutants en chimie croient à tort que lorsqu’une molécule covalente fond, les liaisons covalentes sont brisées. C’est faux. Lorsque les composés ioniques fondent, l’attraction ionique échoue. Lorsque les composés covalents fondent, les molécules s’éloignent simplement les unes des autres, laissant les liaisons intactes.
Les composés covalents Sont de mauvais conducteurs
Les composés ioniques sont d’excellents conducteurs d’électricité lorsqu’ils sont dissous ou fondus. Comme mentionné dans les composés ioniques, c’est parce que les composés ioniques ont des ions mobiles capables de transférer une charge électrique d’un endroit à un autre. Ils conduisent également très bien la chaleur car les ions sont parfaitement côte à côte, ce qui permet de transférer efficacement l’énergie d’un endroit à un autre.
Les composés covalents, en revanche, sont presque toujours de bons isolants d’électricité et de chaleur. L’électricité n’est pas capable de conduire efficacement à travers des composés covalents car il n’y a pas d’ions pour déplacer la charge électrique. Un excellent exemple de ceci est dans votre propre maison, où le métal de vos rallonges est recouvert de plastique pour éviter d’électrocuter votre chat. La chaleur ne se déplace pas bien à travers les composés covalents car les molécules ne sont pas aussi étroitement maintenues les unes aux autres que les ions d’un composé ionique, ce qui rend le transfert de chaleur moins efficace. C’est pourquoi vous utilisez des mitaines pour sortir vos biscuits du four plutôt que de vous enduire les mains de sel.
Les composés covalents Brûlent parfois
Les composés organiques sont des composés covalents contenant du carbone. Ils contiennent généralement également de l’hydrogène. et peut contenir de plus petites quantités d’autres éléments tels que l’azote, le soufre, le phosphore, l’oxygène ou l’un des halogènes.
De nombreux composés covalents sont inflammables et brûlent facilement avec l’ajout de chaleur. Le groupe principal de composés covalents inflammables est appelé composés organiques. Les composés organiques brûlent parce qu’ils contiennent du carbone et de l’hydrogène, qui se combinent bien avec l’oxygène à haute température.
Il est important de garder à l’esprit que tous les composés covalents ne brûlent pas?par exemple, l’eau est un composé covalent et vous aurez beaucoup de mal à allumer un feu avec elle. Cependant, beaucoup plus de composés covalents que ioniques sont inflammables.
L’inflammabilité est une propriété générale des composés covalents car une grande majorité des composés covalents connus sont organiques. Étant donné que la plupart des composés organiques brûlent, nous pouvons en toute sécurité énumérer cela comme une propriété des composés covalents même s’il existe de nombreux composés covalents qui ne brûlent pas.
Extrait de The Complete Idiot’s Guide to Chemistry 2003 par Ian Guch. Tous droits réservés y compris le droit de reproduction en tout ou en partie sous quelque forme que ce soit. Utilisé par arrangement avec Alpha Books, membre de Penguin Group (USA) Inc.
Pour commander ce livre directement auprès de l’éditeur, visitez le site Web de Penguin USA ou appelez le 1-800-253-6476. Vous pouvez également acheter ce livre sur Amazon.com et Barnes &Noble.