Tendances périodiques et effets des solvants sur la nucléophilie
Il existe des tendances périodiques prévisibles de la nucléophilie. En se déplaçant horizontalement sur la deuxième ligne du tableau, la tendance de la nucléophilie est parallèle à la tendance de la basicité:
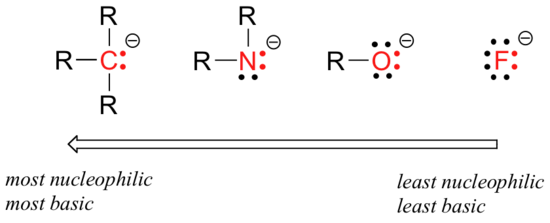
Le raisonnement derrière la tendance à la nucléophilie horizontale est le même que le raisonnement derrière la tendance à la basicité: les éléments plus électronégatifs retiennent plus étroitement leurs électrons et sont moins capables de les donner pour former une nouvelle liaison.
Cette tendance horizontale nous indique également que les amines sont plus nucléophiles que les alcools, bien que les deux groupes agissent généralement comme nucléophiles dans les réactions de laboratoire et biochimiques.
Rappelons que la basicité des atomes diminue lorsque nous nous déplaçons verticalement dans une colonne du tableau périodique: les ions thiolates sont moins basiques que les ions alcoxyde, par exemple, et l’ion bromure est moins basique que l’ion chlorure, qui à son tour est moins basique que l’ion fluorure. Rappelons également que cette tendance peut s’expliquer en considérant la taille croissante du « nuage d’électrons » autour des ions les plus gros: la densité électronique inhérente à la charge négative est répartie sur une plus grande surface, ce qui tend à augmenter la stabilité (et donc à réduire la basicité).
La tendance périodique verticale de la nucléophilie est un peu plus compliquée que celle de la basicité: selon le solvant dans lequel se déroule la réaction, la tendance à la nucléophilie peut aller dans les deux sens. Prenons l’exemple simple de la réaction SN2 ci-dessous :
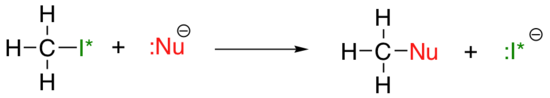
. . .où Nu- est l’un des ions halogénures: fluorure, chlorure, bromure ou iodure, et le groupe partant I * est un isotope radioactif de l’iode (ce qui permet de distinguer le groupe partant du nucléophile dans ce cas où les deux sont de l’iodure). Si cette réaction se produit dans un solvant protique (c’est-à-dire un solvant qui a un hydrogène lié à un oxygène ou à de l’azote – l’eau, le méthanol et l’éthanol sont les exemples les plus importants), la réaction ira plus vite lorsque l’iodure est le nucléophile, et la plus lente lorsque le fluorure est le nucléophile, reflétant la force relative du nucléophile.

Nucléophilie relative dans un solvant protique
Ceci est bien sûr opposé à la tendance périodique verticale de basicité, où l’iodure est le moins basique. Que se passe-t-il ici ? La base la plus forte, avec ses électrons de valence non liés plus réactifs, ne devrait-elle pas également être le nucléophile le plus fort?
Comme mentionné ci-dessus, tout est lié au solvant. Rappelez-vous, nous parlons maintenant de la réaction dans un solvant protique comme l’éthanol. Les molécules de solvant protiques forment de très fortes interactions ion-dipôle avec le nucléophile chargé négativement, créant essentiellement une « cage de solvant » autour du nucléophile :

Pour que le nucléophile attaque l’électrophile, il doit se libérer, au moins en partie, de sa cage de solvant. Les électrons de la paire unique de l’ion iodure plus gros et moins basique interagissent moins étroitement avec les protons des molécules de solvant protiques – ainsi, le nucléophile iodure est mieux en mesure de se libérer de sa cage de solvant par rapport à l’ion fluorure plus petit et plus basique, dont les électrons de la paire unique sont liés plus étroitement aux protons de la cage.
L’image change si nous passons à un solvant aprotique polaire, tel que l’acétone, dans lequel il y a un dipôle moléculaire mais pas d’hydrogènes liés à l’oxygène ou à l’azote. Maintenant, le fluorure est le meilleur nucléophile, et l’iodure le plus faible.
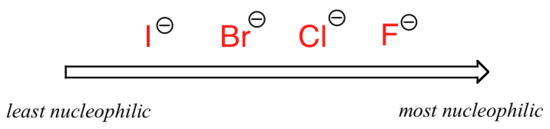
Nucléophilie relative dans un solvant aprotique polaire
La raison de l’inversion est que, avec un solvant aprotique, les interactions ion-dipôle entre le solvant et le nucléophile sont beaucoup plus faibles: l’extrémité positive du dipôle du solvant est cachée à l’intérieur de la molécule et est donc protégée de la charge négative du nucléophile.
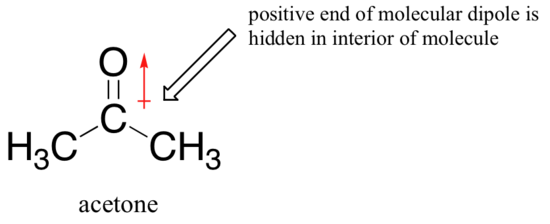
Une interaction solvant-nucléophile plus faible signifie une cage de solvant plus faible pour que le nucléophile puisse percer, de sorte que l’effet solvant est beaucoup moins important et que l’ion fluorure plus basique est également le meilleur nucléophile.
Pourquoi ne pas utiliser un solvant complètement apolaire, tel que l’hexane, pour cette réaction, de sorte que la cage de solvant soit complètement éliminée? La réponse à cela est simple : le nucléophile doit être en solution pour réagir à une vitesse appréciable avec l’électrophile, et un solvant tel que l’hexane ne solvatera pas du tout un nucléophile chargé (ou hautement polaire). C’est pourquoi les chimistes utilisent des solvants aprotiques polaires pour les réactions de substitution nucléophile en laboratoire: ils sont suffisamment polaires pour solvater le nucléophile, mais pas suffisamment polaires pour l’enfermer dans une cage de solvant impénétrable. En plus de l’acétone, trois autres solvants aprotiques polaires couramment utilisés sont l’acétonitrile, le diméthylformamide (DMF) et le diméthylsulfoxyde (DMSO).
En chimie biologique, où le solvant est protique (eau), l’implication la plus importante des tendances périodiques de la nucléophilie est que les thiols sont des nucléophiles plus puissants que les alcools. Le groupe thiol d’un acide aminé cystéine, par exemple, est un nucléophile puissant et agit souvent comme nucléophile dans les réactions enzymatiques, et bien sûr les thiolates chargés négativement (RS-) sont encore plus nucléophiles. Cela ne veut pas dire que les groupes hydroxyles sur la sérine, la thréonine et la tyrosine n’agissent pas non plus comme des nucléophiles – ils le font.