Objectifs
- Solutions connues et inconnues des ions métalliques \(\ce{Ag^{+}}\), \(\ ce {Fe^{3+}}\), \(\ ce {Co^{2+}}\), \(\ ce{Cu^{2+}}\) et \(\ce{Hg^{2+}}\) seront analysés par chromatographie sur papier.
- Une solution inconnue contenant certains de ces cations sera identifiée par comparaison aux valeurs Rf et aux couleurs des taches colorées des solutions connues.
La plupart des chimistes et de nombreux autres scientifiques doivent régulièrement séparer les mélanges et identifier leurs composants. La capacité d’identifier qualitativement les substances trouvées dans un échantillon peut être critique. Par exemple, un chimiste de l’environnement qui étudie des échantillons d’eaux souterraines polluées voudra savoir quels ions toxiques pourraient être présents dans un échantillon.
La chromatographie est l’un des premiers outils utilisés dans de telles situations. Dans cette technique, de nombreux types de mélanges peuvent être séparés en substances pures constitutives; par comparaison à un échantillon standard, chaque substance constitutive peut également être provisoirement identifiée.
Il existe de nombreuses variétés de chromatographie, chacune conçue pour séparer des types spécifiques de mélanges. La caractéristique commune de chaque type de chromatographie est qu’une phase mobile (un liquide ou un gaz) est poussée à travers une phase stationnaire (un solide). Le tableau 1 énumère plusieurs variétés de chromatographie et les identités typiques des phases. La chromatographie sur papier sera utilisée dans cette expérience.
|
Type of Chromatography |
Mobile Phase |
Stationary Phase |
|---|---|---|
|
Gas (GC) |
inert gas (helium) |
waxy liquid or silicone inside narrow tubing |
|
Liquid |
solvent/solvent Mixture (organic or aqueous) |
solid packing (silica, alumina) |
|
Paper |
solvent/solvent Mixture (organic or aqueous) |
paper |
|
Thin-Layer (TLC) |
solvent/solvent Mixture (organic or aqueous) |
silica/alumina coated glass, plastic or metal |
L’exemple de chromatographie sur colonne (Figure 1) montre les caractéristiques typiques de cette technique analytique. Le diagramme montre une expérience où un mélange à deux composants est soumis à une chromatographie sur colonne. La colonne est emballée avec un matériau solide appelé phase stationnaire. Un solvant liquide ou une solution d’élution est versé dans la colonne et mouille complètement le matériau d’emballage solide. Ensuite, le mélange est chargé sur le dessus de la colonne humide et plus d’éluant est ajouté. La gravité tire la phase mobile vers le bas à travers la phase stationnaire et les composants du mélange commencent à se déplacer dans la colonne à des vitesses différentes. Dans le diagramme, le composant A se déplace plus vite que le composant B; ainsi, le composant B est retenu sur la colonne plus longtemps que le composant A. Cela est généralement dû à une différence de solubilité des deux composés dans le solvant et / ou à une différence d’attraction vers le matériau d’emballage solide. Comme plus d’éluant est ajouté en haut de la colonne, les composants finiront par quitter la colonne séparément. Le temps de sortie de la colonne, appelé temps de rétention, sera reproductible pour chaque composant dans les conditions définies données – identités de phase mobile et stationnaire, température et largeur de colonne. Une fois les composants sortis de la colonne, le solvant peut être éliminé par évaporation et les composants purs peuvent être analysés ou identifiés plus avant.
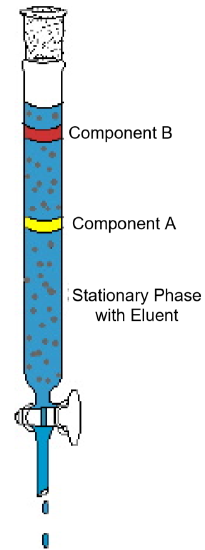
Figure 1: Une expérience typique de chromatographie sur colonne montre la séparation d’un mélange à deux composants.
Une identification provisoire des composants peut être obtenue en comparant le mélange inconnu à un mélange connu soigneusement préparé: si un composant connu a le même temps de rétention qu’un composant inconnu dans les mêmes conditions, il est probable — mais non concluant — que les deux composants sont identiques. Une analyse plus approfondie peut être nécessaire pour confirmer cette hypothèse. Si le connu et l’inconnu ont des temps de rétention différents, il est peu probable que les deux composants soient identiques.
D’autres variantes de la chromatographie utilisent l’action capillaire – l’attraction d’un liquide sur une surface solide — pour tirer un solvant à travers un matériau solide. Une version informelle de la chromatographie sur papier peut être observée lorsqu’une page écrite à l’encre entre en contact avec de l’eau ou d’autres liquides. L’encre coule et plusieurs couleurs sont séparées dans le trait d’encre.
Le diagramme ci-dessous (figure 2) montre le résultat d’une expérience de chromatographie sur couche mince. Deux taches d’encre noire sur la surface solide ont été traversées par un solvant. Le solvant est de l’eau ou un autre liquide qui est tiré à travers la phase stationnaire par capillarité. Dans cet example, une pièce de matière plastique revêtue d’un solide en poudre est utilisée comme phase stationnaire. Alternativement, un morceau de papier filtre peut être utilisé comme phase stationnaire. L’expérience montre que l’encre noire est un mélange contenant plusieurs substances colorées différentes. Chaque composant a une solubilité légèrement différente dans la phase mobile, de sorte que lorsque le liquide est tiré à travers la phase stationnaire, chaque composant se déplace à une vitesse différente, séparant l’encre en taches de couleurs différentes.

Figure 2 : chromatographie en couche mince de l’encre noire après développement. Cette image montre un problème courant où les taches s’élargissent au fur et à mesure qu’elles remontent la plaque, pour finalement fusionner en haut de la plaque.
Dans cette expérience, des principes similaires sont utilisés pour séparer plusieurs cations métalliques par une procédure de chromatographie sur papier. Les ions métalliques – \(\ce{Ag^{+}}\), \(\ ce {Fe^{3+}}\),\(\ ce {Co^{2+}}\), \(\ ce{Cu^{2 +}} \), et \(\ce{Hg ^{2 +}} \) – ont une solubilité différente dans la phase mobile — aqueuse \(\ce{HCl}\) avec l’alcool éthylique et butylique – et se déplaceront à des vitesses différentes vers le haut du papier. Les différentes solubilités métal-ion sont probablement dues à la formation de divers composés avec l’ion chlorure et à leur capacité variable à se dissoudre dans le solvant organique.
Un diagramme montrant comment préparer le papier est illustré ci-dessous. Des solutions standard contenant chacun de ces ions seront repérées sur le papier à l’aide d’un tube capillaire, ainsi qu’une solution standard contenant les cinq ions. Un inconnu sera également repéré sur le papier. Une fois le papier préparé, il sera développé en plaçant le papier dans l’éluant. Après 75 à 90 minutes, le papier est visualisé en le mouillant avec une solution aqueuse contenant de l’iodure de potassium, \(\ce{KI}\) et du ferrocyanure de potassium, \(\ce{K4}\). La couleur unique observée pour chaque ion est produite par une réaction chimique avec la solution de visualisation. C’est un moyen utile d’identifier quels ions sont présents dans un mélange inconnu.
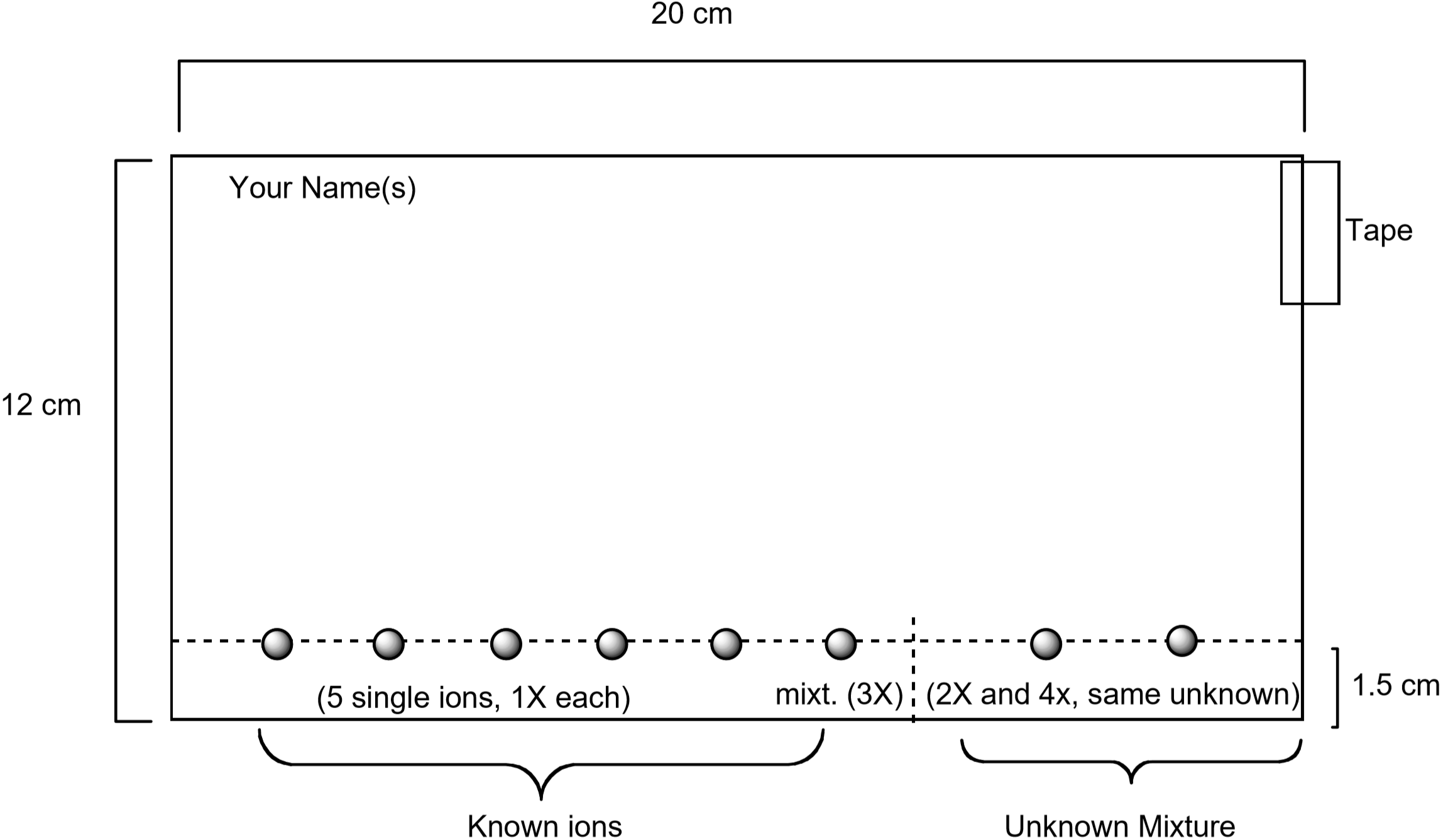
Figure 3: Diagramme montrant comment préparer le papier pour l’expérience de chromatographie
La distance parcourue par l’ion peut également être utilisée pour identifier l’ion. Cependant, étant donné que les étudiants développeront leurs expériences de chromatographie pendant différentes périodes de temps et dans des conditions légèrement différentes, chaque étudiant aura une distance mesurée quelque peu différente pour un ion donné. Le rapport entre la distance parcourue par un ion (\(D\)) et la distance parcourue par le solvant (\(F\), front de solvant) est caractéristique et devrait être presque le même pour tous les élèves. Ce rapport est appelé Rf, ou « facteur de rétention. »
\
Procédure
Matériaux et équipements
Produits chimiques: 0.1 M de solutions aqueuses de \(\ce{AgNO3}\), \(\ce{Hg(NO3)2}\), \(\ce{Fe(NO3)3}\), \(\ce{Co(NO3)2}\) et \(\ce{Cu(NO3)2}\), chacune avec des tubes capillaires dédiés; solution d’élution (aqueuse \(\ce{HCl}\) avec de l’alcool éthylique et butylique); solution de visualisation (solution aqueuse de \(\ce{KI}\) et \(\ce{K4}\)).
Équipement: Papier de chromatographie propre; gants jetables en latex (gants en nitrile disponibles dans la réserve pour les personnes allergiques au latex); bécher de 600 mL; pellicule plastique; pinces ou pinces à bécher; règle *
*Articles obtenus en stock
Sécurité
Éviter tout contact avec les solutions d’ions métalliques, le solvant d’élution et la solution de visualisation. Portez des gants jetables pour toucher votre chromatogramme après l’élution et pour le reste de l’expérience. Ne respirez pas les vapeurs du solvant éluant ou de la solution de visualisation. Placez le chromatogramme humide sur une serviette en papier, pas directement sur le banc de laboratoire. Utilisez la solution de visualisation uniquement dans l’espace prévu par votre instructeur. Jetez les gants et le chromatogramme dans le conteneur à déchets spécifié une fois l’expérience terminée. Lavez-vous soigneusement les mains après le contact avec toutes les solutions de ce laboratoire.
Préparation du papier pour chromatographie
- Chaque paire d’élèves doit obtenir un morceau de papier filtre aux dimensions indiquées à la figure 3. Assurez-vous que le papier est propre et sans déchirures ni plis. Utilisez un crayon — pas un stylo — et une règle pour tracer une ligne sur le papier à un cm du bord long du papier. Vous apercevrez les solutions d’ions métalliques sur cette ligne. Écrivez votre nom au crayon dans le coin supérieur gauche du papier.
- Entraînez-vous à repérer des solutions d’eau et / ou d’ions sur une bande de papier filtre afin de savoir comment créer des taches de la bonne taille. Utilisez des tubes capillaires en verre pour repérer les ions sur le papier. La solution est appliquée en touchant légèrement et rapidement un tube capillaire contenant la solution à la ligne que vous avez dessinée sur le papier. Les taches doivent avoir un diamètre compris entre 5 et 8 mm. Des taches plus grandes que cela s’étaleront excessivement pendant l’expérience et rendront l’analyse difficile.
- Connu 0.Des solutions aqueuses de 1 M de \(\ce{AgNO3}\), \(\ce{Hg(NO3)2}\), \(\ce{Fe(NO3)3}\), \(\ce{Co(NO3)2}\) et \(\ce{Cu(NO3)2}\) sont fournies dans des tubes à essai contenant chacun deux ou trois tubes capillaires. En commençant à gauche, marquez l’identité de l’ion sous chaque tache avec un crayon; puis repérez soigneusement chaque ion connu sur la ligne. Veillez à éviter de contaminer le tube capillaire avec d’autres ions et replacez les tubes capillaires dans le tube à essai approprié. Un tube à essai contenant un mélange connu des cinq ions est également muni d’un ensemble de tubes capillaires. Repérez également ce mélange sur la ligne. Parce que cette solution est plus diluée que les solutions connues à un seul ion, appliquez le mélange connu trois fois, en laissant sécher la tache entre chaque application. Une lampe chauffante aidera à sécher la tache plus rapidement.
- Plusieurs inconnues sont également fournies dans les tubes à essai, ainsi que les tubes capillaires. Votre instructeur vous indiquera quelle inconnue doit être utilisée. Les inconnues contiendront entre un et quatre cations, et sont plus diluées que les solutions connues à un seul ion. L’inconnu devra également être appliqué deux et quatre fois pour les deux essais, en laissant la tache sécher entre chaque application. En cas d’erreur, vous devez repérer l’inconnu à deux endroits le long de la ligne afin que deux essais soient disponibles pour analyse.
Développement du papier de chromatographie
- Placez un morceau de ruban adhésif le long du bord supérieur droit, comme illustré à la figure 3. Ensuite, formez un cylindre en reliant les deux bords courts du papier avec le ruban adhésif. Assurez-vous que les bords ne se touchent pas. Le document devrait ressembler à la figure 4.
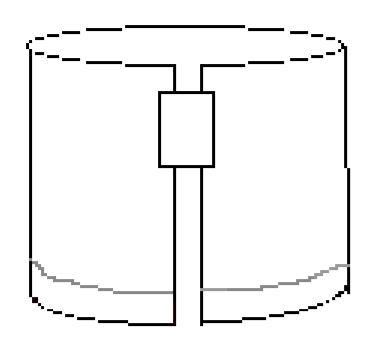
Figure 4: Le papier plié doit ressembler à ceci avant de développer l’expérience.
- Obtenir 15 mL de la solution d’élution. Versez délicatement une partie de ce solvant dans un bécher de 600 mL et tourbillonnez délicatement pendant une seconde ou deux. Attention : Ne respirez pas les vapeurs de cette solution! Assurez-vous que le niveau du liquide sera inférieur à la ligne de tache sur le papier une fois que le papier est placé dans la chambre de développement.
- Placez le cylindre de papier dans le bécher avec le bord marqué vers le bas. Les taches doivent être au-dessus du niveau du solvant. Le papier ne doit pas toucher les côtés du bécher. Couvrez soigneusement le bécher d’une pellicule plastique et placez-le dans la hotte pendant 75 à 90 minutes. Le solvant devrait commencer à remonter le papier. Une fois le bécher couvert, assurez-vous qu’il est de niveau et ne le dérangez pas pendant la période de développement. Votre instructeur peut avoir une tâche sur laquelle vous pouvez travailler pendant que vous attendez.
Visualisation et analyse du papier
- Une fois la période de développement terminée, porter des gants jetables et retirer le papier du bécher. Des gants en latex sont disponibles en laboratoire et des gants en nitrile sont disponibles en réserve pour les personnes allergiques au latex. Laissez tout solvant s’égoutter dans le bécher, puis retirez le ruban adhésif. Posez le papier de chromatographie sur une serviette en papier et marquez immédiatement le devant du solvant avec un crayon. Verser le solvant d’élution utilisé dans le récipient à déchets fourni. Séchez le papier sous une lampe chauffante dans la hotte. Précaution: Ne respirez pas les vapeurs! Veillez à ne pas brûler le papier sous la lampe.
- Une fois le papier sec, apportez-le au poste de visualisation sur la serviette en papier. Trempez brièvement le papier dans la solution de visualisation située dans un plat peu profond dans la hotte. Retirez immédiatement le papier de la solution et laissez tout excès s’égoutter à la station. Placez le papier humide sur une serviette en papier sèche et séchez-le immédiatement sous une lampe chauffante, puis transportez-le sur votre banc pour analyse.
- Trouvez d’abord chaque ion unique connu et enregistrez les couleurs que vous observez. Certaines taches peuvent s’estomper avec le temps, alors enregistrez les couleurs pendant que le papier est encore humide. Mesurez la distance que chaque point a déplacée, D, avec une règle. Mesurez au centre de chaque point. Enregistrez vos données dans le tableau de données.
- Mesurez la distance au front du solvant, F. La valeur de F doit être approximativement la même sur l’ensemble du papier. Utilisez ces valeurs pour calculer le rf pour chaque ion. Faites vos mesures comme indiqué à la figure 5. Chaque point observé a sa propre valeur Rf. Enregistrez vos résultats dans le tableau de données.
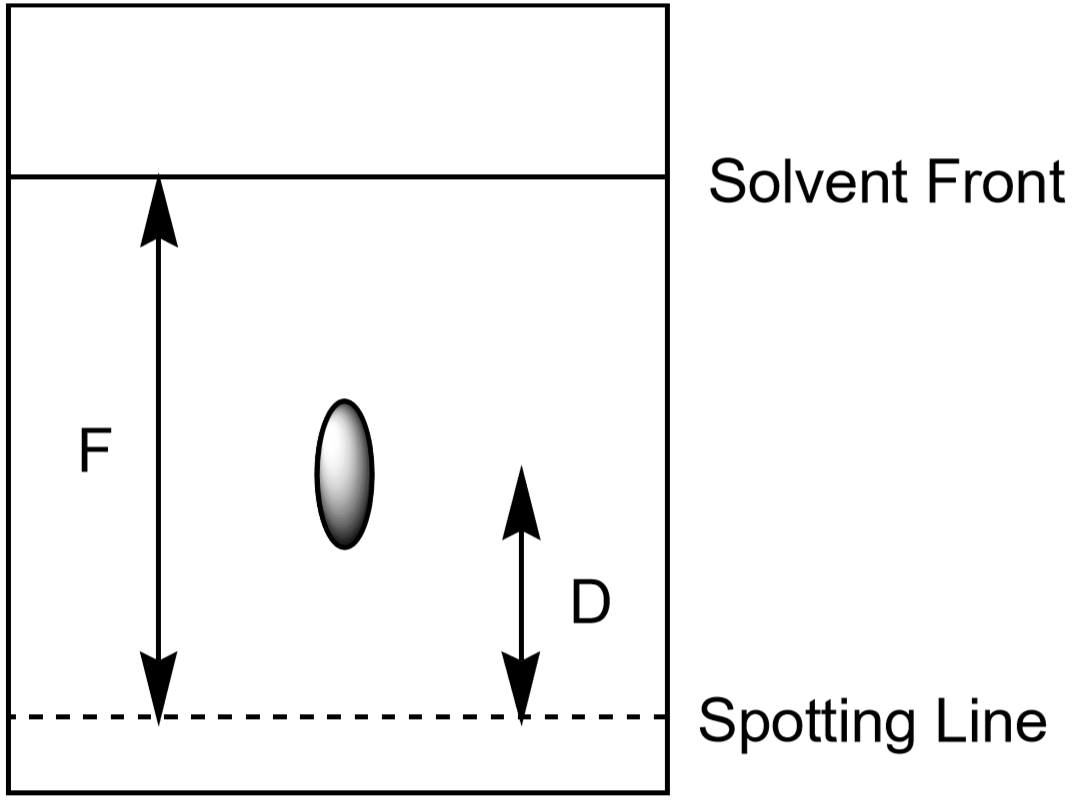
Figure 5: Mesure des distances utilisées dans le calcul de Rf pour un spot.
- Dans la voie contenant le mélange, recherchez chaque ion et enregistrez la distance parcourue par chaque ion. Calculez le Rf pour chaque ion dans cette voie. Les valeurs doivent correspondre étroitement à celles observées dans les knowns à un seul ion.
- Dans la voie contenant les inconnues, localisez le centre de chaque point observé et enregistrez sa distance et calculez les valeurs Rf. Utilisez la voie qui a les endroits les plus clairs. Les valeurs de couleur et de rf pour les taches inconnues doivent correspondre étroitement à certains des ions connus. Vous devriez maintenant être en mesure d’identifier quels ions se trouvent dans votre inconnu. Enregistrez vos données dans le tableau correspondant.
- Faites un croquis de votre chromatogramme dans l’espace prévu sur votre formulaire de rapport de laboratoire, en vous assurant d’indiquer la position et la taille et la forme approximatives de chaque tache sur le papier. Jetez le papier dans le conteneur à déchets désigné.
Nettoyage
Placez le papier de chromatographie et les gants usagés dans le conteneur à déchets fourni. La solution d’élution utilisée aurait déjà dû être placée dans un autre conteneur à déchets. Notez que deux conteneurs à déchets différents sont prévus pour cette expérience, alors assurez-vous de lire les étiquettes afin d’utiliser la bonne! Assurez-vous de bien vous laver les mains avant de quitter le laboratoire.
Affectation pré-laboratoire: Chromatographie sur papier
- Un mélange à deux composants est analysé par chromatographie sur papier. Le composant A est plus soluble dans la phase mobile que le composant B. Le résultat suivant est obtenu. Calculez le Rf pour chaque composant et étiquetez l’identité de chaque spot.
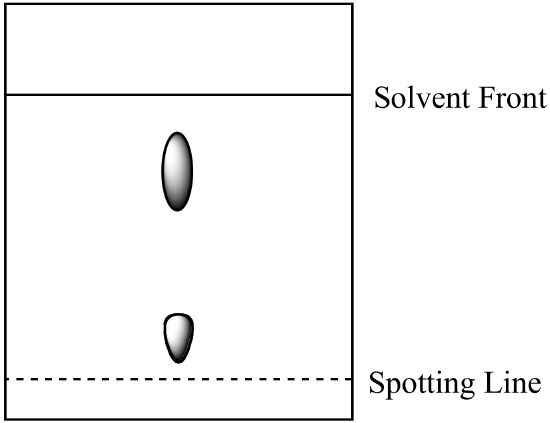
- Le mélange de la question 1 (ci-dessus) est analysé par chromatographie sur colonne en utilisant la même phase mobile et une phase stationnaire de gel de silice. Quel composant a le temps de rétention le plus court? Expliquez votre réponse. (Supposons que le même type de forces de liaison entre les composants et la phase stationnaire soit présent à la fois en chromatographie sur papier et en chromatographie sur colonne.)
- Un échantillon liquide inconnu est analysé par chromatographie sur papier en utilisant le solvant X comme phase mobile. Une tache est observée après le développement et la visualisation de la plaque. La même substance inconnue est réanalysée en utilisant le solvant Y comme phase mobile. Cette fois, trois taches sont observées après le développement et la visualisation de la plaque.
- L’échantillon inconnu est-il une substance pure ou un mélange? Expliquez votre réponse, y compris une raison possible pour les différentes observations dans les deux expériences.
Lab Report for Paper Chromatography
Data, Observations, Calculations and Analysis Known Ions
Known Ions
|
Ion |
Spot Color (Stained) |
D (Single- Ion) |
F (Single- Ion) |
Rf |
D (Ion Mixt.) |
F(Ion mixte.) |
Rf |
|---|---|---|---|---|---|---|---|
|
\(\ce{Ag^{+}}\) |
|||||||
|
\(\ce{Co^{2+}}\) |
|||||||
|
\(\ce{Cu^{2+}}\) |
|||||||
|
\(\ce{Fe^{3+}}\) |
|||||||
|
\(\ce{Hg^{2+}}\) |
Unknown ID Code _________________
Unknowns
|
Spot Number (from lowest Rr) |
Spot Color (Stained) |
D (Unknown) |
F (Unknown) |
Rf |
Identity of Spot |
|---|---|---|---|---|---|
- Sketch of Chromatogram:
Summary:
| Code d’identification inconnu | Ions identifiés |
|---|---|
Questions et conclusions
- Quels critères ont été utilisés pour identifier le ou les ions trouvés dans votre inconnu? Expliquez votre réponse en au moins trois phrases. Inclure toute difficulté à identifier les ions.
- Si vous laissez l’expérience se dérouler pendant seulement 30 minutes, quel serait le résultat probable? L’identification de l’inconnu poserait-elle des problèmes ?
- Si les taches \(\ce{Co^{2+}}\) et \(\ce{Cu^{2+}}\) étaient de la même couleur, l’identification d’un inconnu serait-elle plus difficile? Expliquez votre réponse.