Vidéo \(\PageIndex{1}\): Une brève introduction au génie de Mendeleïev.
Comme les premiers chimistes ont travaillé pour purifier les minerais et découvert plus d’éléments, ils ont réalisé que divers éléments pouvaient être regroupés par leurs comportements chimiques similaires. Un de ces groupes comprend le lithium (Li), le sodium (Na) et le potassium (K): Ces éléments sont tous brillants, conduisent bien la chaleur et l’électricité et ont des propriétés chimiques similaires. Un deuxième groupe comprend le calcium (Ca), le strontium (Sr) et le baryum (Ba), qui sont également brillants, de bons conducteurs de chaleur et d’électricité, et ont des propriétés chimiques en commun. Cependant, les propriétés spécifiques de ces deux groupements sont notamment différentes l’une de l’autre. Par exemple : Li, Na et K sont beaucoup plus réactifs que Ca, Sr et Ba; Li, Na et K forment des composés avec de l’oxygène dans un rapport de deux de leurs atomes à un atome d’oxygène, tandis que Ca, Sr et Ba forment des composés avec un de leurs atomes à un atome d’oxygène. Le fluor (F), le chlore (Cl), le brome (Br) et l’iode (I) présentent également des propriétés similaires, mais ces propriétés sont radicalement différentes de celles de l’un des éléments ci-dessus.
Dimitri Mendeleev en Russie (1869) et Lothar Meyer en Allemagne (1870) ont reconnu indépendamment qu’il existait une relation périodique entre les propriétés des éléments connus à cette époque. Les deux tableaux publiés avec les éléments disposés en fonction de la masse atomique croissante. Mais Mendeleïev est allé plus loin que Meyer: Il a utilisé sa table pour prédire l’existence d’éléments qui auraient des propriétés similaires à l’aluminium et au silicium, mais qui étaient encore inconnus. Les découvertes du gallium (1875) et du germanium (1886) ont apporté un grand soutien aux travaux de Mendeleïev. Bien que Mendeleïev et Meyer aient eu un long différend sur la priorité, les contributions de Mendeleïev au développement du tableau périodique sont maintenant plus largement reconnues (Figure \(\PageIndex{1}\)).
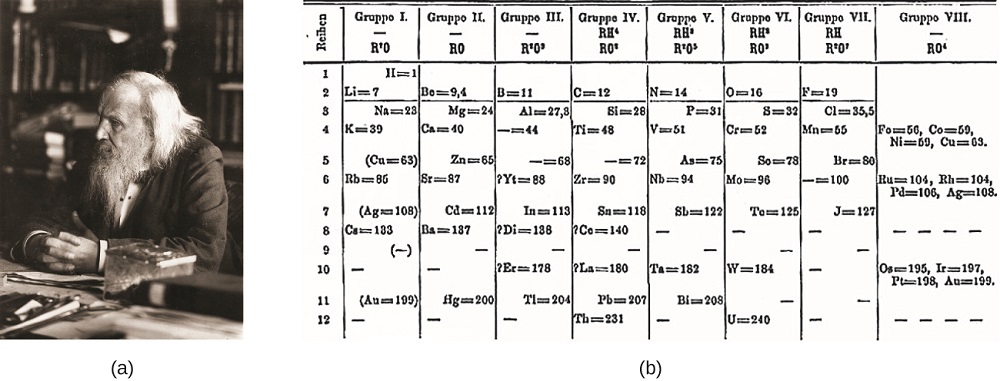
Figure\(\PageIndex{1}\): (a) Dimitri Mendeleïev est largement crédité de la création (b) du premier tableau périodique des éléments. (crédit a : modification du travail de Serge Lachinov; crédit b : modification du travail de « Den fjättrade ankan”/Wikimedia Commons)
Video\(\PageIndex{2}\): Introduction à l’organisation du tableau périodique en périodes et groupes. Cette organisation sera importante alors que nous continuerons à nous appuyer sur les principes de la chimie.
Au XXe siècle, il est devenu évident que la relation périodique impliquait des numéros atomiques plutôt que des masses atomiques. L’énoncé moderne de cette relation, la loi périodique, est le suivant: les propriétés des éléments sont des fonctions périodiques de leurs numéros atomiques. Un tableau périodique moderne organise les éléments dans l’ordre croissant de leurs numéros atomiques et regroupe des atomes ayant des propriétés similaires dans la même colonne verticale (Figure \(\PageIndex{2}\)). Chaque boîte représente un élément et contient son numéro atomique, son symbole, sa masse atomique moyenne et (parfois) son nom. Les éléments sont disposés en sept rangées horizontales, appelées périodes ou séries, et 18 colonnes verticales, appelées groupes. Les groupes sont étiquetés en haut de chaque colonne. Aux États-Unis, les étiquettes étaient traditionnellement des chiffres avec des majuscules. Cependant, l’UICPA recommande d’utiliser les numéros 1 à 18, et ces étiquettes sont plus courantes. Pour que le tableau tienne sur une seule page, des parties de deux des lignes, soit un total de 14 colonnes, sont généralement écrites sous le corps principal du tableau.

Figure\(\PageIndex{2}\): Les éléments du tableau périodique sont organisés en fonction de leurs propriétés.
De nombreux éléments diffèrent considérablement dans leurs propriétés chimiques et physiques, mais certains éléments sont similaires dans leurs comportements. Par exemple, de nombreux éléments apparaissent brillants, sont malléables (capables de se déformer sans se casser) et ductiles (peuvent être entraînés dans des fils) et conduisent bien la chaleur et l’électricité. D’autres éléments ne sont pas brillants, malléables ou ductiles et sont de mauvais conducteurs de chaleur et d’électricité. Nous pouvons trier les éléments en grandes classes avec des propriétés communes: métaux (éléments brillants, malléables, bons conducteurs de chaleur et d’électricité – jaune ombré); non métalliques (éléments qui semblent ternes, mauvais conducteurs de chaleur et d’électricité – vert ombré); et les métalloïdes (éléments qui conduisent modérément bien la chaleur et l’électricité, et possèdent certaines propriétés des métaux et certaines propriétés des non—métaux – violet ombré).
Les éléments peuvent également être classés dans les éléments du groupe principal (ou éléments représentatifs) dans les colonnes étiquetées 1, 2 et 13-18; les métaux de transition dans les colonnes étiquetées 3-12; et les métaux de transition internes dans les deux lignes en bas du tableau (les éléments de la rangée du haut sont appelés lanthanides et les éléments de la rangée du bas sont des actinides; Figure \(\PageIndex{3}\)). Les éléments peuvent être subdivisés par des propriétés plus spécifiques, telles que la composition des composés qu’ils forment. Par exemple, les éléments du groupe 1 (la première colonne) forment des composés constitués d’un atome de l’élément et d’un atome d’hydrogène. Ces éléments (sauf l’hydrogène) sont connus sous le nom de métaux alcalins, et ils ont tous des propriétés chimiques similaires. Les éléments du groupe 2 (la deuxième colonne) forment des composés constitués d’un atome de l’élément et de deux atomes d’hydrogène: Ceux-ci sont appelés métaux alcalino-terreux, avec des propriétés similaires parmi les membres de ce groupe. D’autres groupes avec des noms spécifiques sont les pnictogènes (groupe 15), les chalcogènes (groupe 16), les halogènes (groupe 17) et les gaz nobles (groupe 18, également appelés gaz inertes). Les groupes peuvent également être désignés par le premier élément du groupe: Par exemple, les chalcogènes peuvent être appelés groupe d’oxygène ou famille d’oxygène. L’hydrogène est un élément non métallique unique aux propriétés similaires aux éléments du groupe 1 et du groupe 17. Pour cette raison, l’hydrogène peut être représenté en tête des deux groupes, ou seul.
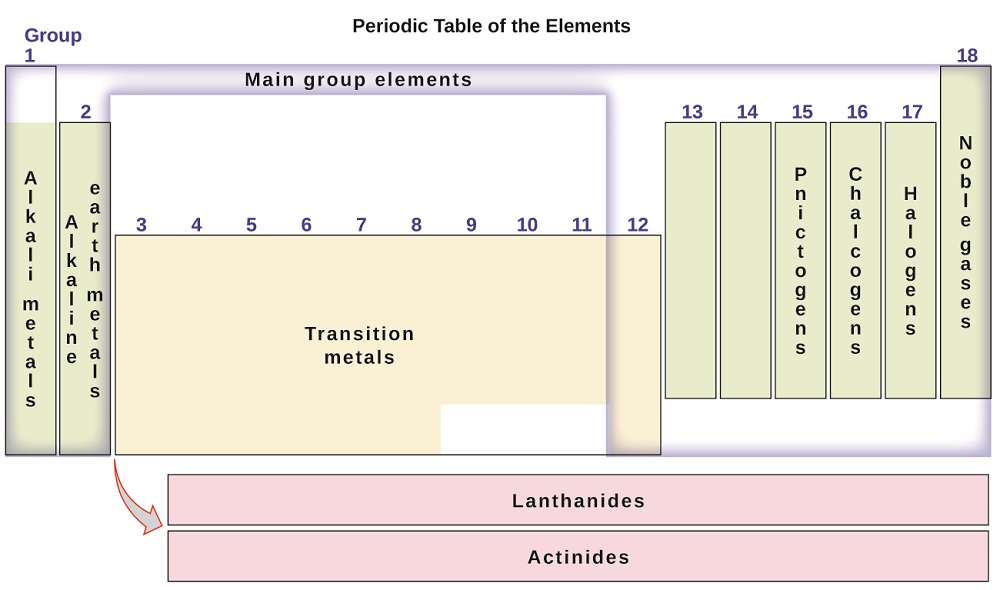
Figure\(\PageIndex{3}\): Le tableau périodique organise les éléments ayant des propriétés similaires en groupes.
Exemple \(\PageIndex{1}\): Nommer des groupes d’éléments
Les atomes de chacun des éléments suivants sont essentiels à la vie. Donnez le nom du groupe pour les éléments suivants:
- chlorine
- calcium
- sodium
- sulfur
Solution
The family names are as follows:
- halogen
- alkaline earth metal
- alkali metal
- chalcogen
Exercise \(\PageIndex{1}\)
Give the group name for each of the following elements:
- krypton
- sélénium
- baryum
- lithium
Réponse a
gaz noble
Réponse b
chalcogène
Réponse c
métal alcalino-terreux
Réponse d
métal alcalin
En étudiant le tableau périodique, vous avez peut-être remarqué quelque chose à propos des masses atomiques de certains éléments. L’élément 43 (technétium), l’élément 61 (prométhium) et la plupart des éléments de numéro atomique 84 (polonium) et plus ont leur masse atomique indiquée entre crochets. Ceci est fait pour les éléments entièrement constitués d’isotopes radioactifs instables (vous en apprendrez plus sur la radioactivité dans le chapitre chimie nucléaire). Un poids atomique moyen ne peut pas être déterminé pour ces éléments car leurs radioisotopes peuvent varier considérablement en abondance relative, selon la source, ou peuvent même ne pas exister dans la nature. Le nombre entre crochets est le nombre de masse atomique (et la masse atomique approximative) de l’isotope le plus stable de cet élément.
Résumé
Video\(\PageIndex{3}\): Un résumé de la découverte et des propriétés du tableau périodique.
La découverte de la récurrence périodique de propriétés similaires parmi les éléments a conduit à la formulation du tableau périodique, dans lequel les éléments sont disposés par ordre de nombre atomique croissant en lignes appelées périodes et colonnes appelées groupes. Les éléments du même groupe du tableau périodique ont des propriétés chimiques similaires. Les éléments peuvent être classés en tant que métaux, métalloïdes et non métalliques, ou en tant qu’éléments du groupe principal, métaux de transition et métaux de transition internes. Les groupes sont numérotés de 1 à 18 de gauche à droite. Les éléments du groupe 1 sont appelés métaux alcalins; ceux du groupe 2 sont les métaux alcalino-terreux; ceux du groupe 15 sont les pnictogènes; ceux du groupe 16 sont les chalcogènes; ceux du groupe 17 sont les halogènes; et ceux du groupe 18 sont les gaz nobles.