Objectifs d’apprentissage
À la fin de cette section, vous pourrez:
- Expliquer les relations entre les grandeurs microscopiques et macroscopiques dans un gaz
- Résoudre des problèmes impliquant des mélanges de gaz
- Résoudre des problèmes impliquant la distance et le temps entre les collisions d’une molécule de gaz
Nous avons examiné la pression et la température en fonction de leurs définitions macroscopiques. La pression est la force divisée par la zone sur laquelle la force est exercée et la température est mesurée avec un thermomètre. Nous pouvons mieux comprendre la pression et la température grâce à la théorie cinétique des gaz, la théorie qui relie les propriétés macroscopiques des gaz au mouvement des molécules qui les composent. Premièrement, nous formulons deux hypothèses sur les molécules d’un gaz idéal.
- Il existe un très grand nombre N de molécules, toutes identiques et ayant chacune une masse m.
- Les molécules obéissent aux lois de Newton et sont en mouvement continu, qui est aléatoire et isotrope, c’est-à-dire le même dans toutes les directions.
Pour dériver la loi du gaz idéal et la connexion entre des grandeurs microscopiques telles que l’énergie d’une molécule typique et des grandeurs macroscopiques telles que la température, nous analysons un échantillon d’un gaz idéal dans un récipient rigide, sur lequel nous faisons deux autres hypothèses:
- Les molécules sont beaucoup plus petites que la distance moyenne entre elles, de sorte que leur volume total est bien inférieur à celui de leur récipient (qui a un volume V). En d’autres termes, on prend la constante de Van der Waals b, le volume d’une mole de molécules de gaz, pour être négligeable par rapport au volume d’une mole de gaz dans le récipient.
- Les molécules font des collisions parfaitement élastiques avec les parois du récipient et les unes avec les autres. D’autres forces sur eux, y compris la gravité et les attractions représentées par la constante de Van der Waals a, sont négligeables (comme cela est nécessaire pour l’hypothèse de l’isotropie).
Les collisions entre molécules n’apparaissent pas dans la dérivation de la loi du gaz idéal. Ils ne perturbent pas non plus la dérivation, car les collisions entre molécules se déplaçant avec des vitesses aléatoires donnent de nouvelles vitesses aléatoires. De plus, si les vitesses des molécules de gaz dans un récipient ne sont initialement pas aléatoires et isotropes, ce sont les collisions moléculaires qui les rendent aléatoires et isotropes.
Nous faisons encore d’autres hypothèses qui simplifient les calculs mais n’affectent pas le résultat. Tout d’abord, nous laissons le conteneur être une boîte rectangulaire. Deuxièmement, nous commençons par considérer les gaz monatomiques, ceux dont les molécules sont constituées d’atomes simples, tels que l’hélium. Ensuite, nous pouvons supposer que les atomes n’ont pas d’énergie sauf leur énergie cinétique de translation; par exemple, ils n’ont ni énergie de rotation ni énergie vibratoire. (Plus tard, nous discuterons de la validité de cette hypothèse pour les gaz monatomiques réels et nous en dispenserons pour considérer les gaz diatomiques et polyatomiques.)
La figure \(\PageIndex{1}\) montre une collision d’une molécule de gaz avec la paroi d’un récipient, de sorte qu’elle exerce une force sur la paroi (par la troisième loi de Newton). Ces collisions sont la source de pression dans un gaz. À mesure que le nombre de molécules augmente, le nombre de collisions, et donc la pression, augmente. De même, si la vitesse moyenne des molécules est plus élevée, la pression du gaz est plus élevée.
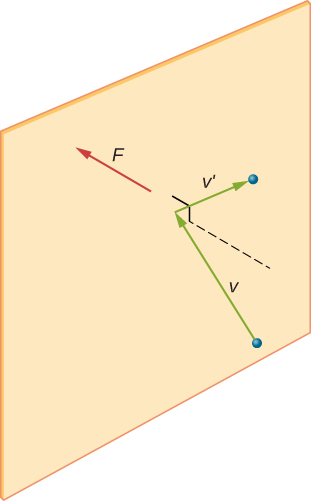
Dans un échantillon de gaz dans un récipient, le caractère aléatoire du mouvement moléculaire fait fluctuer le nombre de collisions de molécules avec n’importe quelle partie de la paroi dans un temps donné. Cependant, comme un grand nombre de molécules entrent en collision avec la paroi en peu de temps, le nombre de collisions sur les échelles de temps et d’espace que nous mesurons ne fluctue que d’une fraction infime, généralement non observable, de la moyenne. Nous pouvons comparer cette situation à celle d’un casino, où les résultats des paris sont aléatoires et les gains du casino fluctuent à la minute et à l’heure. Cependant, sur de longues périodes comme une année, les recettes du casino sont très proches des moyennes attendues des cotes. Un réservoir de gaz contient énormément plus de molécules qu’un casino n’a de parieurs en un an, et les molécules font énormément plus de collisions en une seconde qu’un casino n’a de paris.
Un calcul de la force moyenne exercée par les molécules sur les parois de la boîte nous conduit à la loi du gaz idéal et à la connexion entre température et énergie cinétique moléculaire. (En fait, nous prendrons deux moyennes: une au fil du temps pour obtenir la force moyenne exercée par une molécule avec une vitesse donnée, puis une autre moyenne sur des molécules avec des vitesses différentes.) Cette approche a été développée par Daniel Bernoulli (1700-1782), qui est surtout connu en physique pour ses travaux sur l’écoulement des fluides (hydrodynamique). Remarquablement, Bernoulli a fait ce travail avant que Dalton n’établisse la vision de la matière comme constituée d’atomes.
La figure \(\PageIndex{2}\) montre un récipient rempli de gaz et une vue élargie d’une collision élastique d’une molécule de gaz avec une paroi du récipient, décomposée en composants. Nous avons supposé qu’une molécule est petite par rapport à la séparation des molécules dans le gaz, et que son interaction avec d’autres molécules peut être ignorée. Dans ces conditions, la loi du gaz idéal est expérimentalement valable. Parce que nous avons également supposé que le mur est rigide et que les particules sont des points, la collision est élastique (par conservation de l’énergie — il n’y a nulle part où l’énergie cinétique d’une particule peut aller). Par conséquent, l’énergie cinétique de la molécule reste constante, et par conséquent, sa vitesse et l’ampleur de son élan restent également constantes. Cette hypothèse n’est pas toujours valable, mais les résultats du reste de ce module sont également obtenus dans des modèles qui permettent aux molécules d’échanger de l’énergie et de l’élan avec la paroi.
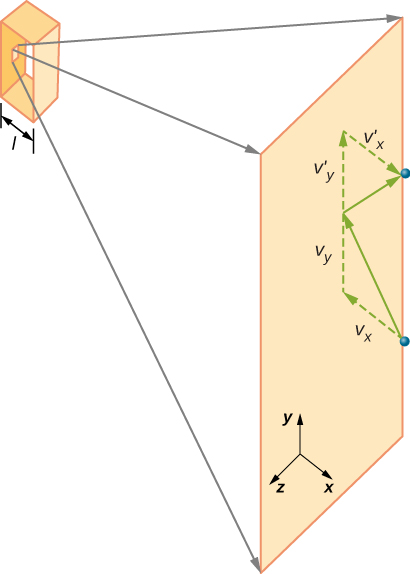
Si la vitesse de la molécule change dans la direction x, son élan passe de \(-m_x\) à \(+mv_x\). Ainsi, son changement d’élan est \(\Delta mv = + mv_x-(-mv_x) = 2mv_x\). Selon le théorème impulsion-élan donné dans le chapitre sur l’élan linéaire et les collisions, la force exercée sur la i molécule, où i marque les molécules de 1 à N, est donnée par \
(Dans cette équation seule, p représente l’élan, pas la pression.) Il n’y a pas de force entre la paroi et la molécule sauf lorsque la molécule touche la paroi. Pendant la courte période de la collision, la force entre la molécule et la paroi est relativement importante, mais ce n’est pas la force que nous recherchons. Nous recherchons la force moyenne, nous prenons donc \(\Delta t\) pour être le temps moyen entre les collisions de la molécule donnée avec cette paroi, qui est le temps pendant lequel nous nous attendons à trouver une collision. Soit l la longueur de la boîte dans la direction x. Alors \(\Delta t\) est le temps que mettrait la molécule pour traverser la boîte et revenir, une distance de 2l, à une vitesse de \(v_x\). Ainsi \(\delta t = 2l/v_x\), et l’expression de la force devient
\
Cette force est due à une molécule. Pour trouver la force totale sur le mur, F, nous devons ajouter les contributions de toutes les molécules N:
\
Nous utilisons maintenant la définition de la moyenne, que nous désignons par une barre, pour trouver la force:
\
Nous voulons la force en termes de vitesse v, plutôt que la composante x de la vitesse. Notez que la vitesse totale au carré est la somme des carrés de ses composantes, de sorte que
\
Avec l’hypothèse de l’isotropie, les trois moyennes du côté droit sont égales, donc
\
En remplaçant cela dans l’expression de F donne
\
La pression est F /A, donc nous obtenons
\ où nous avons utilisé \(V=Al\) pour le volume. Cela donne le résultat important
\
La combinaison de cette équation avec \(pV= Nk_BT\) donne
\
Nous pouvons obtenir l’énergie cinétique moyenne d’une molécule, \(\frac{1}{2}m\overline{v}^2\), du côté gauche de l’équation en divisant N et en multipliant par 3/2.
Énergie cinétique moyenne par molécule
L’énergie cinétique moyenne d’une molécule est directement proportionnelle à sa température absolue :
\
L’équation \(\overline{K} = \frac{3}{2}k_BT\) est l’énergie cinétique moyenne par molécule. Notez en particulier que rien dans cette équation ne dépend de la masse moléculaire (ou de toute autre propriété) du gaz, de la pression, ou autre chose que la température. Si des échantillons d’hélium et de gaz xénon, de masses moléculaires très différentes, sont à la même température, les molécules ont la même énergie cinétique moyenne.
L’énergie interne d’un système thermodynamique est la somme des énergies mécaniques de toutes les molécules qu’il contient. Nous pouvons maintenant donner une équation pour l’énergie interne d’un gaz idéal monatomique. Dans un tel gaz, la seule énergie des molécules est leur énergie cinétique de translation. Par conséquent, en désignant l’énergie interne par \(E_{int}\), nous avons simplement \(E_{int} = N\overline{K}\), ou
\
Souvent, nous aimerions utiliser cette équation en termes de moles:
\
Nous pouvons résoudre \(\overline{K} = \frac{1}{2}m\overline{v}^2 = \frac{3}{2}k_BT \) pour une vitesse typique d’une molécule dans un gaz idéal en termes de température afin de déterminer ce que l’on appelle la vitesse quadratique moyenne (rms) d’une molécule.
Vitesse RMS d’une molécule
La vitesse quadratique moyenne (rms) d’une molécule, ou la racine carrée de la moyenne du carré de la vitesse \(\overline{v}^2\), est
\
La vitesse rms n’est pas la vitesse moyenne ou la plus probable des molécules, comme nous le verrons dans la Distribution des vitesses moléculaires, mais elle fournit une estimation facile de la vitesse des molécules qui est liés à leur énergie cinétique. Encore une fois, nous pouvons écrire cette équation en termes de constante de gaz R et de masse molaire M en kg / mol:
\
Nous nous éloignons un instant pour répondre à une question qui vous est peut-être venue à l’esprit: Lorsque nous appliquons le modèle à des atomes au lieu de particules ponctuelles théoriques, l’énergie cinétique de rotation modifie-t-elle nos résultats? Pour répondre à cette question, nous devons faire appel à la mécanique quantique. En mécanique quantique, l’énergie cinétique de rotation ne peut prendre n’importe quelle valeur; elle est limitée à un ensemble discret de valeurs, et la plus petite valeur est inversement proportionnelle à l’inertie de rotation. L’inertie rotationnelle d’un atome est minuscule car presque toute sa masse est dans le noyau, qui a généralement un rayon inférieur à \(10^{-14} m\). Ainsi, l’énergie de rotation minimale d’un atome est beaucoup plus que \(\frac{1}{2} k_BT \) pour toute température atteignable, et l’énergie disponible n’est pas suffisante pour faire tourner un atome. Nous reviendrons sur ce point lors de la discussion des gaz diatomiques et polyatomiques dans la section suivante.
Exemple \(\PageIndex{1}\): Calcul de l’Énergie Cinétique et de la Vitesse d’une molécule de gaz
- Quelle est l’énergie cinétique moyenne d’une molécule de gaz à \(20,0^oC\) (température ambiante)?
- Trouvez la vitesse efficace d’une molécule d’azote (\(N_2\)) à cette température.
Stratégie
(a) Le connu dans l’équation pour l’énergie cinétique moyenne est la température:
\
Avant de substituer des valeurs dans cette équation, nous devons convertir la température donnée en kelvin: \(T =(20.0 + 273)\, K = 293\, K\). Nous pouvons trouver la vitesse efficace d’une molécule d’azote en utilisant l’équation
\
mais nous devons d’abord trouver la masse d’une molécule d’azote. En obtenant la masse molaire d’azote \(N_2\) à partir du tableau périodique, on trouve
\
Solution
- La température seule nous suffit pour trouver l’énergie cinétique de translation moyenne. La substitution de la température dans l’équation d’énergie cinétique de translation donne \
- La substitution de cette masse et de la valeur de \(k_B\) dans l’équation de \(v_{rms}\) donne \
Signification
Notez que l’énergie cinétique moyenne de la molécule est indépendante du type de molécule. L’énergie cinétique de translation moyenne ne dépend que de la température absolue. L’énergie cinétique est très faible par rapport aux énergies macroscopiques, de sorte que nous ne ressentons pas quand une molécule d’air frappe notre peau. D’autre part, elle est beaucoup plus grande que la différence typique d’énergie potentielle gravitationnelle lorsqu’une molécule se déplace, disons, du haut vers le bas d’une pièce, de sorte que notre négligence de la gravitation est justifiée dans des situations réelles typiques. La vitesse efficace de la molécule d’azote est étonnamment grande. Ces grandes vitesses moléculaires ne donnent pas de mouvement macroscopique de l’air, car les molécules se déplacent dans toutes les directions avec une probabilité égale. Le libre chemin moyen (la distance qu’une molécule se déplace en moyenne entre les collisions, discuté un peu plus loin dans cette section) des molécules dans l’air est très faible, de sorte que les molécules se déplacent rapidement mais ne vont pas très loin en une seconde. La valeur élevée de la vitesse efficace se reflète dans la vitesse du son, qui est d’environ 340 m / s à température ambiante. Plus la vitesse efficace des molécules d’air est élevée, plus les vibrations sonores peuvent être transférées rapidement dans l’air. La vitesse du son augmente avec la température et est plus grande dans les gaz de petites masses moléculaires, tels que l’hélium (voir Figure \(\PageIndex{3}\)).
Exemple \(\PageIndex{2}\): Calcul de la Température : Vitesse d’échappement des atomes d’hélium
Pour échapper à la gravité terrestre, un objet proche du sommet de l’atmosphère (à une altitude de 100 km) doit s’éloigner de la Terre à 11,1 km/s. Cette vitesse est appelée vitesse d’échappement. À quelle température les atomes d’hélium auraient-ils une vitesse efficace égale à la vitesse d’échappement?
Stratégie
Identifiez les connaissances et les inconnues et déterminez les équations à utiliser pour résoudre le problème.
Solution
- Identifier les knowns: v est la vitesse d’échappement, 11,1 km / s.
- Identifier les inconnues: Nous devons résoudre pour la température, T. Nous devons également résoudre pour la masse m de l’atome d’hélium.
- Déterminez quelles équations sont nécessaires.
- Pour obtenir la masse m de l’atome d’hélium, nous pouvons utiliser les informations du tableau périodique: \
- Pour résoudre pour la température T, nous pouvons réorganiser \ pour donner \
- Substituer les valeurs connues dans les équations et résoudre pour les inconnues, \ et \
Signification
Cette température est beaucoup plus élevée que la température atmosphérique, qui est d’environ 250 K (\(-25^oC\) ou \(-10^dE\)) à haute altitude. Il reste très peu d’atomes d’hélium dans l’atmosphère, mais beaucoup étaient présents lors de la formation de l’atmosphère, et d’autres sont toujours créés par la désintégration radioactive (voir le chapitre sur la physique nucléaire). La raison de la perte d’atomes d’hélium est qu’un petit nombre d’atomes d’hélium ont des vitesses supérieures à la vitesse d’échappement de la Terre, même à des températures normales. La vitesse d’un atome d’hélium change d’une collision à l’autre, de sorte qu’à tout instant, il y a une chance faible mais non nulle que la vitesse de l’atome soit supérieure à la vitesse d’échappement. Il est assez probable qu’au cours de la vie de la Terre, presque tous les atomes d’hélium qui se sont trouvés dans l’atmosphère aient atteint une vitesse d’échappement à haute altitude et se soient échappés de l’attraction gravitationnelle de la Terre. Les molécules plus lourdes, telles que l’oxygène, l’azote et l’eau, ont des vitesses efficaces plus petites, et il est donc beaucoup moins probable que l’une d’elles ait des vitesses supérieures à la vitesse d’échappement. En fait, la probabilité est si faible que des milliards d’années sont nécessaires pour perdre des quantités importantes de molécules plus lourdes de l’atmosphère. La figure \(\PageIndex{4}\) montre l’effet d’une absence d’atmosphère sur la Lune. Parce que l’attraction gravitationnelle de la Lune est beaucoup plus faible, elle a perdu presque toute son atmosphère. Les atmosphères de la Terre et d’autres corps sont comparées dans les exercices de ce chapitre.

Exercice \(\PageIndex{2}\)
Si vous considérez un très petit objet, tel qu’un grain de pollen, dans un gaz, le nombre de molécules frappant sa surface serait également relativement faible. Vous attendez-vous à ce que le grain de pollen subisse des fluctuations de pression dues aux fluctuations statistiques du nombre de molécules de gaz qui le frappent dans un laps de temps donné?
Réponse
Oui. De telles fluctuations se produisent en fait pour un corps de n’importe quelle taille dans un gaz, mais comme le nombre de molécules est immense pour les corps macroscopiques, les fluctuations représentent un pourcentage infime du nombre de collisions, et les moyennes mentionnées dans cette section varient imperceptiblement. Grosso modo, les fluctuations sont inversement proportionnelles à la racine carrée du nombre de collisions, de sorte que pour les petits corps, elles peuvent devenir significatives. Cela a été observé au XIXe siècle pour les grains de pollen dans l’eau et est connu sous le nom de mouvement brownien.
Pression de vapeur, Pression partielle et Loi de Dalton
La pression qu’un gaz créerait s’il occupait le volume total disponible est appelée pression partielle du gaz. Si deux gaz ou plus sont mélangés, ils arriveront à l’équilibre thermique à la suite de collisions entre molécules; le procédé est analogue à la conduction thermique comme décrit dans le chapitre sur la température et la chaleur. Comme nous l’avons vu de la théorie cinétique, lorsque les gaz ont la même température, leurs molécules ont la même énergie cinétique moyenne. Ainsi, chaque gaz obéit à la loi du gaz idéal séparément et exerce sur les parois d’un récipient la même pression qu’il le ferait s’il était seul. Par conséquent, dans un mélange de gaz, la pression totale est la somme des pressions partielles des gaz constitutifs, en supposant un comportement idéal des gaz et aucune réaction chimique entre les composants. Cette loi est connue sous le nom de loi des pressions partielles de Dalton, d’après le scientifique anglais John Dalton (1766-1844) qui l’a proposée. La loi de Dalton est cohérente avec le fait que les pressions s’ajoutent selon le principe de Pascal.
Dans un mélange de gaz idéaux en équilibre thermique, le nombre de molécules de chaque gaz est proportionnel à sa pression partielle. Ce résultat résulte de l’application de la loi des gaz idéaux à chacun sous la forme \(p/n = RT/V\). Parce que le côté droit est le même pour tout gaz à une température donnée dans un récipient d’un volume donné, le côté gauche est également le même.
- La pression partielle est la pression qu’un gaz créerait s’il existait seul.
- La loi de Dalton stipule que la pression totale est la somme des pressions partielles de tous les gaz présents.
- Pour deux gaz quelconques (marqués 1 et 2) en équilibre dans un récipient, \(\frac{p_1}{n_1} = \frac{p_2}{n_2}.\)
Une application importante de la pression partielle est que, en chimie, elle fonctionne comme la concentration d’un gaz pour déterminer la vitesse d’une réaction. Ici, nous mentionnons seulement que la pression partielle d’oxygène dans les poumons d’une personne est cruciale pour la vie et la santé. Respirer de l’air dont la pression partielle d’oxygène est inférieure à 0,16 atm peut nuire à la coordination et au jugement, en particulier chez les personnes non acclimatées à une altitude élevée. Des pressions partielles inférieures à \(O_2\) ont des effets plus graves; des pressions partielles inférieures à 0,06 atm peuvent être rapidement fatales et des dommages permanents sont probables même si la personne est secourue. Cependant, la sensation de devoir respirer, comme lorsque l’on retient sa respiration, est beaucoup plus causée par des concentrations élevées de dioxyde de carbone dans le sang que par de faibles concentrations d’oxygène. Ainsi, si une petite pièce ou un placard est rempli d’air ayant une faible concentration d’oxygène, peut-être parce qu’une bouteille de gaz comprimé qui fuit y est stockée, une personne ne ressentira aucune sensation « d’étouffement” et pourrait entrer en convulsions ou perdre conscience sans rien remarquer de mal. Les ingénieurs de sécurité accordent une attention considérable à ce danger.
Une autre application importante de la pression partielle est la pression de vapeur, qui est la pression partielle d’une vapeur à laquelle elle est en équilibre avec la phase liquide (ou solide, dans le cas de la sublimation) de la même substance. À n’importe quelle température, la pression partielle de l’eau dans l’air ne peut pas dépasser la pression de vapeur de l’eau à cette température, car chaque fois que la pression partielle atteint la pression de vapeur, l’eau se condense hors de l’air. La rosée est un exemple de cette condensation. La température à laquelle la condensation se produit pour un échantillon d’air est appelée point de rosée. Il est facilement mesuré en refroidissant lentement une bille métallique; le point de rosée est la température à laquelle la condensation apparaît pour la première fois sur la bille.
Les pressions de vapeur de l’eau à certaines températures d’intérêt pour la météorologie sont données dans le tableau \(\PageIndex{1}\).
| T(\(^oC\)) | Pression de vapeur (Pa) |
|---|---|
| 0 | 610.5 |
| 3 | 757.9 |
| 5 | 872.3 |
| 8 | 1073 |
| 10 | 1228 |
| 13 | 1497 |
| 15 | 1705 |
| 18 | 2063 |
| 20 | 2338 |
| 23 | 2809 |
| 25 | 3167 |
| 30 | 4243 |
| 35 | 5623 |
| 40 | 7376 |
The relative humidity (R.H.) à une température T est définie par
\
Une humidité relative de \(100\%\) signifie que la pression partielle de l’eau est égale à la pression de vapeur ; en d’autres termes, l’air est saturé en eau.
Exemple \(\PageIndex{3}\): Calcul de l’humidité relative
Quelle est l’humidité relative lorsque la température de l’air est \(25^oC\) et que le point de rosée est \(15^oC\)?
Stratégie
Il suffit de rechercher la pression de vapeur à la température donnée et celle au point de rosée et de trouver le rapport.
Solution
\
Signification
R.H. est important pour notre confort. La valeur de \(53,8\%\) se situe dans la plage de \(40\%\) à \(60\%\) recommandée pour le confort à l’intérieur.
Comme indiqué dans le chapitre sur la température et la chaleur, la température tombe rarement en dessous du point de rosée, car lorsqu’elle atteint le point de rosée ou le point de gel, l’eau se condense et libère une quantité relativement importante de chaleur latente de vaporisation.
Chemin Libre Moyen et Temps Libre Moyen
Nous considérons maintenant explicitement les collisions. La première étape habituelle (qui est tout ce que nous prendrons) consiste à calculer le chemin libre moyen, \(\lambda\), la distance moyenne qu’une molécule parcourt entre les collisions avec d’autres molécules, et le temps libre moyen \(\tau\), le temps moyen entre les collisions d’une molécule. Si nous supposons que toutes les molécules sont des sphères de rayon \(r\) alors une molécule entrera en collision avec une autre si leurs centres sont à une distance 2r l’un de l’autre. Pour une particule donnée, nous disons que l’aire d’un cercle de ce rayon, \(4\pi r^2\), est la « section transversale” des collisions. Au fur et à mesure que la particule se déplace, elle trace un cylindre avec cette section transversale. Le chemin libre moyen est la longueur \(\lambda\) telle que le nombre attendu d’autres molécules dans un cylindre de longueur \(\lambda\) et de section \(4\pi r ^2\) soit 1. Si nous ignorons temporairement le mouvement des molécules autres que celle que nous examinons, le nombre attendu est la densité en nombre de molécules, N / V, fois le volume, et le volume est \(4 \pi r ^2 \ lambda\), donc nous avons \((N / V) 4 \ pi r ^ 2 \lambda = 1 \), ou
\
La prise en compte du mouvement de toutes les molécules rend le calcul beaucoup plus difficile, mais le seul changement est un facteur de \(\sqrt {2} \). Le résultat est
\
Dans un gaz idéal, on peut substituer \(V/N =k_BT/p\) pour obtenir
\
Le temps libre moyen \(\tau\) est simplement le chemin libre moyen divisé par une vitesse typique, et le choix habituel est la vitesse efficace. Ensuite
\
Calcul Du Temps Libre moyen
Trouvez le temps libre moyen pour les atomes d’argon (\(M = 39,9 \, g/ mol\)) à une température de \(0^oC\) et une pression de 1,00 atm. Prenez le rayon d’un atome d’argon pour être \(1,70 \ fois 10^{-10}\ espace m\).
Solution
- Identifiez les knowns et convertissez-les en unités SI. Nous savons que la masse molaire est 0.0399 kg / mol, la température est de 273 K, la pression est \ (1,01 \ fois 10^ 5 \, Pa \) et le rayon est \ (1,70 \ fois 10^{-10} \, m \).
- Trouvez la vitesse efficace : \(v_{rms}= \sqrt{\frac{3RT}{M}} = 413\, m/s\).
- Substituer dans l’équation le temps libre moyen: \
Signification
Nous pouvons difficilement comparer ce résultat avec notre intuition sur les molécules de gaz, mais cela nous donne une image de molécules entrant en collision avec une fréquence extrêmement élevée.
Exercice \(\PageIndex{4}\)
Qui a un chemin libre moyen plus long, de l’eau liquide ou de la vapeur d’eau dans l’air?
Réponse
Dans un liquide, les molécules sont très proches les unes des autres, entrant constamment en collision les unes avec les autres. Pour qu’un gaz soit presque idéal, comme l’air l’est dans des conditions ordinaires, les molécules doivent être très éloignées les unes des autres. Par conséquent, le chemin libre moyen est beaucoup plus long dans l’air.
Contributeurs et attributions
-
Samuel J. Ling (Université d’État de Truman), Jeff Sanny (Université Loyola Marymount) et Bill Moebs avec de nombreux auteurs contributeurs. Ce travail est concédé sous licence par OpenStax University Physics sous licence Creative Commons Attribution (by 4.0).