Orbitales moléculaires d’un carbocation allylique
La stabilité du carbocation du propène est due à un système d’électrons π conjugués. Un » double lien » n’existe pas vraiment. Au lieu de cela, il s’agit d’un groupe de 3 orbitales p adjacentes, chevauchantes et non hybridées que nous appelons un système d’électrons π conjugué. Vous pouvez clairement voir les interactions entre les trois orbitales p des trois carbones, ce qui donne un cation vraiment stable. Tout se résume à l’emplacement du carbone déficient en électrons.
Les descriptions des orbitales moléculaires peuvent expliquer la stabilité allylique d’une autre manière en utilisant le 2-propényle. Figue.6
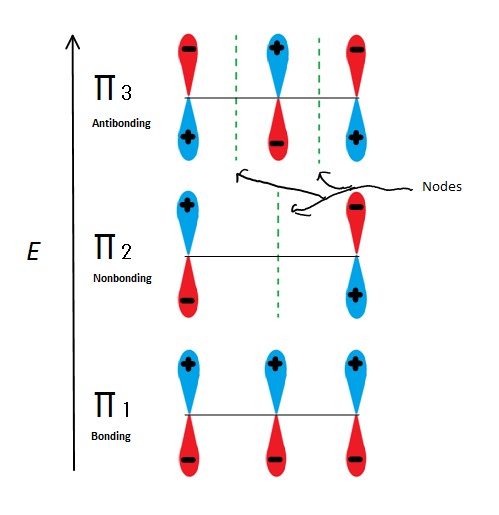
Fig.6 Montre les 3 orbitales moléculaires possibles du propényle-2
Si nous prenons simplement l’orbitale moléculaire π et non l’une des s, nous en obtenons trois. π1 est lié sans nœuds, π2 est non lié (en d’autres termes, la même énergie qu’une orbitale p régulière) avec un nœud et π3 est anti-lié avec 2 nœuds (aucune des orbitales n’interagit). Les deux premiers électrons iront dans l’orbitale moléculaire π1, qu’il s’agisse d’un cation, d’un radical ou d’un anion. S’il s’agit d’un radical ou d’un anion, l’électron suivant passe dans l’orbitale moléculaire π2. Le dernier électron anionique entre également dans l’orbitale non liée. Donc, quel que soit le type de centre de carbone existant, aucun électron n’entrera jamais dans l’orbitale anti-reliure.
Les orbitales de liaison sont les orbitales d’énergie la plus basse et sont favorables, c’est pourquoi elles sont remplies en premier. Même si les orbitales non liées peuvent être remplies, l’énergie globale du système est toujours plus faible et plus stable en raison des orbitales moléculaires de liaison remplies.
Cette figure montre également que π2 est la seule orbitale moléculaire où l’électrion diffère, et c’est également là qu’un seul nœud passe par le milieu. De ce fait, les charges de la molécule sont principalement sur les deux carbones terminaux et non sur le carbone moyen.
Cette description d’orbitale moléculaire peut également illustrer la stabilité des centres de carbone allylique de la figure 7.
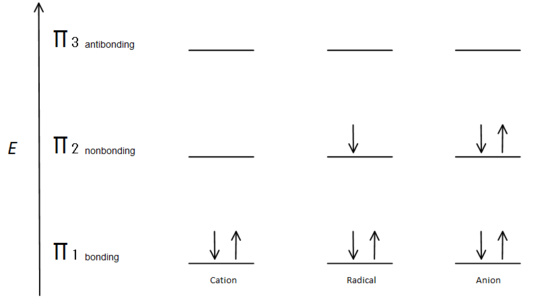
Fig.7 diagramme montrant comment les électrons se remplissent sur la base du principe d’Aufbau.
L’orbitale de liaison π est plus faible en énergie que l’orbitale p non liée. Étant donné que chaque centre de carbone représenté a deux électrons dans l’énergie inférieure, liant des orbitales π, l’énergie de chaque système est globalement abaissée (et donc plus stable), indépendamment du cation, du radical ou de l’anion.