| Taq polymerase, exonuclease | ||||||
|---|---|---|---|---|---|---|
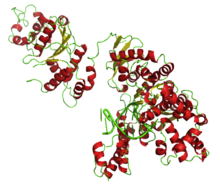 Full Taq DNA polymerase bound to a DNA octamer
|
||||||
| Identifiers | ||||||
| Symbol | Taq-exonuc | |||||
| Pfam | PF09281 | |||||
| InterPro | IPR015361 | |||||
| SCOP2 | 1qtm / SCOPe / SUPFAM | |||||
| Available protein estructuras: | Pfam | AP | PDBsum | |||
Taq PolA tiene una estructura general similar a la de E. coli PolA. El dominio de exonucleasas de 3’a 5′ intermedio responsable de la corrección de pruebas ha cambiado drásticamente y no es funcional. Tiene un dominio de exonucleasa funcional 5 ‘ -3 ‘ en el terminal amino, descrito a continuación. Los dos dominios restantes actúan en coordinación, a través del movimiento de dominios acoplados.
Dominio de exonucleaseditar
La exonucleasa de la polimerasa Taq es un dominio que se encuentra en el terminal amino de la polimerasa de ADN Taq I (termoestable). Asume un motivo tipo H de ribonucleasa. El dominio confiere actividad de exonucleasa 5 ‘ -3 ‘ a la polimerasa.
A diferencia del mismo dominio en E. coli, que degradaría los cebadores y debe eliminarse por digestión para el uso de PCR, este dominio no se dice que degrade el cebador. Esta actividad se utiliza en la sonda TaqMan: a medida que se forman las hebras hijas, las sondas complementarias a la plantilla entran en contacto con la polimerasa y se dividen en piezas fluorescentes.
La unión con DNAEdit
La polimerasa Taq se une en su hendidura del sitio activo de la polimerasa con el extremo romo del ADN dúplex. Como la polimerasa Taq está en contacto con el ADN unido, sus cadenas laterales forman enlaces de hidrógeno con las purinas y pirimidinas del ADN. La misma región de la polimerasa Taq que se ha unido al ADN también se une a la exonucleasa. Estas estructuras unidas a la polimerasa Taq tienen diferentes interacciones.
Mutanteseditar
Se ha notificado un experimento de mutagénesis dirigido al sitio que mejora la actividad de la exonucleasa vestigal 3′-5′ en un factor de 2, pero nunca se informó si hacerlo disminuye la tasa de error. Siguiendo una línea de pensamiento similar, las proteínas quimera se han fabricado mediante dominios de selección de E. coli, Taq y T. neapolitana polimerasa I. El intercambio del dominio vestigal por uno funcional de E. coli creó una proteína con capacidad de corrección de pruebas, pero una temperatura óptima más baja y baja termoestabilidad.
Se han producido versiones de la polimerasa sin el dominio exonucleasa 5′-3′, entre las que se conocen mejor Klentaq o el fragmento de Stoffel. La completa falta de actividad de exonucleasa hace que estas variantes sean adecuadas para imprimaciones que exhiben estructura secundaria, así como para copiar moléculas circulares. Otras variaciones incluyen el uso de Klentaq con una polimerasa de alta fidelidad, una termosequenasa que reconoce sustratos como la polimerasa de ADN T7, mutantes con tolerancias más altas a los inhibidores, o versiones «marcadas con un dominio» que tienen un motivo de hélice-horquilla-hélice adicional alrededor del sitio catalítico para sostener el ADN más firmemente a pesar de las condiciones adversas.

Importancia en la enfermedad detectionEdit
Debido a las mejoras de la Taq polimerasa siempre en la PCR de la replicación del ADN: mayor especificidad, menos productos inespecíficos y procesos y equipos más simples, ha sido fundamental en los esfuerzos realizados para detectar enfermedades. «El uso de la Reacción en Cadena de la Polimerasa (PCR, por sus siglas en inglés) en el diagnóstico de enfermedades infecciosas ha dado como resultado la capacidad de diagnosticar temprano y tratar adecuadamente enfermedades debidas a patógenos exigentes, determinar la susceptibilidad antimicrobiana de los organismos de crecimiento lento y determinar la magnitud de la infección.»La implementación de la polimerasa Taq ha salvado innumerables vidas. Ha desempeñado un papel esencial en la detección de muchas de las peores enfermedades del mundo, incluidas: tuberculosis, faringitis estreptocócica, neumonía atípica, SIDA, sarampión, hepatitis e infecciones urogenitales ulcerosas. La PCR, el método utilizado para recrear copias de muestras de ADN específicas, hace posible la detección de enfermedades al apuntar a una secuencia de ADN específica de un patógeno objetivo a partir de la muestra de un paciente y amplificar las trazas de las secuencias indicativas copiándolas hasta miles de millones de veces. Aunque este es el método más preciso de detección de enfermedades, especialmente para el VIH, no se realiza con tanta frecuencia como pruebas alternativas e inferiores debido al costo relativamente alto, la mano de obra y el tiempo requerido.
La dependencia de la polimerasa Taq como catalizador para el proceso de replicación de PCR se ha destacado durante la pandemia de COVID-19 de 2020. La escasez de la enzima necesaria ha mermado la capacidad de los países de todo el mundo para producir kits de prueba para el virus. Sin la polimerasa Taq, el proceso de detección de la enfermedad es mucho más lento y tedioso.
A pesar de las ventajas de usar la polimerasa Taq en la detección de enfermedades por PCR, la enzima no está exenta de sus deficiencias. Enfermedades retrovirales: VIH, HTLV-1 y HTLV-II; a menudo incluyen mutaciones de guanina a adenina en su genoma. Mutaciones como estas son las que permiten que las pruebas de PCR detecten las enfermedades, pero la tasa de fidelidad relativamente baja de la polimerasa Taq hace que se produzca la misma mutación G a A y posiblemente produzca un resultado positivo falso de la prueba.