Los compuestos Antiaromáticos Son Inusualmente Inestables
¿Cuáles son los factores clave que determinan si una molécula es antiaromática?
En nuestros posts anteriores de nuestra serie sobre aromaticidad, vimos que las moléculas aromáticas son inusualmente estables. Tienen energías de resonancia particularmente grandes, tienden a experimentar reacciones de sustitución en lugar de de adición, y tienen electrones pi deslocalizados (todas las longitudes de enlace C-C en benceno son iguales, por ejemplo).
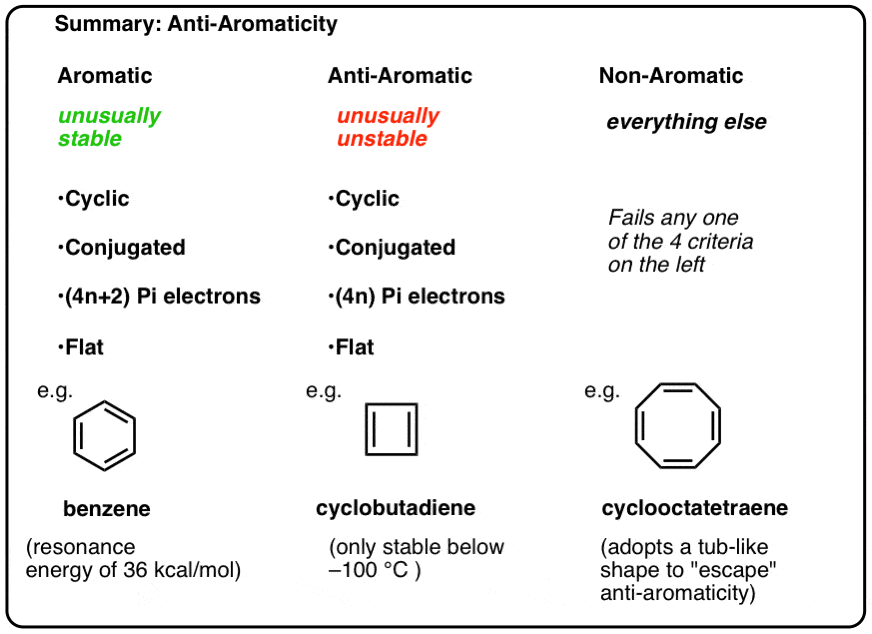
Para ser aromática, una molécula debe poseer las siguientes cuatro características estructurales:
- cíclico
- conjugado alrededor del anillo
- tener electrones pi
- plano (plano)
Si se cumplen estas cuatro condiciones, la molécula es aromática.
Si falla incluso una pregunta en la prueba, no es aromático.
Eso parece estar bastante claro. ¿O lo es?
Por la forma en que estoy formulando esta pregunta, podrías adivinar que la respuesta es «no del todo». : – )
Tabla de Contenidos
- Algunas Moléculas Son Tan Espectaculares E Inusualmente Inestables Y Difíciles De Aislar Que Merecen Su Propia Categoría:Antiaromático
- Catión de Ciclopentadienilo: El Carbocatión «Estabilizado Por Resonancia» Que No Es Estable
- Anillos Antiaromáticos De Tres Miembros: Oxireno, 1H-Azireno, Tiireno
- El Ciclobutadieno Es Antiaromático
- Un Ejemplo de 8 Electrones Pi de un Compuesto Antiaromático: Pentaleno
- ¿Qué Hace Que Una Molécula Sea Antiaromática?
- El Ciclooctatetraeno «Escapa» De la Anti-Aromaticidad A Través de La Torsión De La Planitud
- Conclusión: Compuestos Antiaromáticos
- Notas
- Avanzado: Referencias y Lecturas adicionales
1. Moléculas Espectacularmente Inestables Que Forman Una Categoría En Sí Mismas:»Anti-Aromáticas»
Aquí está la cosa. Hay un pequeño número de moléculas que pasaría la aromaticidad de la prueba, que no solo no aromáticos: tienen la propiedad de ser tan espectacular e inusualmente inestables y difíciles de aislar que merecen otro nombre.
A estas moléculas las llamamos «anti-aromáticas».
Lo interesante es que en muchos casos las moléculas en sí no parecen ser particularmente inestables desde los primeros principios, en contraste con, digamos, cubanas. Curiosamente, puedes comprar cubane (más o menos) de Aldrich, pero la mayoría de las moléculas anti-aromáticas que discutiremos a continuación solo son estables a temperaturas extremadamente bajas, ¡si es que se pueden aislar en absoluto!
2. Catión de Ciclopentadienilo: La Carbocación «Estabilizada por Resonancia» Que no es Estable
Comencemos nuestro viaje por la madriguera del conejo con un ejemplo simple que debería parecer familiar de la química orgánica del primer semestre.
¿Recuerdas la reacción SN1? ¿El gato que deja la silla cómoda primero?
revisión Rápida: Comience con un haluro de alquilo. Dejando las hojas del grupo, formando un carbocatión. Ataques nucleófilos. Se llama SN1 porque el paso determinante de la velocidad (formación de carbocatión) es unimolecular. En pocas palabras: cuanto más estable sea el carbocatión, más rápida será la reacción. Por lo tanto, la velocidad de reacción para los haluros de alquilo es terciaria > secundaria > primaria, y el carbocatión obtiene puntos de bonificación especiales si se estabiliza por resonancia.
Observe estas dos reacciones SN1. ¿Cuál crees que sucedería más rápido – la reacción SN1 que pasa por una carbocación secundaria (A), o la reacción SN1 que pasa por una carbocación secundaria y puede formar múltiples formas de resonancia (B)?
De todo lo que has aprendido hasta ahora, esperarías que la respuesta fuera B).
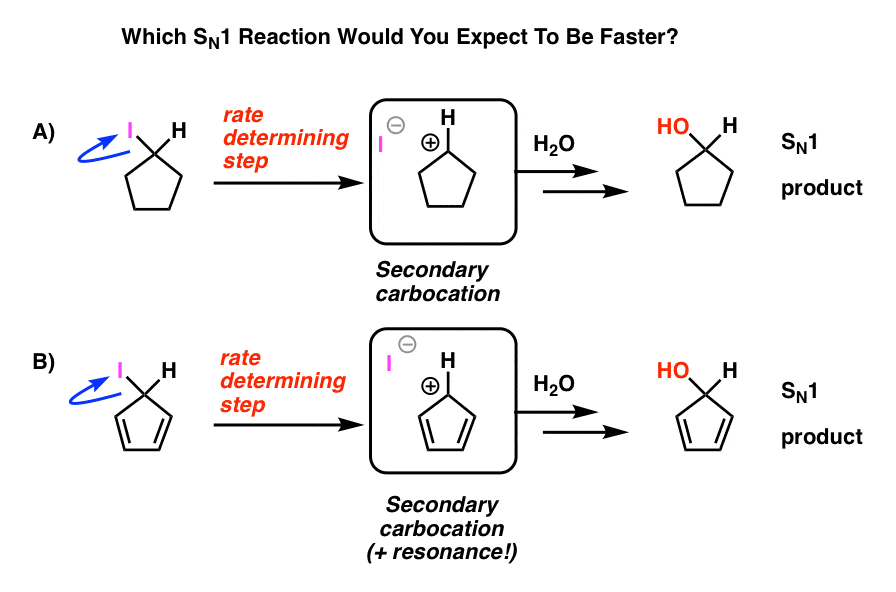
No lo es.
La respuesta es que la reacción A) ocurre más rápido. La reacción B no ocurre en absoluto.
Esto te parecerá profundamente extraño.
¡Lo es!
¿Cómo es que este supuestamente resonancia estabilizado carbocation es menos estable que un secundario carbocation?
Después de todo, ¿cuántas veces se perfora en la cabeza que la resonancia estabiliza las moléculas, especialmente las carbocaciones?
Pero aquí, parece ser desestabilizador. Ess

¡Pero es inestable! El catión ciclopentadienilo es increíblemente inestable y difícil de fabricar, y no es por falta de intentarlo. Hay algo muy extraño en la estructura del catión ciclopentadienilo que le da una inestabilidad inusual.

Cíclico, conjugado, plano…. y tiene 4 electrones pi. ¡Interesante!
3. Anillos Antiaromáticos de Tres Miembros: Oxireno, 1H-Azireno, Tiireno
Otra clase de moléculas «elusivas» es una familia de anillos de tres miembros. Puede recordar de Org 1 que es fácil hacer epóxidos a partir de alquenos usando un oxidante como el m-CPBA.
¿Alguna vez se preguntó por qué nunca cubrimos la misma reacción para alquinos?
Bueno, no es por falta de intentos. Los químicos han probado todo tipo de métodos para epoxidar alquinos, ¿y sabes qué? La reacción no funciona.
Por ejemplo, la epoxidación del acetileno daría la molécula de abajo (oxireno).
El oxireno en sí nunca se ha observado, aunque hay rastros tentadores de su existencia fugaz. Y por cierto, tampoco tiene el análogo de nitrógeno, 1H-azireno, o el tiireno.
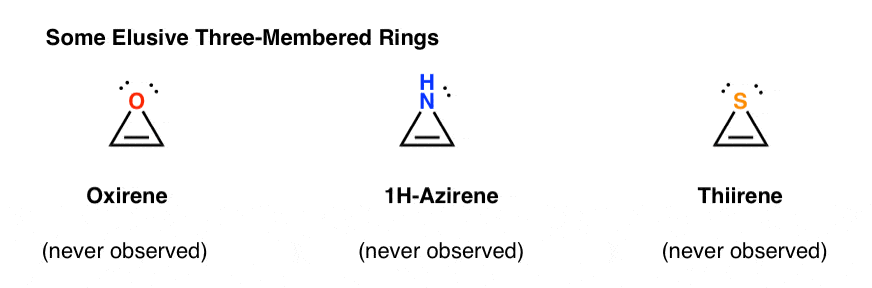
¿Por qué no? ¿Qué tiene de especial cada uno de estos casos?
Puede notar que, al igual que el catión ciclopentadienilo, estas moléculas son cíclicas, conjugadas, planas y tienen 4 electrones pi (dos en el enlace pi y dos de un par solitario).
OK. ¿Qué más podría ser cíclico, conjugado, plano y tener 4 electrones pi?
4. El ciclobutadieno es Antiaromático
El ciclobutadieno parece una molécula bastante simple, pero en realidad no se sintetizó hasta 1965. E incluso entonces, se descubrió que no es estable a temperaturas superiores a 35 Kelvin.
La pregunta es, ¿por qué?

Claro, es un anillo de cuatro miembros, y sí, tiene mucha tensión en el anillo, pero se han fabricado moléculas más tensas que en realidad son estables a temperatura ambiente.
También puede notar que, al igual que los ejemplos anteriores, el ciclobutadieno es otro ejemplo de una molécula que es cíclica, conjugada, tiene 4 electrones pi y es plana.
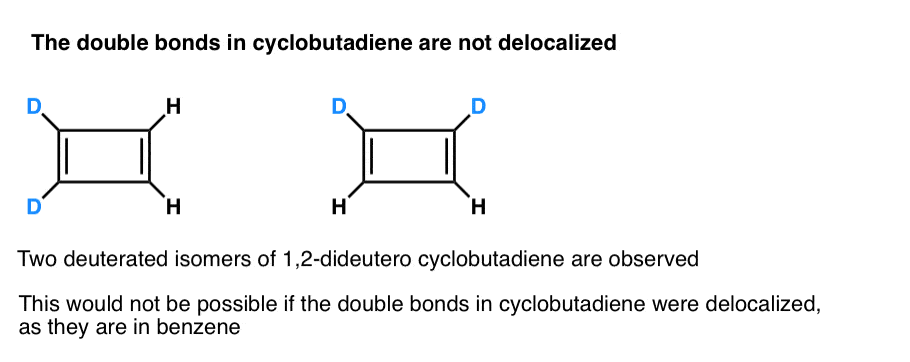
Lo que es aún más interesante es lo que se aprendió sobre la geometría del ciclobutadieno. En lugar de ser una molécula con longitudes de enlace idénticas (como el benceno), se encontró que el ciclobutadieno tenía una forma rectangular, lo que indica que los electrones no estaban deslocalizados.
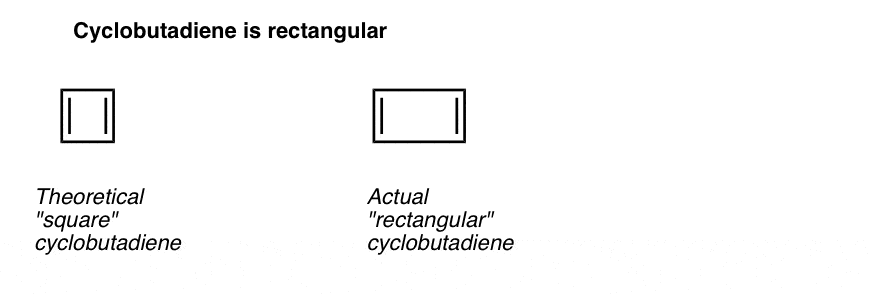
Lo que nos dice es que incluso cuando una molécula cumple todas las condiciones (electrones cíclicos, conjugados, planos, de 4 pi), la geometría simétrica es particularmente inestable. . Muy interesante!
Un Ejemplo de 8 electrones Pi de un Compuesto Antiaromático: Pentaleno
Hasta ahora todos los ejemplos que hemos visto hasta ahora tenían 4 electrones pi. Te estarás preguntando: ¿hay algún ejemplo de moléculas antiaromáticas que tengan más de 4 electrones pi? Vaya, sí.
La molécula de abajo se llama «Pentaleno». Se ha sintetizado, pero solo es estable por debajo de -100 °C. Por encima de esta temperatura se combina con otra molécula de sí misma (referencia). Otro ejemplo de inestabilidad espectacular.

El pentaleno tiene 8 electrones pi. Esto podría activar algunas alarmas de reconocimiento. Recuerde cómo el número de electrones pi en las moléculas aromáticas siguió la secuencia (2, 6, 10, 14….) ?
Este ejemplo sugiere que el número de electrones pi en el anti-moléculas aromáticas sigue la secuencia (4, 8, 12…)
¿Qué Hace que Una Molécula Anti-Aromáticos?
Entonces, ¿qué tienen en común todas estas moléculas en esta galería de pícaros?
Cada uno de ellos es cíclico, conjugado y plano, y cuando cuentas el número de electrones pi, es múltiplos de 4. Así, mientras que las moléculas aromáticas tienen electrones pi (4n + 2), la «regla» para las moléculas anti-aromáticas es (4n). (otra forma de verlo: el número de electrones pi será el doble de un número par).
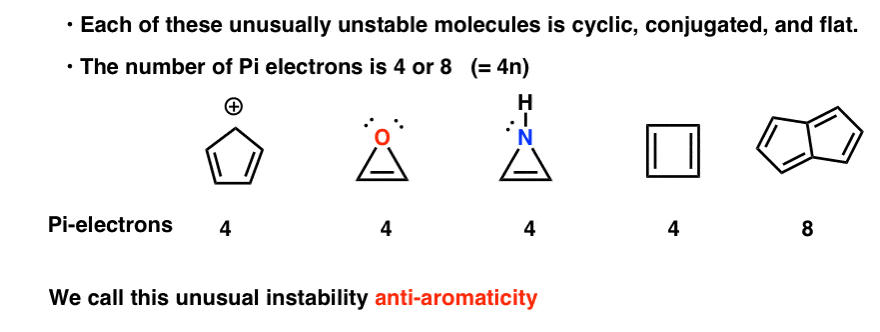
Esta inestabilidad inusual se llama «anti-aromaticidad».
Esto significa que ahora podemos elaborar tres categorías para moléculas de acuerdo con los siguientes criterios:
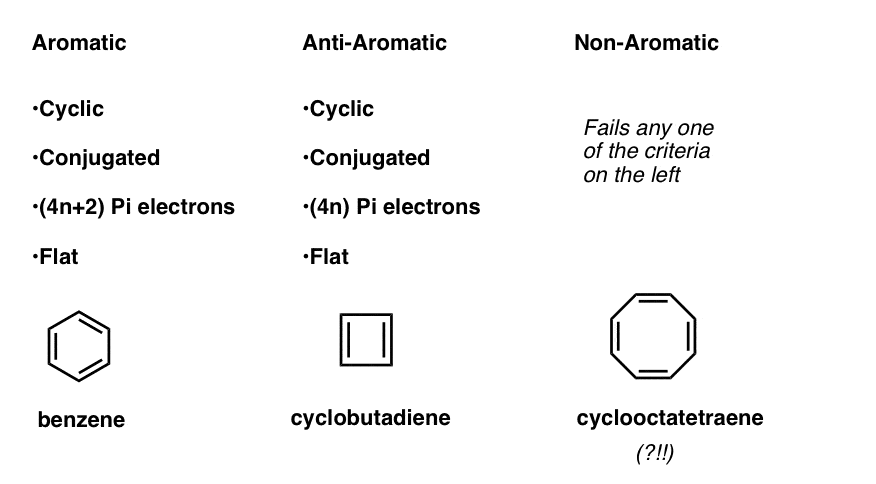
- Las moléculas aromáticas son cíclicas, conjugadas, tienen electrones pi (4n+2) y son planas.
- Las moléculas antiaromáticas son cíclicas, conjugadas, tienen electrones (4n) pi y son planas.
- Las moléculas no aromáticas son todas las demás moléculas que fallan en una de estas condiciones.
Espere un segundo, es posible que se pregunte por qué el ciclooctatetraeno se clasifica como»no aromático». Con 8 electrones pi (el doble de un número par), ¿no debería ser «anti-aromático»?
El ciclooctatetraeno » Escapa «de la Anti-Aromaticidad A través de La Torsión Fuera de la Planitud
Piense en cumplir con las condiciones para la» anti-aromaticidad » como un poco como calificar para un impuesto sobre la renta extremadamente penoso. Dada la oportunidad de encontrar una escapatoria para salir del impuesto, ¿lo harías? Probablemente.
El ciclooctatetraeno es anti-aromático solo si es plano. Sin embargo, la estructura relativamente «flexible» del ciclooctatetraeno permite cierta flexibilidad. Los enlaces pueden girar lejos de la planitud de tal manera que la molécula adopta una forma «tubular», evitando así el «impuesto de antiaromaticidad» de 18 12 kcal/mol que se pagaría si todos los orbitales p de la molécula se conjugaran entre sí.
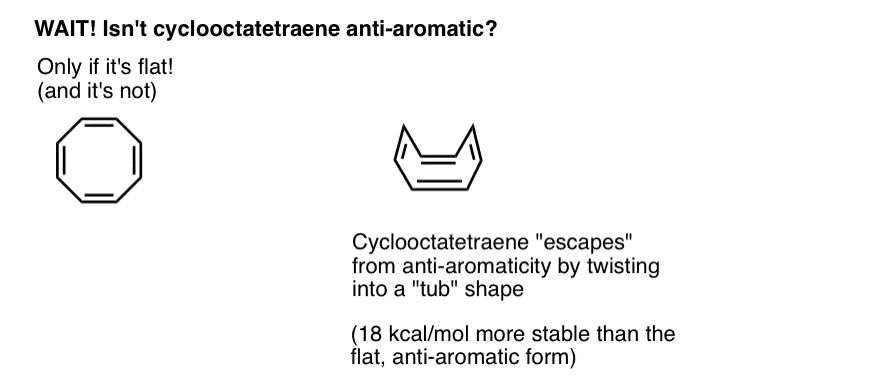
Resulta que el ciclooctatetraeno se ha sintetizado, es estable (se puede comprar aquí, por ejemplo) y se comporta como un alqueno «normal», experimentando reacciones de adición, hidrogenación, etc.
Pentaleno (arriba) que también tiene 8 electrones pi, tiene una estructura bicíclica muy rígida que evita la rotación del enlace lejos de la planitud. Por lo tanto, está atascado en su conformación anti-aromática.
Se conoce la anti-aromaticidad para moléculas con más de 8 electrones pi, pero es muy inusual. (Aquí hay un divertido ejemplo de otro «escape» de la aromaticidad para una molécula con 18 electrones pi.)
Conclusión: Compuestos antiaromáticos
Hasta ahora, nuestro tratamiento de la aromaticidad y la antiaromaticidad ha sido puramente descriptivo y empírico. Hemos mostrado muchos ejemplos y dado muchas reglas, pero falta en la discusión cualquier explicación profunda del «por qué».
¿Qué tiene de especial el anillo de benceno que lo hace tan estable? ¿Por qué es estable?
Qué tiene de especial el sistema ciclobutadieno que lo hace tan inestable. ¿Por qué es inestable?
Para responder a estas preguntas más profundas, vamos a tener que dar un paso atrás y examinar los orbitales moleculares de estas dos moléculas, y luego llegar a una comprensión más profunda de la aromaticidad y la anti-aromaticidad.
Eso es lo que haremos en nuestro próximo post.
Gracias a Matthew Knowe por su ayuda en la preparación de este post.
Notas
Nota 1. Para simplificar, la imagen que se muestra en el artículo principal confunde las condiciones de reacción reales. A continuación se muestran las condiciones experimentales reales. El solvente es ácido propiónico, y el perclorato de plata ácido de Lewis se agrega para ayudar a extraer el yodo. .
Incluso en estas condiciones, el carbocatión ciclopentadienilo no se forma, lo que es un testimonio de su extrema inestabilidad.
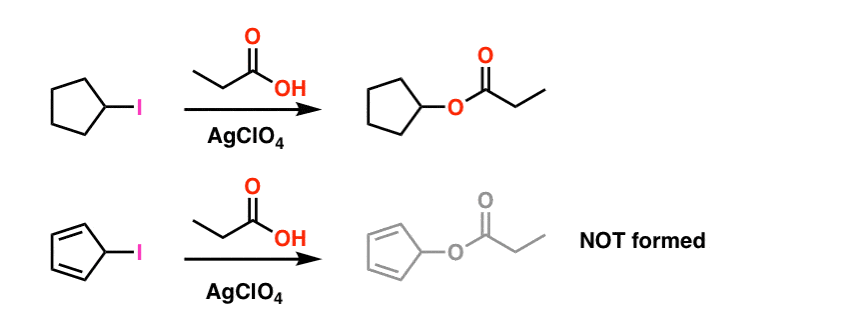
Nota a pie de página 2. La epoxidación del etileno (también conocido como etileno) se realiza a razón de 15 millones de toneladas anuales. Se desconoce la epoxidación del acetileno para formar oxireno.
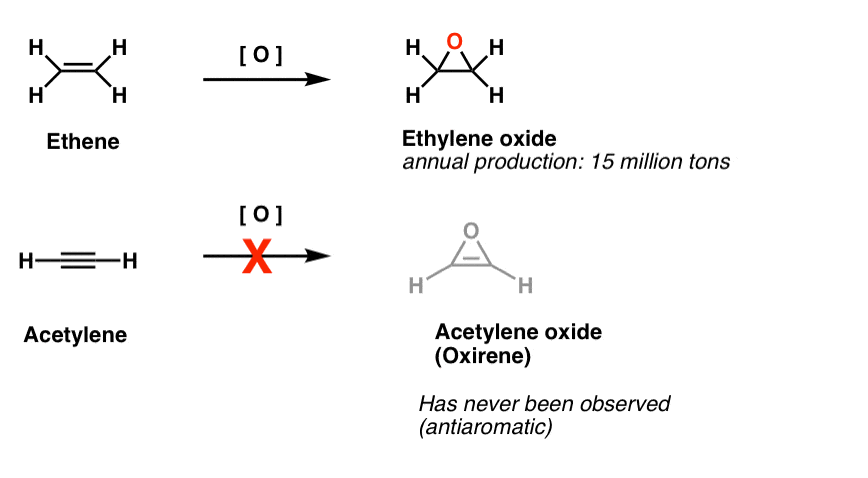
Se ha encontrado evidencia fugaz de la existencia de oxirenos. Existen buenas pruebas de estudios de etiquetado de isótopos de que los oxirenos son intermedios fugaces en ciertos reordenamientos de Wolff. También hay dos ejemplos de oxirenos que han sido atrapados a temperaturas extremadamente bajas, pero descompuestos por encima de 35 Kelvin.
La existencia fugaz de una 1H-azirina se ha postulado en la adición de un nitreno a un acetileno, que se reorganiza rápidamente a un (estable) 2H-azireno (abajo).
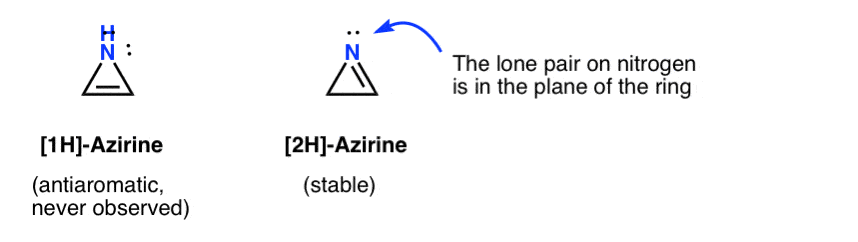
Tenga en cuenta que en 2H-azireno el par solitario en el nitrógeno está en ángulo recto con el sistema pi, por lo que este sistema no es aromático en lugar de anti-aromático.
Para más información, consulte Química Orgánica Avanzada de March. He estado trabajando en la 5ª edición, páginas 62-63.
. Nota 3. Un experimento muy inteligente determinó que el ciclobutadieno 1,2-dideutero tiene dos isómeros, no uno (ver más abajo). Esto indica que los enlaces dobles en el ciclobutadieno no están deslocalizados como lo están en el benceno, sino que son más como enlaces dobles en un dieno convencional.
El ciclobutadieno reacciona consigo mismo a 35 K para formar un «dímero», en un ejemplo de una reacción de Diels-Aliso.
Nota 4. Sí, es cierto que el par solitario en azireno se puede colocar en un orbital híbrido sp3 (abajo). Esto probablemente reduce un poco la «penalización» anti aromática, pero la molécula sigue siendo increíblemente inestable. La anti-aromaticidad es la forma más sencilla de explicar esto.

Nota 5. La geometría rectangular se debe a un efecto conocido como el efecto Jahn-Teller. ¿Recuerdas el principio de exclusión de Pauli, donde los electrones no pueden tener el mismo número cuántico? Bueno, como veremos cuando veamos el diagrama orbital molecular del ciclobutadieno, el ciclobutadieno «cuadrado» tiene dos electrones «degenerados», es decir, tienen las mismas energías y números cuánticos. Esto conduce a un fenómeno conocido como» repulsión de Pauli», donde se produce elongación de los enlaces hasta que los niveles de energía de los dos electrones se diferencian. Definitivamente un tema avanzado.
Referencias (Avanzadas)y Lectura adicional
- Espectroscopia de Estado de Transición de Ciclooctatetraeno
Paul G. Wenthold, David A. Hrovat, Weston T. Borden, W. C. Lineberger.Ciencia, 1996, 272, 1456-1459.DOI: 10.1126 / ciencia.272.5267.1456 Este estudio es la base para la afirmación de que el estado fundamental no aromático del ciclooctatetraeno es de 12 kcal/mol por debajo de la conformación «antiaromática». - La domesticación del Ciclobutadieno
Donald J. Cram, Martin E. Tanner,Robert Thomas
Chem. Int. Eréctil. 1991, 30 (8), 1024-1027 DOI: 10.1002/anie.199110241 Este artículo del Premio Nobel Prof. Donald J. Cram (UCLA) describe la primera caracterización espectroscópica del ciclobutadieno. Esto se logra encerrando el precursor en un hemicarcerand (complejo de jaula), y luego irradiándolo con luz UV, creando así ciclobutadieno, que es incapaz de hacer nada ya que está atrapado. - Ciclobutadieno
Thomas Bally, Satoru Masamune
Tetraedro 1980, 36 (3), 343-370
DOI: 1016/0040-4020(80)87003-7
Este artículo de 1980 revisa el trabajo realizado con ciclobutadieno hasta ese momento. Esto se divide en 2 partes: esfuerzos sintéticos experimentales y cálculos teóricos. - Tetraedrano y Ciclobutadieno
Günther Maier
Chem. Int. Eréctil. 1988, 27 (3), 309-332 DOI: 10.1002/anie.198803093
Este artículo revisa los esfuerzos sintéticos hacia el tetraedrano y el ciclobutadieno – ambas moléculas tienen una fórmula de C4H4. Hasta la fecha, solo se han sintetizado y aislado con éxito tetraedranas sustituidas (tetra t-butilo y tetra trimetilsililo). - Complejos Tricarbonílicos de Hierro y Ciclobutadieno y Benzociclobutadieno
F. Emerson, L. Watts y R. Pettit
Journal of the American Chemical Society 1965, 87 (1), 131-133
DOI: 10.1021/ja01079a032 - Ciclobutadieneiron Tricarbonilo. Un Nuevo Sistema Aromático
D. Fitzpatrick, L. Watts, G. F. Emerson, and R. Pettit
Journal of the American Chemical Society 1965, 87 (14), 3254-3255
DOI: 10.1021/ja01092a050
Un tema adicional: el ciclobutadieno se puede estabilizar con metales: el complejo organometálico ciclobutadieno de hierro tricarbonilo es un sólido cristalino estable. Como mencionan los autores, es poco probable que se genere ciclobutadieno libre en la síntesis. - https://www.asu.edu/courses/chm233/notes/aromatic/aromaticRL1/antiaromatic.html
La olanzapina antipsicótica adopta una forma de» mariposa » para evitar efectos antiaromáticos, similar al ciclooctatetraeno. Esto es aparentemente crítico para su función.Ronald Breslow Accounts of Chemical Research 1973, 6 (12), 393-398 DOI: 1021/ar50072a001 Curiosamente, el profesor Breslow (Columbia) afirma en este relato que fue la primera persona que sugirió el término «antiaromático» para compuestos cíclicos especialmente desestabilizados con electrones 4n p. También cita otros trabajos del profesor M. J. S. Dewar y otros en los que se calcula que la desestabilización antiaromática del ciclobutadieno está entre 18 y 33 kcal/mol en relación con el butadieno lineal.Determinación experimental de la Antiaromaticidad del Ciclobutadieno Ashok A. Deniz, Kevin S. Peters, Gary J. Snyder Science 1999, 286 (5442), 1119-1122 DOI: 1126/science.286.5442.1119 Este es un artículo muy riguroso que utiliza nuevas técnicas espectroscópicas para determinar la desestabilización antiaromática del ciclobutadieno. En relación con una hipotética referencia de dieno conjugado sin cepa, el ciclobutadieno se desestabiliza en un total de 87 kcal / mol, de las cuales 32 kcal/mol se pueden atribuir a la cepa anular y 55 kcal/mol a la antiaromaticidad (en comparación con 21 kcal/mol para la estabilización aromática del benceno).Catión de ciclopentadienilo no sustituido, un triplete de estado base Saunders, R. Berger, A. Jaffe, J. M. McBride, J. O’Neill, R. Breslow, J. M. Hoffmann, C. Perchonock, E. Wasserman, R. S. Hutton, V. J. Kuck Journal of the American Chemical Society 1973, 95 (9), 3017-3018 DOI: 10.1021 / ja00790a049
El catión ciclopentadienilo solo se puede preparar con dificultad, como se describe en este artículo. Una vez que se forma, tiene un estado fundamental electrónico triplete (con 2 electrones no emparejados), y puede caracterizarse por espectroscopia EPR (resonancia paramagnética electrónica). - Oxirenos
Errol G. Lewars
Chemical Reviews 1983, 83 (5), 519-534
DOI: 10.1021/cr00057a002