La adición de hidrógeno a un doble enlace carbono-carbono se denomina hidrogenación. El efecto general de tal adición es la eliminación reductiva del grupo funcional de doble enlace. La regioselectividad no es un problema, ya que el mismo grupo (un átomo de hidrógeno) está unido a cada uno de los carbonos de doble enlace. La fuente más simple de dos átomos de hidrógeno es el hidrógeno molecular (H2), pero la mezcla de alquenos con hidrógeno no da lugar a ninguna reacción discernible. Aunque la reacción de hidrogenación general es exotérmica, una alta energía de activación impide que tenga lugar en condiciones normales. Esta restricción puede eludirse mediante el uso de un catalizador, como se muestra en el siguiente diagrama.
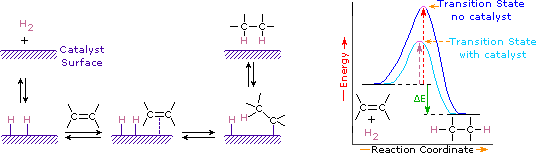
Los catalizadores son sustancias que cambian la velocidad de una reacción química sin consumirse ni aparecer como parte del producto. Los catalizadores actúan reduciendo la energía de activación de las reacciones, pero no cambian la energía potencial relativa de los reactivos y productos. Los metales finamente divididos, como el platino, el paladio y el níquel, se encuentran entre los catalizadores de hidrogenación más utilizados. La hidrogenación catalítica se lleva a cabo en al menos dos etapas, como se muestra en el diagrama. En primer lugar, el alqueno debe ser adsorbido en la superficie del catalizador junto con parte del hidrógeno. A continuación, dos hidrógenos se desplazan de la superficie metálica a los carbonos del doble enlace, y el hidrocarburo saturado resultante, que es más débilmente adsorbido, abandona la superficie del catalizador. La naturaleza exacta y el momento de los últimos eventos no se entienden bien.
Como se muestra en el diagrama de energía, la hidrogenación de alquenos es exotérmica, y se libera calor correspondiente al ΔE (color verde) en el diagrama. Este calor de reacción se puede utilizar para evaluar la estabilidad termodinámica de alquenos que tienen diferentes números de sustituyentes alquilos en el doble enlace. Por ejemplo, en el cuadro siguiente se enumeran los calores de hidrogenación de tres alquenos C5H10 que dan el mismo producto alcano (2-metilbutano). Dado que un gran calor de reacción indica un reactivo de alta energía, estos calores son inversamente proporcionales a las estabilidades de los isómeros de alqueno. Para una aproximación aproximada, vemos que cada sustituyente alquilo en un enlace doble estabiliza este grupo funcional en un poco más de 1 kcal / mol.
| Alqueno Isómero | (CH3)2CHCH=CH2 3-metil-1-buteno |
CH2=C(CH3)CH2CH3 2-metil-1-buteno |
(CH3)2C=CHCH3 2-metil-2-buteno |
|---|---|---|---|
| Calor de Reacción ( ΔHº ) |
-30.3 kcal/mol | -28.5 kcal/mol | -26.9 kcal/mol |
Desde el mecanismo que se muestra aquí podríamos esperar que la adición de hidrógeno a ocurrir con syn-estereoselectividad. Esto es a menudo cierto, pero los catalizadores de hidrogenación también pueden causar isomerización del doble enlace antes de la adición de hidrógeno, en cuyo caso la estereoselectividad puede ser incierta.La formación de complejos de metales de transición con alquenos ha sido demostrada convincentemente por el aislamiento de complejos de platino estables como la sal de Zeise, K. H2O, y el platino de etilenbis(trifenilfosfina), 2Pt(H2C=CH2). En este último, el platino tiene tres coordenadas y cero valente, mientras que la sal de Zeise es un derivado del platino(II). Un modelo de la sal de Zeise y una discusión de la unión inusual en tales complejos se pueden ver haciendo clic aquí. Se han reportado complejos similares para el níquel y el paladio, metales que también funcionan como catalizadores para la hidrogenación de alquenos.
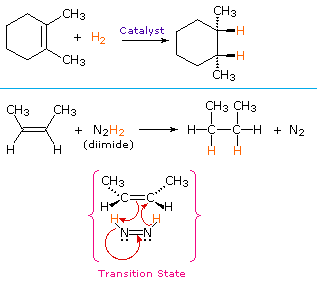
Un procedimiento no catalítico para la adición sin de hidrógeno hace uso del compuesto inestable diimida, N2H2. Este reactivo debe generarse recientemente en el sistema de reacción, generalmente por oxidación de hidracina, y la reacción fuertemente exotérmica se ve favorecida por la eliminación de gas nitrógeno (un compuesto muy estable). La diimida puede existir como isómeros cis-trans; solo el isómero cis sirve como agente reductor. A continuación se muestran ejemplos de reducciones de alquenos por ambos procedimientos.
Colaboradores
- William Reusch, Profesor Emérito (Michigan State U.), Libro de Texto Virtual de Química Orgánica