Objetivos de aprendizaje
Al final de esta sección, podrá:
- Examinar la transferencia de calor.
- Calcular la temperatura final a partir de la transferencia de calor.
Hasta ahora hemos discutido el cambio de temperatura debido a la transferencia de calor. No se produce ningún cambio de temperatura por transferencia de calor si el hielo se derrite y se convierte en agua líquida (es decir, durante un cambio de fase). Por ejemplo, considere el goteo de agua de carámbanos que se derriten en un techo calentado por el Sol. Por el contrario, el agua se congela en una bandeja de hielo enfriada por un entorno de temperatura más baja.

Figura 1. El calor del aire se transfiere al hielo haciendo que se derrita. (crédito: Mike Brand)
Se requiere energía para fundir un sólido porque los enlaces cohesivos entre las moléculas en el sólido deben romperse de manera que, en el líquido, las moléculas puedan moverse a energías cinéticas comparables; por lo tanto, no hay aumento de temperatura. De manera similar, se necesita energía para vaporizar un líquido, porque las moléculas de un líquido interactúan entre sí a través de fuerzas atractivas. No hay cambio de temperatura hasta que se complete un cambio de fase. La temperatura de una taza de refresco inicialmente a 0ºC se mantiene a 0ºC hasta que todo el hielo se derrita. Por el contrario, la energía se libera durante la congelación y la condensación, generalmente en forma de energía térmica. El trabajo se realiza mediante fuerzas cohesivas cuando las moléculas se unen. La energía correspondiente debe ser emitida (disipada)para permitir que permanezcan juntos Figura 2.
La energía involucrada en un cambio de fase depende de dos factores principales: el número y la fuerza de los enlaces o pares de fuerzas. El número de enlaces es proporcional al número de moléculas y, por lo tanto, a la masa de la muestra. La fuerza de las fuerzas depende del tipo de moléculas. El calor Q requerido para cambiar la fase de una muestra de masa m viene dado por
Q = mLf (fusión / congelación,
Q = mLv (vaporización/condensación),
donde el calor latente de fusión, Lf, y el calor latente de vaporización, Lv, son constantes materiales que se determinan experimentalmente. Véase (Cuadro 1).

Figura 2. (a) Se requiere energía para superar parcialmente las fuerzas de atracción entre moléculas en un sólido para formar un líquido. Esa misma energía debe eliminarse para que se produzca la congelación. (b) Las moléculas están separadas por grandes distancias al pasar del líquido al vapor, lo que requiere una energía significativa para superar la atracción molecular. Se debe eliminar la misma energía para que se produzca la condensación. No hay cambio de temperatura hasta que se complete un cambio de fase.
el calor Latente se mide en unidades de J/kg. Tanto el Lf como el Lv dependen de la sustancia, en particular de la fuerza de sus fuerzas moleculares, como se señaló anteriormente. Lf y Lv se denominan colectivamente coeficientes de calor latente. Están latentes, u ocultos, porque en los cambios de fase, la energía entra o sale de un sistema sin causar un cambio de temperatura en el sistema; por lo tanto, en efecto, la energía está oculta. En el cuadro 1 se enumeran los valores representativos de Lf y Lv, junto con los puntos de fusión y ebullición.
La tabla muestra que cantidades significativas de energía están involucradas en los cambios de fase. Veamos, por ejemplo, cuánta energía se necesita para derretir un kilogramo de hielo a 0°C para producir un kilogramo de agua a 0 ° C. Usando la ecuación para un cambio en la temperatura y el valor para el agua de la Tabla 1, encontramos que Q = mLf = (1.0 kg) (334 kJ / kg) = 334 kJ es la energía para derretir un kilogramo de hielo. Esto es mucha energía, ya que representa la misma cantidad de energía necesaria para elevar la temperatura de 1 kg de agua líquida de 0 ° C a 79,8 ° C. Se requiere aún más energía para vaporizar el agua; se necesitarían 2256 kJ para cambiar 1 kg de agua líquida en el punto de ebullición normal (100 ° C a presión atmosférica) a vapor (vapor de agua). Este ejemplo muestra que la energía para un cambio de fase es enorme en comparación con la energía asociada con los cambios de temperatura sin un cambio de fase.
| Table 1. Heats of Fusion and Vaporization | ||||||
|---|---|---|---|---|---|---|
| Lf | Lv | |||||
| Substance | Melting point (ºC) | kJ/kg | kcal/kg | Boiling point (°C) | kJ/kg | kcal/kg |
| Helium | −269.7 | 5.23 | 1.25 | −268.9 | 20.9 | 4.99 |
| Hydrogen | −259.3 | 58.6 | 14.0 | −252.9 | 452 | 108 |
| Nitrogen | −210.0 | 25.5 | 6.09 | −195.8 | 201 | 48.0 |
| Oxygen | −218.8 | 13.8 | 3.30 | −183.0 | 213 | 50.9 |
| Ethanol | −114 | 104 | 24.9 | 78.3 | 854 | 204 |
| Ammonia | −75 | 108 | −33.4 | 1370 | 327 | |
| Mercury | −38.9 | 11.8 | 2.82 | 357 | 272 | 65.0 |
| Water | 0.00 | 334 | 79.8 | 100.0 | 2256 | 539 |
| Sulfur | 119 | 38.1 | 9.10 | 444.6 | 326 | 77.9 |
| Lead | 327 | 24.5 | 5.85 | 1750 | 871 | 208 |
| Antimony | 631 | 165 | 39.4 | 1440 | 561 | 134 |
| Aluminum | 660 | 380 | 90 | 2450 | 11400 | 2720 |
| Silver | 961 | 88.3 | 21.1 | 2193 | 2336 | 558 |
| Gold | 1063 | 64.5 | 15.4 | 2660 | 1578 | 377 |
| Copper | 1083 | 134 | 32.0 | 2595 | 5069 | 1211 |
| Uranium | 1133 | 84 | 20 | 3900 | 1900 | 454 |
| Tungsten | 3410 | 184 | 44 | 5900 | 4810 | 1150 |
Phase changes can have a tremendous stabilizing effect even on temperatures that are not near the melting and boiling points, because evaporation and condensation (conversion of a gas into a liquid state) occur even at temperatures below the boiling point. Tomemos, por ejemplo, el hecho de que las temperaturas del aire en climas húmedos rara vez superan los 35,0 ºC, lo que se debe a que la mayor parte de la transferencia de calor va al agua que se evapora al aire. Del mismo modo, las temperaturas en clima húmedo rara vez caen por debajo del punto de rocío porque se libera un calor enorme cuando el vapor de agua se condensa.
Examinamos los efectos del cambio de fase con mayor precisión considerando agregar calor a una muestra de hielo a −20ºC (Figura 3). La temperatura del hielo aumenta linealmente, absorbiendo calor a una velocidad constante de 0,50 cal/g⋅ºC hasta que alcanza los 0ºC. Una vez a esta temperatura, el hielo comienza a derretirse hasta que todo el hielo se haya derretido, absorbiendo 79,8 cal/g de calor. La temperatura se mantiene constante a 0 ° C durante este cambio de fase. Una vez que todo el hielo se ha derretido, la temperatura del agua líquida aumenta, absorbiendo calor a una nueva tasa constante de 1,00 cal/g⋅ºC. A 100ºC, el agua comienza a hervir y la temperatura permanece constante, mientras que el agua absorbe el 539 cal/g calor durante este cambio de fase. Cuando todo el líquido se ha convertido en vapor de vapor, la temperatura aumenta de nuevo, absorbiendo calor a una velocidad de 0,482 cal/g⋅ºC.
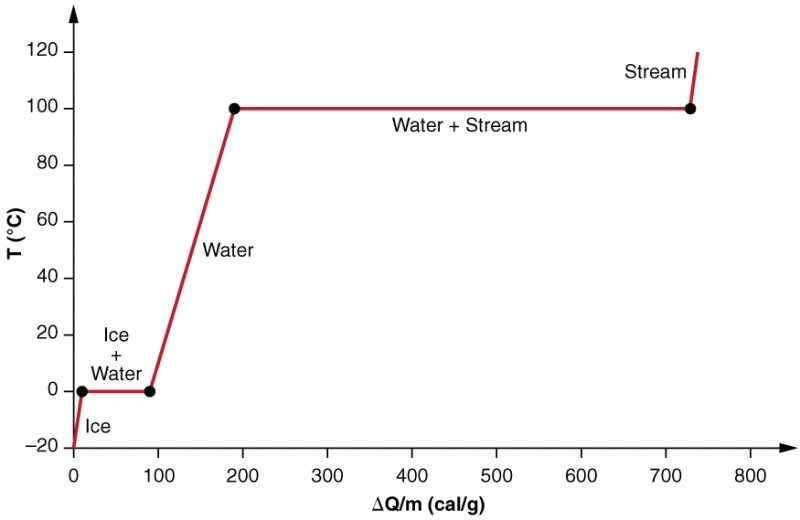
Figura 3. Un gráfico de temperatura versus energía agregada. El sistema está construido para que ningún vapor se evapore mientras el hielo se calienta para convertirse en agua líquida, y para que, cuando se produce la vaporización, el vapor permanezca en el sistema. Los largos tramos de valores de temperatura constante a 0ºC y 100ºC reflejan el gran calor latente de fusión y vaporización, respectivamente.
El agua puede evaporarse a temperaturas por debajo del punto de ebullición. Se requiere más energía que en el punto de ebullición, porque la energía cinética de las moléculas de agua a temperaturas inferiores a 100ºC es menor que la de 100ºC, por lo que se dispone de menos energía de movimientos térmicos aleatorios. Tomemos, por ejemplo, el hecho de que, a temperatura corporal, la transpiración de la piel requiere un aporte de calor de 2428 kJ/kg, que es aproximadamente un 10 por ciento más alto que el calor latente de vaporización a 100 ° C. Este calor proviene de la piel y, por lo tanto, proporciona un mecanismo de enfriamiento efectivo en climas cálidos. La humedad alta inhibe la evaporación, por lo que la temperatura corporal podría aumentar, dejando sudor sin evaporar en la frente.
Ejemplo 1. Calcular la Temperatura Final a partir del Cambio de Fase: Refresco con Cubitos de hielo
Se utilizan tres cubitos de hielo para enfriar un refresco a 20ºC con masa msoda = 0,25 kg. El hielo está a 0 ° C y cada cubito de hielo tiene una masa de 6,0 g. Suponga que el refresco se mantiene en un recipiente de espuma para que se pueda ignorar la pérdida de calor. Supongamos que el refresco tiene la misma capacidad calorífica que el agua. Encuentra la temperatura final cuando todo el hielo se haya derretido.
Estrategia
Los cubitos de hielo están a la temperatura de fusión de 0ºC. El calor se transfiere de la soda al hielo para que se derrita. La fusión del hielo ocurre en dos pasos: primero se produce el cambio de fase y el sólido (hielo) se transforma en agua líquida a la temperatura de fusión, luego la temperatura de esta agua aumenta. La fusión produce agua a 0 ° C, por lo que se transfiere más calor de la soda a esta agua hasta que el sistema de agua más soda alcanza el equilibrio térmico, Qice = − Qsoda.
El calor transferido al hielo es
Qice = ratones Lf + micecW (Tf−0ºC).
El calor que emite la soda es Qsoda = msodacW (Tf−20ºC). Dado que no se pierde calor, Qice = – Qsoda, de modo que
ratones Lf + micecW (Tf-0ºC) = −msodacW(Tf-20ºC).
Traiga todos los términos que involucran Tf en el lado izquierdo y todos los demás términos en el lado derecho. Resolver para la cantidad desconocida Tf:
\displaystyle{T}_{\text{f}}=\frac{m_{\text{soda}}c_{\text{W}}\left(20^{\circ}\text{C}\right)-m_{\text{ice}}L_{\text{f}}}{\left(m_{\text{soda}}+m_{\text{ice}}\right)c_{\text{W}}}\\
Solución
- Identificar las cantidades conocidas. La masa de hielo se ratones = 3 × 6.0 g = 0.018 kg y la masa de soda es msoda = 0.25 kg.
- Calcular los términos en el numerador: m sodacW(20ºC)=(0.25 kg)(4186 J/kg ⋅ ºC)(20ºC) = 20,930 J y miceLf = (0.018 kg)(334,000 J/kg) = 6012 J.
- Calcular el denominador: (msoda + ratones)cW = (0.25 kg + 0.018 kg) (4186 K/(kg⋅ºC) = 1122 J/ºC.
- Calcular la temperatura final: \displaystyle{T}_{\text{f}}=\frac{20,930\text{ J}-6012\text{ J}}{1122\text{ J/}^{\circ}\text{C}}=13^{\circ}\text{C}\\
Discusión
Este ejemplo ilustra las enormes energías que intervienen durante un cambio de fase. La masa de hielo es de aproximadamente el 7 por ciento de la masa de agua, pero conduce a un cambio notable en la temperatura de la soda. Aunque asumimos que el hielo estaba a la temperatura de congelación, esto es incorrecto: la temperatura típica es de −6ºC. Sin embargo, esta corrección da una temperatura final que es esencialmente idéntica al resultado que encontramos. ¿Puedes explicar por qué?

Figura 4. Condensación en un vaso de té helado. (crédito: Jenny Downing)
Hemos visto que la vaporización requiere la transferencia de calor a un líquido del entorno, de modo que el entorno libera energía. La condensación es el proceso inverso, aumentando la temperatura del entorno. Este aumento puede parecer sorprendente, ya que asociamos la condensación con objetos fríos, como el vidrio de la figura, por ejemplo. Sin embargo, la energía debe eliminarse de las moléculas de condensación para hacer una condensación de vapor. La energía es exactamente la misma que se requiere para hacer el cambio de fase en la otra dirección, de líquido a vapor, por lo que se puede calcular a partir de Q = mLv.
La condensación se forma en la Figura 4 porque la temperatura del aire cercano se reduce por debajo del punto de rocío. El aire no puede contener tanta agua como lo hizo a temperatura ambiente, por lo que el agua se condensa. La energía se libera cuando el agua se condensa, acelerando el derretimiento del hielo en el vidrio.
Aplicación en el mundo real
La energía también se libera cuando un líquido se congela. Este fenómeno es utilizado por los productores de frutas en Florida para proteger las naranjas cuando la temperatura está cerca del punto de congelación (0 ° C). Los cultivadores rocían agua sobre las plantas de los huertos para que el agua se congele y se libere calor a las naranjas que crecen en los árboles. Esto evita que la temperatura dentro de la naranja caiga por debajo del punto de congelación, lo que dañaría la fruta.

Figura 14.11. El hielo en estos árboles liberan grandes cantidades de energía cuando se congeló, ayudando a evitar que la temperatura de los árboles se caigan por debajo de los 0ºC. El agua se rocía intencionalmente en los huertos para ayudar a prevenir heladas duras. (crédito: Hermann Hammer)
La sublimación es la transición de la fase sólida a la fase de vapor. Es posible que haya notado que la nieve puede desaparecer en el aire sin dejar rastro de agua líquida, o la desaparición de cubitos de hielo en un congelador. Lo contrario también es cierto: las heladas se pueden formar en ventanas muy frías sin pasar por la etapa líquida. Un efecto popular es la fabricación de «humo» a partir de hielo seco, que es dióxido de carbono sólido. La sublimación se produce porque la presión de vapor de equilibrio de los sólidos no es cero. Ciertos ambientadores utilizan la sublimación de un sólido para inyectar un perfume en la habitación. Las bolas de polilla son un ejemplo ligeramente tóxico de un fenol (un compuesto orgánico) que se sublima, mientras que algunos sólidos, como el tetróxido de osmio, son tan tóxicos que deben mantenerse en recipientes sellados para evitar la exposición humana a sus vapores producidos por sublimación.

Figura 5. Las transiciones directas entre sólido y vapor son comunes, a veces útiles e incluso hermosas. a) El hielo seco se sublima directamente en gas dióxido de carbono. El vapor visible está hecho de gotas de agua. (crédito: Windell Oskay) (b) Frost forma patrones en una ventana muy fría, un ejemplo de un sólido formado directamente de un vapor. (crédito: Liz West)
Todas las transiciones de fase implican calor. En el caso de transiciones directas sólido-vapor, la energía requerida viene dada por la ecuación Q = mLs, donde Ls es el calor de sublimación, que es la energía requerida para cambiar 1.00 kg de una sustancia desde la fase sólida hasta la fase de vapor. Ls es análogo a Lf y Lv, y su valor depende de la sustancia. La sublimación requiere la entrada de energía, por lo que el hielo seco es un refrigerante eficaz, mientras que el proceso inverso (es decir, el glaseado) libera energía. La cantidad de energía requerida para la sublimación es del mismo orden de magnitud que para otras transiciones de fase.
El material presentado en esta sección y en la anterior nos permite calcular cualquier número de efectos relacionados con la temperatura y el cambio de fase. En cada caso, es necesario identificar qué cambios de temperatura y fase se están produciendo y luego aplicar la ecuación adecuada. Tenga en cuenta que la transferencia de calor y el trabajo pueden causar cambios de temperatura y de fase.
Estrategias de resolución de problemas para los Efectos de la Transferencia de Calor
- Examine la situación para determinar que hay un cambio en la temperatura o fase. Hay transferencia de calor dentro o fuera del sistema? Cuando la presencia o ausencia de un cambio de fase no es obvia, es posible que desee resolver primero el problema como si no hubiera cambios de fase, y examinar el cambio de temperatura obtenido. Si es suficiente para llevarlo más allá de un punto de ebullición o fusión, debe regresar y hacer el problema en pasos: cambio de temperatura, cambio de fase, cambio de temperatura posterior, etc.
- Identifique y enumere todos los objetos que cambian de temperatura y fase.
- Identifique exactamente lo que necesita ser determinado en el problema (identifique las incógnitas). Una lista escrita es útil.
- Haga una lista de lo que se da o lo que se puede inferir del problema como se indica (identifique los conocidos).
- Resolver la ecuación apropiada para la cantidad a determinar (lo desconocido). Si hay un cambio de temperatura, el calor transferido depende del calor específico (ver Tabla 1 en Cambio de Temperatura y Capacidad de calor), mientras que, para un cambio de fase, el calor transferido depende del calor latente. Véase el cuadro 1.
- Sustituya los conocidos junto con sus unidades en la ecuación apropiada y obtenga soluciones numéricas completas con unidades. Tendrá que hacer esto en pasos si hay más de una etapa en el proceso (como un cambio de temperatura seguido de un cambio de fase).
- Compruebe la respuesta para ver si es razonable: ¿Tiene sentido? Por ejemplo, asegúrese de que el cambio de temperatura no cause también un cambio de fase que no haya tenido en cuenta.
Compruebe su comprensión
¿Por qué la nieve permanece en las laderas de las montañas incluso cuando las temperaturas diurnas son más altas que la temperatura de congelación?
Solución
La nieve se forma a partir de cristales de hielo y, por lo tanto, es la fase sólida del agua. Debido a que se necesita un calor enorme para los cambios de fase, se necesita una cierta cantidad de tiempo para que este calor se acumule desde el aire, incluso si el aire está por encima de 0 ° C. Cuanto más cálido sea el aire, más rápido se produce este intercambio de calor y más rápido se derrite la nieve.
Resumen de la sección
- La mayoría de las sustancias pueden existir en forma sólida, líquida y gaseosa, a las que se hace referencia como «fases».»
- Los cambios de fase se producen a temperaturas fijas para una sustancia dada a una presión dada, y estas temperaturas se denominan puntos de ebullición y congelación (o fusión).
- Durante los cambios de fase, el calor absorbido o liberado viene dado por: Q = mL donde L es el coeficiente de calor latente.
Preguntas conceptuales
- La transferencia de calor puede causar cambios de temperatura y fase. ¿Qué más puede causar estos cambios?
- ¿Cómo ayuda el calor latente de fusión del agua a frenar la disminución de la temperatura del aire, tal vez evitando que las temperaturas caigan significativamente por debajo de ºC, en las proximidades de grandes masas de agua?
- ¿Cuál es la temperatura del hielo justo después de que se forme al congelar el agua?
- Si colocas hielo ºC en agua ºC en un recipiente aislado, ¿qué pasará? Se derretirá algo de hielo, se congelará más agua, o no tendrá lugar ninguno de los dos?
- ¿Qué efecto tiene la condensación en un vaso de agua helada en la velocidad a la que se derrite el hielo? ¿La condensación acelerará el proceso de fusión o lo ralentizará?
- En climas muy húmedos donde hay numerosos cuerpos de agua, como en Florida, es inusual que las temperaturas se eleven por encima de los 35 ° C (95 ° F). En los desiertos, sin embargo, las temperaturas pueden elevarse muy por encima de esto. Explique cómo la evaporación del agua ayuda a limitar las altas temperaturas en climas húmedos.
- En invierno, a menudo es más cálido en San Francisco que en la cercana Sacramento, a 150 km tierra adentro. En verano, casi siempre hace más calor en Sacramento. Explique cómo los cuerpos de agua que rodean San Francisco moderan sus temperaturas extremas.Poner una tapa en una olla hirviendo reduce en gran medida la transferencia de calor necesaria para mantenerla hirviendo. Explica por qué.
- Los alimentos liofilizados se han deshidratado al vacío. Durante el proceso, los alimentos se congelan y deben calentarse para facilitar la deshidratación. Explique cómo el vacío acelera la deshidratación y por qué los alimentos se congelan como resultado.
- Cuando el aire en calma se enfría por radiación nocturna, es inusual que las temperaturas caigan por debajo del punto de rocío. Explica por qué.
- En una demostración de física en el aula, un instructor infla un globo por la boca y luego lo enfría en nitrógeno líquido. Cuando está frío, el globo encogido tiene una pequeña cantidad de líquido azul claro, así como algunos cristales similares a la nieve. A medida que se calienta, el líquido hierve, y parte de los cristales se subliman, con algunos cristales que permanecen por un tiempo y luego producen un líquido. Identifique el líquido azul y los dos sólidos en el globo frío. Justifique sus identificaciones utilizando los datos de la Tabla 1.
Problemas& Ejercicios
- ¿Cuánta transferencia de calor (en kilocalorías) se requiere para descongelar un paquete de verduras congeladas de 0,450 kg originalmente a 0 ° C si su calor de fusión es el mismo que el del agua?
- Una bolsa que contiene hielo a 0ºC es mucho más eficaz para absorber energía que una que contiene la misma cantidad de agua a 0ºC. a) ¿Cuánta transferencia de calor es necesaria para elevar la temperatura de 0,800 kg de agua de 0ºC a 30,0 ºC? (b) Cuánta transferencia de calor se requiere para fundir primero 0.¿800 kg de hielo a 0ºC y luego elevar su temperatura? (c) Explique cómo su respuesta apoya la afirmación de que el ice es más efectivo.
- (a) ¿Cuánta transferencia de calor se requiere para elevar la temperatura de una olla de aluminio de 0,750 kg que contiene 2,50 kg de agua desde 30,0 ºC hasta el punto de ebullición y luego hervir 0,750 kg de agua? b) ¿Cuánto tarda esto si la velocidad de transferencia de calor es de 500 W 1 vatio = 1 julio/segundo (1 W = 1 J/s)?
- La formación de condensación en un vaso de agua helada hace que el hielo se derrita más rápido de lo que lo haría de otra manera. Si 8.se forman 00 g de condensación en un vaso que contiene agua y 200 g de hielo, ¿cuántos gramos de hielo se derretirán como resultado? Supongamos que no se produce ninguna otra transferencia de calor.
- En un viaje, notarás que una bolsa de hielo de 3,50 kg dura un día en promedio en tu enfriador. ¿Cuál es la potencia media en vatios que entra en el hielo si comienza a 0 ° C y se derrite completamente a 0 ° C de agua en exactamente un día 1 vatio = 1 julio/segundo (1 W = 1 J/s)?
- En un cierto día seco y soleado, la temperatura de una piscina aumentaría en 1,50 ºC si no fuera por evaporación. ¿Qué fracción del agua debe evaporarse para transportar con precisión la energía suficiente para mantener la temperatura constante?
- (a) ¿Cuánta transferencia de calor es necesaria para elevar la temperatura de un trozo de hielo de 0,200 kg de -20,0 ºC a 130 ºC, incluida la energía necesaria para los cambios de fase? (b) ¿Cuánto tiempo se requiere para cada etapa, suponiendo una tasa constante de transferencia de calor de 20,0 kJ/s? (c) Hacer un gráfico de temperatura versus tiempo para este proceso.
- En 1986, un gigantesco iceberg se desprendió de la Barrera de hielo de Ross en la Antártida. Era aproximadamente un rectángulo de 160 km de largo, 40.0 km de ancho y 250 m de espesor. a) ¿Cuál es la masa de este iceberg, dado que la densidad del hielo es de 917 kg/m3? b) ¿Cuánta transferencia de calor (en julios) se necesita para fundirla? (c) ¿Cuántos años tardaría la luz solar sola en derretir hielo tan grueso, si el hielo absorbe un promedio de 100 W/m2, 12.00 h por día?
- ¿Cuántos gramos de café deben evaporarse de 350 g de café en una taza de vidrio de 100 g para enfriar el café de 95,0 ºC a 45,0 ºC? Puede suponer que el café tiene las mismas propiedades térmicas que el agua y que el calor promedio de vaporización es de 2340 kJ/kg (560 cal/g). (Es posible que descuides el cambio en la masa del café a medida que se enfría, lo que te dará una respuesta que es un poco más grande de lo correcto.)
- (a) Es difícil extinguir un incendio en un petrolero crudo, porque cada litro de petróleo crudo libera 2,80 × 107 J de energía cuando se quema. Para ilustrar esta dificultad, calcule el número de litros de agua que se deben gastar para absorber la energía liberada por la quema de 1,00 L de petróleo crudo, si el agua tiene su temperatura elevada de 20,0 ºC a 100 ºC, hierve y el vapor resultante se eleva a 300 ºC. b) Examinar las complicaciones adicionales causadas por el hecho de que el petróleo crudo tiene una densidad menor que el agua.
- La energía liberada por la condensación en las tormentas eléctricas puede ser muy grande. Calcule la energía liberada a la atmósfera para una pequeña tormenta de radio de 1 km, suponiendo que se precipite uniformemente 1,0 cm de lluvia sobre esta área.
- Para ayudar a prevenir daños por heladas, se rocían 4,00 kg de agua a 0 ° C sobre un árbol frutal. a) ¿Cuánta transferencia de calor se produce a medida que el agua se congela? b) ¿En qué medida disminuiría la temperatura del árbol de 200 kg si se transfiriera esa cantidad de calor del árbol? Tome el calor específico a 3,35 kJ · kg * ºC, y asuma que no se produce ningún cambio de fase.
- Un recipiente de aluminio de 0,250 kg que contiene 0,800 kg de sopa a 25,0 ºC se coloca en un congelador. ¿Cuál es la temperatura final si se transfieren 377 kJ de energía desde el recipiente y la sopa, suponiendo que las propiedades térmicas de la sopa sean las mismas que las del agua?
- Un cubo de hielo de 0,0500 kg a -30,0 ºC se coloca en 0,400 kg de agua de 35,0 ºC en un recipiente muy bien aislado. ¿Cuál es la temperatura final?
- Si viertes 0,0100 kg de agua de 20,0 ºC en un bloque de hielo de 1,20 kg (que está inicialmente a -15,0 ºC), ¿cuál es la temperatura final? Puede suponer que el agua se enfría tan rápidamente que los efectos de los alrededores son insignificantes.
- Los indígenas a veces cocinan en cestas estancas colocando rocas calientes en el agua para que hierva. ¿Qué masa de roca de 500 ° C debe colocarse en 4,00 kg de agua de 15,0 ° C para llevar su temperatura a 100 ° C, si 0,0250 kg de agua se escapa en forma de vapor del chisporroteo inicial? Puede descuidar los efectos de los alrededores y tomar el calor promedio específico de las rocas como el de granito.
- ¿Cuál sería la temperatura final de la sartén y el agua al Calcular la Temperatura Final Cuando el Calor Se Transfiere Entre Dos Cuerpos: Verter Agua Fría en una Sartén Caliente si se colocaron 0,260 kg de agua en la sartén y 0,0100 kg de agua se evaporaron inmediatamente, dejando que el resto alcance una temperatura común con la sartén?
- En algunos países, el nitrógeno líquido se utiliza en camiones lecheros en lugar de refrigeradores mecánicos. A 3.el viaje de entrega de 00 horas requiere 200 L de nitrógeno líquido, que tiene una densidad de 808 kg/m3. a) Calcular la transferencia de calor necesaria para evaporar esta cantidad de nitrógeno líquido y elevar su temperatura a 3,00 ºC. (Use cp y asuma que es constante en el rango de temperatura.) Este valor es la cantidad de enfriamiento de los suministros de nitrógeno líquido. (b) ¿Cuál es esta tasa de transferencia de calor en kilovatios-hora? c) Comparar la cantidad de refrigeración obtenida de la fusión de una masa idéntica de hielo a 0ºC con la de la evaporación del nitrógeno líquido.
- Algunos aficionados a las armas hacen sus propias balas, lo que implica fundir y lanzar las balas de plomo. ¿Cuánta transferencia de calor se necesita para elevar la temperatura y fundir 0,500 kg de plomo, a partir de 25,0 ºC?
Glosario
calor de sublimación: la energía necesaria para cambiar una sustancia de la fase sólida a la fase de vapor
coeficiente de calor latente: una constante física igual a la cantidad de calor transferido por cada 1 kg de una sustancia durante el cambio de fase de la sustancia
sublimación: la transición de la fase sólida a la fase de vapor
Soluciones seleccionadas a Problemas & Ejercicios
1. 35,9 kcal
3. a) 591 kcal; b)4,94 × 103 s
5. 13,5 W
7. a) 148 kcal; b) 0,418 s, 3,34 s, 4,19 s, 22,6 s, 0,456 s
9. 33,0 g
10. a) 9,67 litros; b) El petróleo crudo es menos denso que el agua, por lo que flota sobre el agua, exponiéndolo así al oxígeno del aire, que utiliza para quemar. Además, si el agua está debajo del aceite, es menos eficiente para absorber el calor generado por el aceite.
12. a) 319 kcal; b) 2,00 ºC
14. 20,6 ºC
16. 4,38 kg
18. a) 1,57 × 104 kcal; b) 18,3 kW ⋅ h; c) 1,29 × 104 kcal
- Valores indicados a las temperaturas normales de fusión y ebullición a presión atmosférica estándar (1 atm). ↵
- A 37,0 ºC (temperatura corporal), el calor de vaporización Lv para agua es de 2430 kJ/kg o 580 kcal/kg
- A 37,0 ºC (temperatura corporal), el calor de vaporización Lv para agua es de 2430 kJ / kg o 580 kcal/kg