A Microbial Biorealm page on the genus Enterococcus faecalis
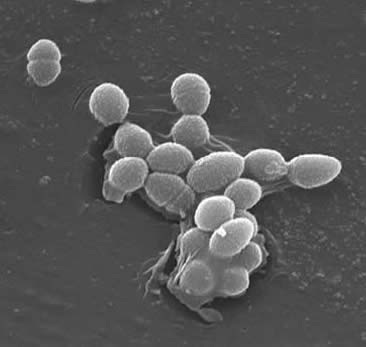
Classification
Higher order taxa
Bacteria; Firmicutes; Bacilli; Lactobacillales; Enterococcaceae; Enterococcus
Especie
Enterococcus faecalis
Descripción e importancia
Los enterococos son cocos grampositivos que pueden sobrevivir a duras condiciones en la naturaleza. Se pueden encontrar en el suelo, el agua y las plantas. Algunas cepas se utilizan en la fabricación de alimentos, mientras que otras son la causa de infecciones humanas y animales graves (por ejemplo, se sabe que colonizan el tracto gastrointestinal y genital de los seres humanos). Están asociados con infecciones adquiridas tanto en la comunidad como en el hospital. Los enterococos pueden crecer a un rango de temperatura de 10 a 42°C y en entornos con valores de pH amplios. Algunos son conocidos por ser móviles. Si bien hay más de 15 especies del género Enterococcus, el 80-90% de los aislados clínicos son E. faecalis (8). Los enterococos suelen formar cadenas cortas o están dispuestos en pares. Sin embargo, bajo ciertas condiciones de crecimiento, se alargan y aparecen como cocobacilares. En general, los enterococos son alfa-hemolíticos. Algunos poseen el antígeno Lancefield del grupo D y se pueden detectar mediante pruebas de aglutinación basadas en anticuerpos monoclonales.Los enterococos son típicamente negativos a la catalasa, y son anaeróbicos. Son capaces de crecer en un 6,5% de NaCl, pueden hidrolizar esculina en presencia de un 40% de sales biliares y son pirrolidonil arilamidasa y leucina arilamidasa positivas (8). Los enterococos han demostrado presentar un desafío terapéutico debido a su resistencia a muchos medicamentos antimicrobianos, «incluidos los agentes activos de la pared celular; aminoglucósidos, penicilina y ampicilina, y vancomicina» (1). Los enterococos tienen la capacidad de adquirir una amplia variedad de factores de resistencia a los antimicrobianos, que presentan serios problemas en el manejo de pacientes con infecciones enterocócicas (8). En general, los aislados enterocócicos con susceptibilidad reducida a la vancomicina se pueden clasificar como vanA, vanB y vanC. vanA y vanB representan la mayor amenaza porque son los más resistentes y los genes de resistencia se transmiten en un plásmido. Dado que los genes de resistencia se transmiten en un plásmido, son fácilmente transferibles, E. faecalis puede transferir estos plásmidos por conjugación (2). E. las heces también son resistentes a la teicoplanina. Se han encontrado cepas enterocócicas que dependen de la vancomicina, pero son raras y menos comunes que las cepas resistentes a la vancomicina (denominadas «enterococos resistentes a la vancomicina» o «ERV») (1).
Estructura del genoma

Debido a muchos peligros para la salud pública, los datos de la secuencia del genoma de una cepa de Enterococo eran necesarios. La cepa elegida para la secuenciación del ADN del genoma fue E. faecalis V583, el primer aislado resistente a vancomicina en los Estados Unidos. El genoma de la cepa V583 fue secuenciado por el Institute for Genome Research (TIGR). El genoma enterocócico muestra que E. faecalis es metabólicamente diverso y contiene una amplia gama de sistemas reguladores. La cepa V583 contiene cuatro moléculas de ADN: el cromosoma bacteriano principal de 3.218.030 pares de bases y tres plásmidos circulares. El cromosoma contiene alrededor de 3.500 marcos de lectura abiertos (ORF), aproximadamente 1/3 de estos ORF no tienen función asignable (8). Los tres plásmidos son moléculas circulares de ADN identificadas como Plásmido-1, Plásmido-2 y Plásmido-3. El plásmido – 1 contiene 66.320 pb, el Plásmido-2 contiene 17.963 pb y el Plásmido-3 contiene 57.660 pb. Los plásmidos codifican una serie de genes, incluyendo transposasas, proteínas de resistencia a múltiples fármacos y un inhibidor del crecimiento regulado por ppGpp (8). La composición promedio de G + C del cromosoma E. faecalis es del 37,38%. Dado que la molécula de ADN es tan grande, se producen desviaciones regionales del promedio. Una de estas ubicaciones es el segmento grande asociado con el «grupo de genes de resistencia a vancomicina posicionado cerca de 2,22 Mb», que muestra un gran aumento en el porcentaje de contenido de G+C (8). Estas diferencias asociadas con la resistencia a los antibióticos o la virulencia sugirieron la adquisición de material genético de una especie extraña a través de la transferencia horizontal. Todavía se desconoce si las transferencias son responsables de las variaciones en la composición del ADN. La información contenida en el genoma de E. faecalis V583 ayudará en gran medida a comprender cómo el organismo se ha adaptado para ser un patógeno humano versátil. Utilizando la genómica comparativa, se comprenderá mejor el papel de los diferentes elementos reguladores en la forma en que responden a las diversas tensiones ambientales y en la expresión de los posibles factores de virulencia (8). Más estudios como estos sugerirán nuevos medicamentos para las infecciones bacterianas causadas por los enterococos.El genoma también contiene 3 operones Ebp (codificación para la endocarditis pili asociada a biopelículas) que son importantes para la producción de biopelículas de la cepa OG1RF de E. faecalis. Esta cepa utiliza estos operones para producir pili de superficie. . Los pili de superficie se utilizan para «la fijación a las superficies del huésped y son antigénicos en humanos durante la endocarditis» (9).
El TIGR contiene una lista completa de genes para los cromosomas de E. faecalis.
Estructura celular y metabolismo
Metabolismo celular
Los enterococos habitan en ambientes hostiles, como el tracto intestinal de humanos y animales. El crecimiento en estas condiciones hostiles requiere que E. faecalis tenga un metabolismo flexible. E. los fecales no solo son capaces de fermentar para producir ácido láctico, sino que también pueden «catabolizar un espectro de fuentes de energía a partir de carbohidratos, glicerol, lactato, malato, citrato, diaminoácidos y maniacetoácidos» (3).Se ha demostrado que en condiciones de crecimiento seleccionadas E. faecalis puede mejorar el crecimiento a través de la fosforilación oxidativa utilizando una fuerza motriz de protones establecida por transporte de electrones. Una consecuencia de la «respiración naciente es la producción de oxidantes potentes» (por ejemplo, superóxido y peróxido de hidrógeno), el estrés oxidativo que E. faecalis puede tolerar (3). La tolerancia a este estrés, combinada con otras condiciones de crecimiento severas, permite que E. faecalis crezca a 10 a 45°C, en sales biliares, y a pH extremadamente bajos y altos. Además, E. faecalis puede resistir la azida, los detergentes, los metales pesados y el etanol. Dado que E. faecalis puede utilizar diversas fuentes de azúcar, puede vivir en diversos entornos, especialmente en el intestino, donde los nutrientes son limitados (2). En el intestino, E. faecalis obtiene la mayor parte de su energía de la fermentación de azúcares no absorbidos. E. las heces también pueden obtener energía degradando las mucinas, un carbohidrato que está fuertemente glicosilado y producido por las células de las copas intestinales (2).El E. faecalis utiliza un «sistema de fosfoenolipiruvato fosfotransferasa (PTS) para detectar azúcares fuera de la célula y acoplar la absorción de azúcares con fosforilación» (2). Al hacerlo, se desperdicia menos energía (ATP) en comparación con la forma en que el azúcar se acumula en sistemas sin PTS. Los azúcares metabolizados por E. faecalis son: D-glucosa, D-fructosa, lactosa, maltosa (todos los sustratos de PTS). En enterococos, el STP también regula el metabolismo del glicerol, la expulsión de inductores y la represión de catabolitos (8). E. faecalis es una de las pocas bacterias grampositivas con bajo contenido de G+C que expulsan azúcar durante el crecimiento de glucosa, un fenómeno conocido como expulsión de inductores (8). E. faecalis puede incluso fermentar glicerol en condiciones aeróbicas y microaerófilas. E. faecalis también puede crecer con glicerol en condiciones anaeróbicas porque » expresa un gen para la actividad anaeróbica de la glicerol deshidrogenasa ligada a NAD+» (8). El glicerol puede atravesar la membrana celular usando una proteína llamada facilitador de difusión de glicerol (GlpF, por sus siglas en inglés). El GlpF hace que la concentración de glicerol dentro y fuera de la célula sea igual, la proteína se inhibe por glucólisis. E. faecalis es capaz de vivir en un pH alcalino extremo y una alta concentración de sal. Estos rasgos requieren transporte de cationes para mantener la composición de iones citosólicos constantes esenciales para la homeostasis. Todas las células deben expulsar el exceso de sodio para mantener las concentraciones citosólicas en un rango que favorezca la homeostasis. E. las heces expresan tanto un antiportador Na+ / H + como una ATPasa de tipo vacuolar (2). El potasio es un catión intracelular importante. La concentración de potasio dentro de E. faecalis de 0,4 a 0,6 M es esencial para el metabolismo celular normal, «neutraliza los aniones intracelulares, activa diversas enzimas y regula el pH citosólico» (8). E. faecalis expresa al menos dos transportadores de potasio para realizar la regulación, KtrI y KtrII junto con el sistema Kep para extrusión K+ (8). Aunque se sabe que KtrI y KtrII son sistemas de captación K+ (son simportadores K+ / H+), poco más se sabe de las proteínas.
Estructura celular
Los enterococos son cocos grampositivos que típicamente forman cadenas cortas o están dispuestos en pares (3). Bajo ciertas condiciones de crecimiento, pueden alargarse y aparecer como cocobacilares. La pared celular de E. faecalis es del 20 al 38% del peso de la célula seca (en las células de fase exponencial y estacionaria). Dado que la E. faecalis es una bacteria grampositiva, hay tres componentes principales que componen su pared celular: peptidoglicano, ácido teicoico y polisacárido. el 40% de la pared celular se compone de peptidoglicano, mientras que el resto de la pared celular se compone de un «polisacárido que contiene ramnosa y un ácido teicoico que contiene ribitol» (3). El peptidioglicano funciona (como en la mayoría de las células grampositivas) para resistir el estallido inducido por una alta presión osmótica citoplasmática. E. faecalis es generalmente considerado un organismo no encapsulado, demostrado por la «falta de fenotipo mucoide detectable» (3). Sin embargo, subconjuntos de aislados de E. faecalis poseen un polisacárido capsular. E. las heces pueden intercambiar material genético (plásmidos) mediante procesos de conjugación inducidos por pequeñas feromonas peptídicas (2). Las «sustancias de agregación de proteínas de superficie que reconocen un ligando específico en las células receptoras» aseguran conexiones exitosas para la conjugación (2).E. faecalis también tiene la capacidad de hacer pili de superficie que puede conducir a la formación de una biopelícula. Las cepas de E. faecalis que causan endocarditis contienen grandes cantidades de estos pili. Los pili permiten la fijación a las superficies del huésped (por ejemplo, el tejido del corazón). Las cepas de E. las heces que causan endocarditis producen la «biopelícula significativamente más a menudo y también en mayor grado que los aislados no endocarditis» (9).
Ecología
E. faecalis es una especie muy diversa de enterococos. Interactúa con muchos otros organismos y tiene efectos en el medio ambiente. Los enterococos son miembros de la comunidad bacteriana que habita el intestino grueso en los seres humanos. También son una parte natural de la flora intestinal en la mayoría de los otros mamíferos y aves (8). Los enterococos también se encuentran en el suelo, las plantas y el agua. Cuando se encuentran en el agua es típicamente porque el agua había sido contaminada con materia fecal. Aunque E. faecalis no aparece con demasiada frecuencia en las plantas, se han encontrado otras cepas de enterococos entre las plantas y es muy probable que lo hagan en una fuente de agua contaminada (8).La ecología de la resistencia a los antibióticos y la transferencia de genes de virulencia en el medio ambiente todavía no se conoce bien. Los insectos, como las moscas domésticas (HF), que se desarrollan en material orgánico en descomposición pueden transmitir bacterias resistentes a los antibióticos del estiércol de animales y otros sustratos orgánicos en descomposición a entornos residenciales (7). Los HF son transmisores perfectos debido a las comunidades microbianas vivas presentes en los hábitats donde se desarrollan (por ejemplo, heces). A las buenas cualidades de transferencia se suman la forma en que la HF alimenta a sus crías (regurgitación) y su atracción por la comida humana. Dado que la HF puede volar largas distancias, este insecto es muy bueno para propagar bacterias fecales, incluidos patógenos humanos y animales, y posiblemente cepas de enterococos resistentes a los antibióticos (7). Un estudio reciente examinó la resistencia a los antibióticos y los genes de virulencia en enterococos de IC en restaurantes de comida rápida en Kanasas. Este estudio demostró que «las moscas domésticas en instalaciones de manipulación y servicio de alimentos pueden transportar enterococos resistentes a los antibióticos y potencialmente virulentos que tienen la capacidad de transferir horizontalmente genes de resistencia a los antibióticos a otras bacterias» (7).Los efectos que E. las heces tienen en el medio ambiente tienden a ser más negativas. Por lo general, contaminan los suministros de agua que pueden provocar plantas infectadas, así como infecciones en las personas (8). Los factores antibióticos también pueden ser transportados por varios insectos (por ejemplo, moscas domésticas) y animales, lo que lleva a un número creciente de E. faecalis virulentos.
Patología
Los enterococos han surgido como una de las principales causas de infecciones nosocomiales, y dentro de este grupo, Enterococcus faecalis causa la mayoría de las infecciones enterocócicas humanas. Estas infecciones pueden ser locales o sistemáticas e incluyen infecciones urinarias y abdominales, infecciones de heridas, bacteriemia y endocarditis (2). Dado que E. faecalis es capaz de sobrevivir a numerosos desafíos ambientales (como temperaturas extremas y la presencia de sales biliares) y debido a que pueden adquirir resistencia a múltiples antibióticos, estas bacterias se han convertido en un gran problema de salud. El sistema Nacional de Vigilancia de Infecciones Nosocomiales (NNIS, por sus siglas en inglés) ha informado de aumentos en la incidencia de infecciones debidas a enterococos resistentes a la vancomicina (ERV) desde 1989 (1). Esto puede significar problemas de salud graves, que incluyen la falta de terapia antibiótica disponible para las infecciones por ERV, porque la mayoría de las cepas de ERV albergan resistencia a múltiples antibióticos además de la vancomicina (por ejemplo, aminogliscoides y ampicilina). La transferencia de genes resistentes a la vanocmicina del ERV a otros patógenos grampositivos es un grave problema de salud pública. La forma más común en que la infección por E. faecalis se produce en un hospital o centro de atención a largo plazo es la transmisión de E. faecalis entre pacientes (8). Los enterococos pueden llevarse en las manos de los trabajadores de la salud y transportarse (transferirse) de un paciente a otro. Se ha demostrado que la ERV en las manos puede persistir hasta 60 minutos (8). La transmisión de las manos de un trabajador de la salud al paciente podría tener lugar al entrar en contacto con los catéteres intravenosos o urinarios del paciente. Los termómetros rectales, que no se limpian adecuadamente después de su uso, también pueden transmitir el ERV de un paciente a otro. A veces, la transmisión puede resultar en la colonización del tracto gastrointestinal del paciente con la cepa adquirida. La nueva cepa pasa a formar parte de la flora endógena del paciente (8). La cepa adquirida, portadora de genes de resistencia a los antibióticos, es capaz de vivir en el tracto gastrointestinal. Las infecciones surgen a partir de estas cepas de E. faecalis recién adquiridas.E. faecalis puede causar muchas infecciones en el cuerpo humano. La infección más común causada por enterococos es la infección del tracto urinario. E. faecalis puede causar infecciones del tracto urinario inferior (U), como cistitis, prostatitis y epididimitis (8). E. faecalis también se encuentra en infecciones intraabdominales, pélvicas y de tejidos blandos. La E. las heces pueden causar bacteriemia nosocomial. La fuente de bacteriemia es con mayor frecuencia el tracto urinario, que se produce a partir de un catéter intravenoso infectado. La endocarditis es la infección enterocócica más grave, ya que causa inflamación de las válvulas cardíacas. En muchos casos de endocarditis, el tratamiento con antibióticos falla y es necesaria una cirugía para extirpar la válvula infectada (8). Las infecciones menos comunes causadas por E. faecalis incluyen meningitis, hematógena, osteomielitis, artritis séptica y (muy raramente) neumonía. Debido a la resistencia de los enterococos a muchos antibióticos, el tratamiento de estas infecciones es difícil.
Aplicación a la biotecnología
Los enterococos se han estudiado para su posible uso como probiótico (un suplemento dietético que contiene células microbianas vivas no virulentas que, cuando se ingieren, se cree que afectan beneficiosamente la composición de la microflora intestinal). Se ha demostrado que la administración de la cepa E. faecalis reduce la diarrea. Los probióticos de E. faecalis se utilizan en la alimentación de pollos, cerdos y ganado para reducir la diarrea en los animales (8).
Debido a las altas propiedades causantes de enfermedades de E. faecalis, se han realizado muchas más investigaciones sobre cómo detener la virulencia de E. faecalis que el uso beneficioso de E. faecalis.
Investigación actual
1.) Esperanza de infecciones causadas por Enterococcus faecalis (4)
Se sabe que las bacterias resistentes a la vancomicina (por ejemplo, faecalis) plantean muchos problemas a la sociedad, causando infecciones bacterianas en los seres humanos que son difíciles de tratar. Las infecciones enterocócicas son un desafío porque los organismos tienen la capacidad de adquirir y diseminar rápidamente genes de resistencia. Ceftobiprol (BPR) se utilizó como cefalosporina de investigación contra cocos grampositivos. La BPR es una cefalosporina parenteral de amplio espectro con altas afinidades de proteínas de unión a penicilina Gram-positivas y Gram-negativas. También muestra estabilidad frente a la hidrólisis por β-lactamasas.En este estudio se examinó la actividad de BRP frente a una gran colección de E. faecalis y se analizó la actividad bactericida de BPR frente a aislados resistentes a vancomicina. El estudio encontró que la susceptibilidad a la RBP en E. faecalis no se ve afectada por la presencia de resistencia a vancomicina o por la producción de β-lactamasa. En las cepas de E. faecalis que mostraron resistencia a vancomicina (fenotipos VanA y VanB) o resistencia a ampicilina, la RBP fue bactericida. Los investigadores demostraron que el BPR exhibía actividad bactericida contra E. faecalis a una dosis de 750 mg, inhibiendo el 100% de la actividad de E. faecalis. Aunque la presencia de la enzima β-lactamasa es rara en E. faecalis, su presencia compromete el uso de los β-lactámicos antienterocócicos más eficaces (por ejemplo, ampicilina). La BPR es un sustrato pobre para la enzima β-lactamasa, lo que explica su excelente actividad contra la E. faecalis productora de β-lactamasa.Esta investigación demostró que la RBP tiene una potente actividad contra una colección muy grande de E. faecalis. La actividad de la RBP no se vio afectada por la resistencia a la vancomicina ni por la producción de β-lactamasa. Por lo tanto, el BPR es un agente esperanzador para su uso en el tratamiento de las infecciones por E. faecalis resistentes a la vancomicina y productoras de β-lactamasa en humanos.
2.) Examinar cómo Enterococcus faecalis se vuelve resistente al medicamento linezolid (5)
Cuando se usan antibióticos en el tratamiento de una infección bacteriana, pueden tener un impacto en la flora intestinal. Las bacterias resistentes se pueden seleccionar durante el tratamiento, como los enterococos, y son potencialmente patógenas. La aparición de resistencia es un problema para los nuevos antibióticos, ya que podría poner en riesgo la utilidad de los antibióticos.Este estudio examinó la aparición de resistencia a los antibióticos por E. faecalis. Más específicamente, los investigadores analizaron la resistencia al linezolid (el primero de una nueva clase de antibióticos conocidos como «oxazolidinonas»). Linezolid se puede usar contra cocos grampositivos resistentes a múltiples medicamentos, incluido el ERV. Inhibe la síntesis de proteínas bacterianas al unirse específicamente a un dominio en la subunidad ribosómica de los años 50 y no se ve afectada por los mecanismos de resistencia que afectan a otros antibióticos. Este estudio analizó la tasa de aparición de mutantes de E. faecalis resistentes a linezólidos en el tracto digestivo de ratones gnotobióticos. Las eod de linezolid se alimentaron en agua con dosis que variaban de 0,5, 0,005 a 0,005 g / L. Todos los mutantes dependían del linezolid administrado, los niveles de resistencia aumentaban con la duración de la exposición. No se aislaron mutantes en ausencia de linezolid, lo que sugiere que la resistencia de novo a linezolid era poco frecuente en los enterococos.La investigación encontró que una mutación en un único gen 23S rRNA fue el paso crítico en la aparición de resistencia a linezolid. Se observó colonización primaria con mutantes de mutación única a los 5 días del inicio del tratamiento en ratones.Estos experimentos con ratones ayudan a explicar el patrón de aparición de resistencia al linezolid observado en aislados clínicos. El equipo de investigación demostró que la dosis es crítica para la dinámica de la resistencia. Estos hallazgos deben ayudar a definir las mejores estrategias terapéuticas para minimizar la aparición de resistencia en el entorno clínico, posiblemente salvando muchas vidas.
3. Se ha encontrado que una quinasa Ser/Thr en Enterococcus faecalis es mediadora de la resistencia antimicrobiana (6)
Enterococcus faecalis causa muchas de las infecciones resistentes a los antibióticos en los hospitales, una consecuencia de su resistencia inherente a ciertos antibióticos y de su capacidad para sobrevivir y proliferar en el tracto intestinal.La base genética de la resistencia vista en E. faecalis no es bien conocido, esta investigación intenta identificar una causa de la resistencia. Los investigadores demostraron que el PrkC, una proteína de señalización de un componente que contiene un dominio de quinasa Ser/Thr de tipo eucariótico, permitía la resistencia antimicrobiana inherente y la persistencia intestinal de E. faecalis. Encontraron que un mutante de E. faecalis que carecía de PrkC creció a un ritmo de tipo salvaje en ausencia de estrés antimicrobiano, pero mostró una mayor sensibilidad a los compuestos activos de la envoltura celular, incluidos los antibióticos que se dirigían a la biogénesis de la pared celular y los detergentes biliares.PrkC regula los procesos fisiológicos en E. faecalis que son clave para su éxito como patógeno nosocomial. La estructura predecida por los investigadores del PrkC era un dominio de cinasa citoplasmática separado por un segmento transmembrana que se cree que se une a peptidoglicano no cruzado. Esto sugirió que el PrkC era un receptor transmembrana que monitorea la integridad de la pared celular de E. faecalis y media las respuestas adaptativas para mantener esa intergridad. PrKC es importante para E. heces para causar infecciones nosocomiales, lo que sugiere que la proteína de señalización es un objetivo para el desarrollo de terapias para prevenir infecciones por enterococos resistentes a los antibióticos.
1.) I. T. Paulsen, L. Banerjei, G. S. A. Myers, K. E. Nelson, R. Seshadri, T. D. Read, D. E. Fouts, J. A. Eisen, S. R. Gill, J. F. Heidelberg, H. Tettelin, R. J. Dodson, L. Umayam, L. Brinkac, M. Beanan, S. Daugherty, R. T. DeBoy, S. Durkin, J. Kolonay, R. Madupu, W. Nelson, J. Vamathevan, B. Tran, J. Upton, T. Hansen, J. Shetty, H. Khouri, T. Utterback, D. Radune, K. A. Ketchum, B. A. Dougherty, C. M. Fraser. «Role of Mobile DNA in the Evolution of Vancomycin-Resistant Enterococcus faecalis.» Ciencia. Marzo de 2003. Vol. 299, Nº 5615. p. 2071-2074
2.) Murrary BE. Mayo de 1998. «Diversidad entre los enterococos multirresistentes.»Enfermedades Infecciosas Emergentes. Vol. 4, Nº 1. p. 46-65.
3.) De la Maza, Luis M., Marie T. Pezzlo, and Janet T. Shigei. Atlas de Color de Bacteriología Médica. Washington, DC: American Society for Microbiology Press, 2004.
4.) Arias C., Singh K., Panesso D., Murray BE. «Time-Kill and Synergism Studies of Ceftobiprole against Enterococcus faecalis, Including ß-Lactamase-Producing and Vancomycin-Resistant Isolates.»Agentes Antimicrobianos y Quimioterapia. Junio de 2007. Vol. 51, Nº 6. p. 2043-2047.
5.) Bourgeois-Nicolaos N., Massias L., Couson B., Butel MJ, Andremont A., Doucet-Populaire F. «Dose Dependence of Emergence of Resistance to Linezolid in Enterococcus faecalis In Vivo.»The Journal of Infectious Diseases. 2007. Vol. 195. p. 1480-1488.
6.) Kristich C., Wells C., Dunny G. «A eucariotic-type Ser/Thr kinase in Enterococcus faecalis mediates antimicrobial resistance and intestinal persistence.»Proceedings of the National Academy of Sciences of the United States of America. Febrero de 2007. Vol. 104, Nº 9. p. 3508-3513.
7.) Macovei, L., Zurek, L. » Ecology of Antibiotic Resistance Genes: Characterization of Enterococci from Houseflies Collected in Food Settings.»Microbiología Aplicada y Ambiental. Junio de 2006. Vol. 72, Nº 6. p. 4028-4035.
8.) Gilmore, Michael. The Enterococci: Pathogenesis, Molecular Biology, and Antibiotic Resistance (en inglés). Washington, DC: American Society for Microbiology Press, 2002.
9.) Nallapareddy SR, Singh KV, Sillanpää J, Garsin DA, Höök M, Erlandsen SL, Murray BE.. «Endocarditis and biofilm-associated pili of Enterococcus faecalis.»The Journal of Clinical Investigation. Octubre de 2006. Nº 116. p. 2799-2807.
Editado por Richard A. Martínez de UC San Diego, estudiante de Rachel Larsen.