Chemguide: Core Chemistry 14 – 16
Enlaces covalentes dobles y triples
Esta página presenta la posibilidad de enlaces covalentes múltiples (dobles o triples) entre átomos utilizando oxígeno, nitrógeno, dióxido de carbono y eteno como ejemplos. Estos se eligen porque todos se especifican comúnmente en los programas de estudios del Reino Unido para niños de 14 a 16 años.
Asumo que ha leído la página que presenta la vinculación covalente y tiene acceso a una Tabla Periódica como la que puede descargar de este sitio.
Doble enlace en oxígeno
Si busca oxígeno en la Tabla Periódica, encontrará que tiene un número atómico de 8, por lo que el átomo neutro tiene 8 protones y 8 electrones. Estos se arreglarán 2,6.
Así que tienes dos átomos como esto:
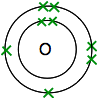
Cada uno tiene dos electrones no apareados. Para obtener la máxima estabilidad energética, todos estos deberán emparejarse.
Así que los oxígenos comparten dos pares de electrones:
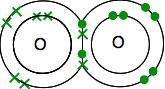
Esto es mucho más fácil de ver usando líneas para representar pares de electrones compartidos:
![]()
Enlace triple en nitrógeno
Si encuentra nitrógeno en la Tabla Periódica, podrás averiguar que su estructura electrónica es 2,5. Comparándolo con el oxígeno, por lo tanto, tiene un par de electrones y tres electrones no emparejados en su nivel exterior.
Para que sea lo más estable energéticamente posible, necesitará emparejar todos estos en enlaces covalentes. Por lo tanto, dos átomos de nitrógeno se combinarán de esta manera:
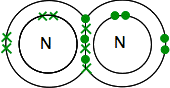
De nuevo, esto es mucho más fácil de ver usando líneas para representar pares de electrones compartidos:
![]()
Doble enlace en dióxido de carbono
La estructura electrónica del carbono es de 2,4 con 4 electrones no apareados en el nivel exterior.
El oxígeno es 2,6 con 2 pares de electrones y 2 electrones no emparejados en el nivel exterior.
Necesitas terminar con todos los electrones emparejados , y solo hay una forma de hacerlo.
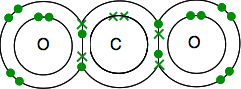
Como antes, el enlace es más fácil de ver usando líneas para unir pares de electrones.
![]()
Si hay dos pares de electrones de enlace entre dos átomos, se llama, como es lógico, un doble enlace. Así que cada oxígeno está unido al átomo de carbono en el medio por un doble enlace.
El doble enlace en eteno, C2H4
El eteno y otros compuestos similares con doble enlace entre átomos de carbono son sustancias importantes en química. Los conocerá con más detalle más adelante en el curso.
Mire cuidadosamente el diagrama de puntos y cruces y asegúrese de comprender cómo encaja todo. Tiene que ser de esta manera para que todos los electrones individuales, tanto en los carbonos como en los hidrógenos, se emparejen en pares de enlace.
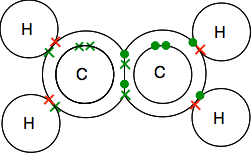
Si encuentra diagramas que muestran los pares de unión como líneas, puede encontrar una de las dos versiones.
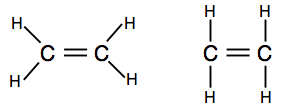
El primero muestra mejor la forma real de la molécula, pero el segundo también es perfectamente aceptable a este nivel.
¿Dónde te gustaría ir ahora?
A la siguiente página de esta sección sobre unión covalente . . .
Al menú estructura atómica y unión. . .
Al menú Química 14-16 . . .
Al Menú Principal de Chemguide . . .