¿Qué es la Unión Iónica?
Los enlaces químicos se forman cuando la energía total de los átomos enlazados es menor que la energía total de los átomos separados.La forma que toma el enlace está determinada por la disposición de electrones que minimiza la energía.
En algunos casos, los electrones se comparten entre los átomos, lo que se denomina enlace covalente.
En otros casos, hay una transferencia completa de uno o más electrones de un átomo a otro.El átomo que pierde electrones se convierte en un ion cargado positivamente.El átomo que recibe electrones se convierte en un ion cargado negativamente.
Esto conduce a la unión iónica, la atracción electrostática mutua de lo positivo y lo negativo charges.In su forma más pura, la unión iónica no es direccional. Puede considerarse como una simple atracción coulombica entre cargas puntuales.Esto es diferente del enlace covalente, en el que el intercambio de electrones resulta en enlaces direccionales.
Transferencia de electrones
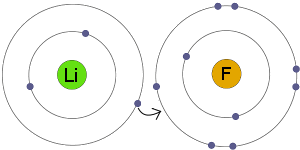
Li transfiere un electrón a F. El resultado es que ambos iones resultantes se vuelven cargados eléctricamente y tienen capas electrónicas completas y estables.
Atracción electrostática
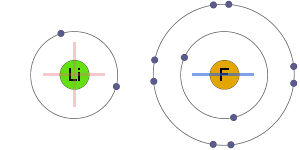
los iones positivos y negativos se atraen electrostáticamente entre sí, lo que resulta en un enlace iónico.
La fuerza coulombica no tiene una dirección preferida, con el resultado de que los compuestos iónicos tienden a existir como estructuras de celosía cristalina gigante de iones empaquetados juntos.
Una muestra de la Red Cristalina de fluoruro de litio

Electronegatividad y Unión Iónica
Dos elementos tenderán a unirse iónicamente cuando difieren ampliamente en electronegatividad.
Tabla Periódica de Electronegatividad
Cuanto más claro sea el tono de verde, mayor será la electronegatividad. Gris significa que no se conoce ningún valor. (Haga clic en la imagen para ampliarla.)

Carácter de unión covalente
Los compuestos de enlace iónico absolutamente puros no existen realmente, porque el ion cargado positivamente polariza la nube de electrones del ion negativo.Esto es particularmente notable cuando se trata de iones metálicos pequeños y altamente cargados como Al3+, aunque el efecto polarizador está presente hasta cierto punto en todos los compuestos iónicos.La polarización es efectivamente un efecto direccional de intercambio de electrones, por lo que introduce una pequeña cantidad de covalencia en los compuestos iónicos.
La proporción de comportamiento iónico/covalente en un enlace puede evaluarse de forma muy aproximada utilizando la escala de Pauling de electronegatividad.Linus Pauling estimó que una diferencia de electronegatividad de 1,7 entre los elementos conduce a un enlace que es 50 por ciento iónico.
Los valores inferiores a 1 corresponden al dominio de la unión covalente y los valores superiores a 2 al dominio de la unión iónica.
Electronegativity of Selected Elements (Pauling Scale)
| Element | Electronegativity |
|---|---|
| hydrogen | 2.20 |
| lithium | 0.98 |
| sodium | 0.93 |
| aluminum | 1.61 |
| carbon | 2.55 |
| oxygen | 3.44 |
| chlorine | 3.16 |
| iodine | 2.66 |
El enlace C-H con una diferencia de 0,35 será covalente, mientras que el enlace NaCl a 2,23 será iónico.La unión de HCl a 0,96 será covalente polar, y la unión de LiI a 1,68 será 50/50 iónico / covalente.
La mayor diferencia de electronegatividad es de 3.19, entre cesio (0.79) y el flúor (3.98). La unión resultante es de aproximadamente un 95 por ciento de carácter iónico.
