Tendencias periódicas y efectos de los disolventes en la nucleofilicidad
Hay tendencias periódicas predecibles en la nucleofilicidad. Moviéndose horizontalmente a través de la segunda fila de la tabla, la tendencia en nucleofilicidad es paralela a la tendencia en basicidad:
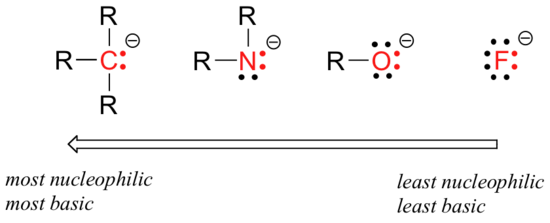
El razonamiento detrás de la tendencia de nucleofilicidad horizontal es el mismo que el razonamiento detrás de la tendencia de basicidad: más elementos electronegativos mantienen sus electrones más firmemente, y son menos capaces de donarlos para formar un nuevo enlace.
Esta tendencia horizontal también nos dice que las aminas son más nucleofílicas que los alcoholes, aunque ambos grupos comúnmente actúan como nucleófilos en reacciones de laboratorio y bioquímicas.
Recordemos que la basicidad de los átomos disminuye a medida que nos movemos verticalmente hacia abajo en una columna de la tabla periódica: los iones tiolato son menos básicos que los iones alcóxido, por ejemplo, y el ion bromuro es menos básico que el ion cloruro, que a su vez es menos básico que el ion fluoruro. Recordemos también que esta tendencia se puede explicar considerando el tamaño creciente de la «nube de electrones» alrededor de los iones más grandes: la densidad electrónica inherente a la carga negativa se extiende alrededor de un área más grande, lo que tiende a aumentar la estabilidad (y por lo tanto reducir la basicidad).
La tendencia periódica vertical para la nucleofilicidad es algo más complicada que la de la basicidad: dependiendo del disolvente en el que tenga lugar la reacción, la tendencia de nucleofilicidad puede ir en cualquier dirección. Tomemos el ejemplo sencillo de la reacción SN2 a continuación:
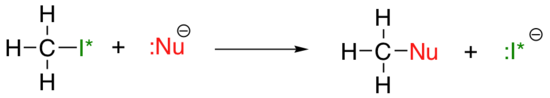
. . .donde Nu-es uno de los iones de haluro: fluoruro, cloruro, bromuro o yoduro, y el grupo saliente I* es un isótopo radiactivo de yodo (lo que nos permite distinguir el grupo saliente del nucleófilo en el caso de que ambos sean yoduro). Si esta reacción ocurre en un solvente protico (es decir, un solvente que tiene un hidrógeno unido a un oxígeno o nitrógeno – agua, metanol y etanol son los ejemplos más importantes), entonces la reacción será más rápida cuando el yoduro es el nucleófilo, y más lenta cuando el fluoruro es el nucleófilo, reflejando la fuerza relativa del nucleófilo.

Nucleofilicidad relativa en un disolvente protico
Esto, por supuesto, es opuesto a la tendencia periódica vertical de basicidad, donde el yoduro es el menos básico. ¿Qué está pasando aquí? ¿No debería la base más fuerte, con sus electrones de valencia no enlazados más reactivos, ser también el nucleófilo más fuerte?
Como se mencionó anteriormente, todo tiene que ver con el disolvente. Recuerde, estamos hablando ahora de la reacción que se ejecuta en un disolvente protico como el etanol. Las moléculas de solvente protico forman interacciones ion-dipolo muy fuertes con el nucleófilo cargado negativamente, creando esencialmente una «jaula de solvente» alrededor del nucleófilo:

Para que el nucleófilo ataque al electrófilo, debe liberarse, al menos en parte, de su jaula de disolventes. Los electrones del par solitario en el ion yoduro más grande y menos básico interactúan menos estrechamente con los protones en las moléculas de solvente protico, por lo que el nucleófilo yoduro es más capaz de liberarse de su jaula de solvente en comparación con el ion fluoruro más pequeño y básico, cuyos electrones del par solitario están unidos más estrechamente a los protones de la jaula.
La imagen cambia si cambiamos a un solvente aprótico polar, como la acetona, en el que hay un dipolo molecular pero no hidrógenos unidos al oxígeno o al nitrógeno. El fluoruro es el mejor nucleófilo, y el yoduro el más débil.
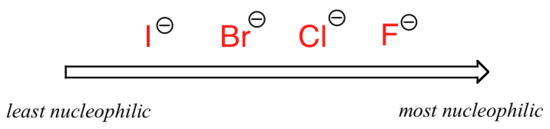
Nucleofilicidad relativa en un solvente aprótico polar
La razón de la inversión es que, con un solvente aprótico, las interacciones ion-dipolo entre el solvente y los nucleófilos son mucho más débiles: el extremo positivo del dipolo del solvente está oculto en el interior de la molécula, y por lo tanto está protegido de la carga negativa del nucleófilo.
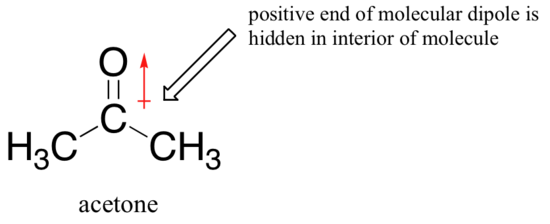
Una interacción disolvente-nucleófilo más débil significa una jaula de disolvente más débil para que el nucleófilo se abra paso, por lo que el efecto disolvente es mucho menos importante, y cuanto más básico sea el ion fluoruro, mejor será el nucleófilo.
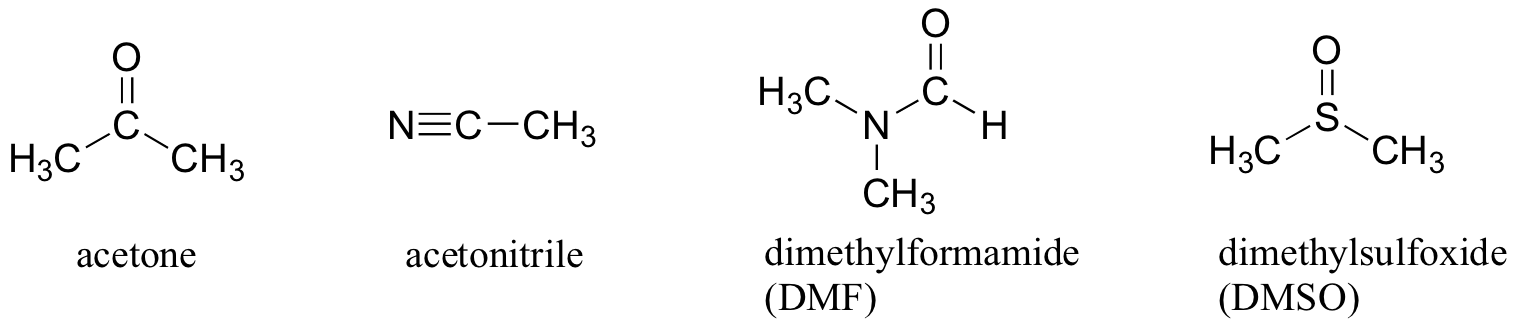
¿Por qué no utilizar un disolvente completamente no polar, como el hexano, para esta reacción, de modo que la jaula del disolvente se elimine por completo? La respuesta a esto es simple: el nucleófilo necesita estar en solución para reaccionar a una velocidad apreciable con el electrofilo, y un solvente como el hexano no solvatará un nucleófilo con carga a (o altamente polar) en absoluto. Es por eso que los químicos utilizan disolventes apróticos polares para reacciones de sustitución nucleofílica en el laboratorio: son lo suficientemente polares para solvatar el nucleófilo, pero no tan polares como para encerrarlo en una jaula de disolventes impenetrable. Además de la acetona, otros tres solventes apróticos polares comúnmente utilizados son el acetonitrilo, la dimetilformamida (DMF) y el sulfóxido de dimetilo (DMSO).
En química biológica, donde el solvente es protico (agua), la implicación más importante de las tendencias periódicas en nucleofilicidad es que los tioles son nucleófilos más poderosos que los alcoholes. El grupo tiol en un aminoácido cisteína, por ejemplo, es un potente nucleófilo y a menudo actúa como nucleófilo en reacciones enzimáticas, y por supuesto los tiolatos cargados negativamente (RS -) son aún más nucleófilos. Esto no quiere decir que los grupos hidroxilo de la serina, treonina y tirosina no actúen también como nucleófilos, sino que lo hacen.