Objetivos
- Soluciones conocidas y desconocidas de los iones metálicos \(\ce{Ag^{+}}\), \(\ce {Fe^{3+}}\), \(\ce{Co^{2+}}\), \(\ce{Cu^{2+}}\) y \(\ce{Hg^{2+}}\) se analizarán mediante cromatografía en papel.
- Una solución desconocida que contenga algunos de estos cationes se identificará en comparación con los valores de Rf y los colores de las manchas de las soluciones conocidas.
La mayoría de los químicos y muchos otros científicos deben separar rutinariamente las mezclas e identificar sus componentes. La capacidad de identificar cualitativamente las sustancias encontradas en una muestra puede ser crítica. Por ejemplo, un químico ambiental que investigue muestras de agua subterránea contaminada querrá saber qué iones tóxicos podrían estar presentes en una muestra.
La cromatografía es una de las primeras herramientas utilizadas en este tipo de situaciones. En esta técnica, muchos tipos de mezclas se pueden separar en el componente sustancias puras; en comparación con una muestra estándar, también se puede identificar tentativamente cada sustancia componente.
Existen muchas variedades de cromatografía, cada una diseñada para separar tipos específicos de mezclas. La característica común de cada tipo de cromatografía es que una fase móvil (un líquido o gas) es empujada a través de una fase estacionaria (un sólido). La Tabla 1 enumera varias variedades de cromatografía e identidades típicas de las fases. En este experimento se utilizará cromatografía en papel.
|
Type of Chromatography |
Mobile Phase |
Stationary Phase |
|---|---|---|
|
Gas (GC) |
inert gas (helium) |
waxy liquid or silicone inside narrow tubing |
|
Liquid |
solvent/solvent Mixture (organic or aqueous) |
solid packing (silica, alumina) |
|
Paper |
solvent/solvent Mixture (organic or aqueous) |
paper |
|
Thin-Layer (TLC) |
solvent/solvent Mixture (organic or aqueous) |
silica/alumina coated glass, plastic or metal |
El ejemplo de cromatografía de columna (Figura 1) muestra las características típicas de esta técnica analítica. El diagrama muestra un experimento en el que una mezcla de dos componentes se somete a cromatografía en columna. La columna está embalada con un material sólido llamado fase estacionaria. Se vierte un disolvente líquido o una solución elusiva en la columna y moja completamente el material de embalaje sólido. Luego, la mezcla se carga en la parte superior de la columna húmeda y se agrega más eluyente. La gravedad tira de la fase móvil hacia abajo a través de la fase estacionaria y los componentes de la mezcla comienzan a moverse a través de la columna a diferentes velocidades. En el diagrama, el componente A se mueve más rápido que el componente B; por lo tanto, el componente B se retiene en la columna durante más tiempo que el componente A. Generalmente esto se debe a una diferencia en la solubilidad de los dos compuestos en el disolvente y/o a una diferencia en la atracción al material de embalaje sólido. A medida que se agrega más eluyente a la parte superior de la columna, los componentes eventualmente saldrán de la columna por separado. El tiempo necesario para salir de la columna, llamado tiempo de retención, será reproducible para cada componente en las condiciones establecidas dadas: identidades de fase móviles y estacionarias, temperatura y ancho de columna. Una vez que los componentes salen de la columna, el disolvente se puede eliminar por evaporación y los componentes puros se pueden analizar o identificar más a fondo.
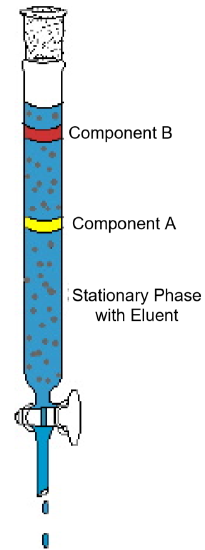
Figura 1: Un experimento típico de cromatografía en columna demuestra la separación de una mezcla de dos componentes.
La identificación tentativa de los componentes puede lograrse comparando la mezcla desconocida con una mezcla conocida cuidadosamente preparada: si un componente conocido tiene el mismo tiempo de retención que un componente desconocido en las mismas condiciones, es probable, pero no concluyente, que los dos componentes sean los mismos. Puede ser necesario un análisis más detallado para confirmar esta hipótesis. Si lo conocido y lo desconocido tienen tiempos de retención diferentes, entonces no es probable que los dos componentes sean idénticos.
Otras variaciones de la cromatografía utilizan la acción capilar, la atracción de un líquido a una superficie sólida, para arrastrar un disolvente a través de un material sólido. Se puede observar una versión informal de la cromatografía de papel cuando una página escrita con tinta entra en contacto con agua u otros líquidos. Las tiradas de tinta y varios colores están separados en la raya de tinta.
El diagrama siguiente (Figura 2) muestra el resultado de un experimento de cromatografía de capa delgada. Dos manchas de tinta negra en la superficie sólida han pasado un disolvente a través de ellas. El disolvente es agua u otro líquido que es arrastrado a través de la fase estacionaria por acción capilar. En este ejemplo, una pieza de plástico recubierta con un sólido en polvo se utiliza como fase estacionaria. Alternativamente, se puede utilizar un trozo de papel de filtro como fase estacionaria. El experimento muestra que la tinta negra es una mezcla que contiene varias sustancias de diferentes colores. Cada componente tiene una solubilidad ligeramente diferente en la fase móvil, por lo que cuando el líquido pasa por la fase estacionaria, cada componente se mueve a una velocidad diferente, separando la tinta en manchas de diferentes colores.

Figura 2: Cromatografía de capa delgada de tinta negra después del desarrollo. Esta imagen muestra un problema común en el que las manchas se ensanchan a medida que se mueven hacia arriba de la placa, finalmente se fusionan en la parte superior de la placa.
En este experimento, se utilizan principios similares para separar varios cationes metálicos mediante un procedimiento de cromatografía en papel. Los iones metálicos- \ (\ce{Ag^{+}}\), \(\ce {Fe^{3+}}\),\(\ce{Co^{2+}}\), \(\ce{Cu^{2+}}\), y \(\ce{Hg^{2+}}\)—tienen diferente solubilidad en la fase móvil—acuosa \(\ce{HCl}\) con alcohol etílico y butílico-y se moverán a diferentes velocidades hacia arriba en el papel. Las diferentes solubilidades de iones metálicos se deben probablemente a la formación de varios compuestos con el ion cloruro y su capacidad variable de disolverse en el solvente orgánico.
A continuación se muestra un diagrama que muestra cómo preparar el papel. Las soluciones estándar que contienen cada uno de estos iones se verán en el papel utilizando un tubo capilar, junto con una solución estándar que contiene los cinco iones. Un desconocido también será visto en el papel. Una vez preparado el papel, se desarrollará colocando el papel en el eluyente. Después de 75-90 minutos, el papel se visualiza humedeciéndolo con una solución acuosa que contiene yoduro de potasio, \(\ce{KI}\), y ferrocianuro de potasio, \(\ce{K4}\). El color único observado para cada ion se produce mediante una reacción química con la solución de visualización. Esta es una forma útil de identificar qué iones están presentes en una mezcla desconocida.
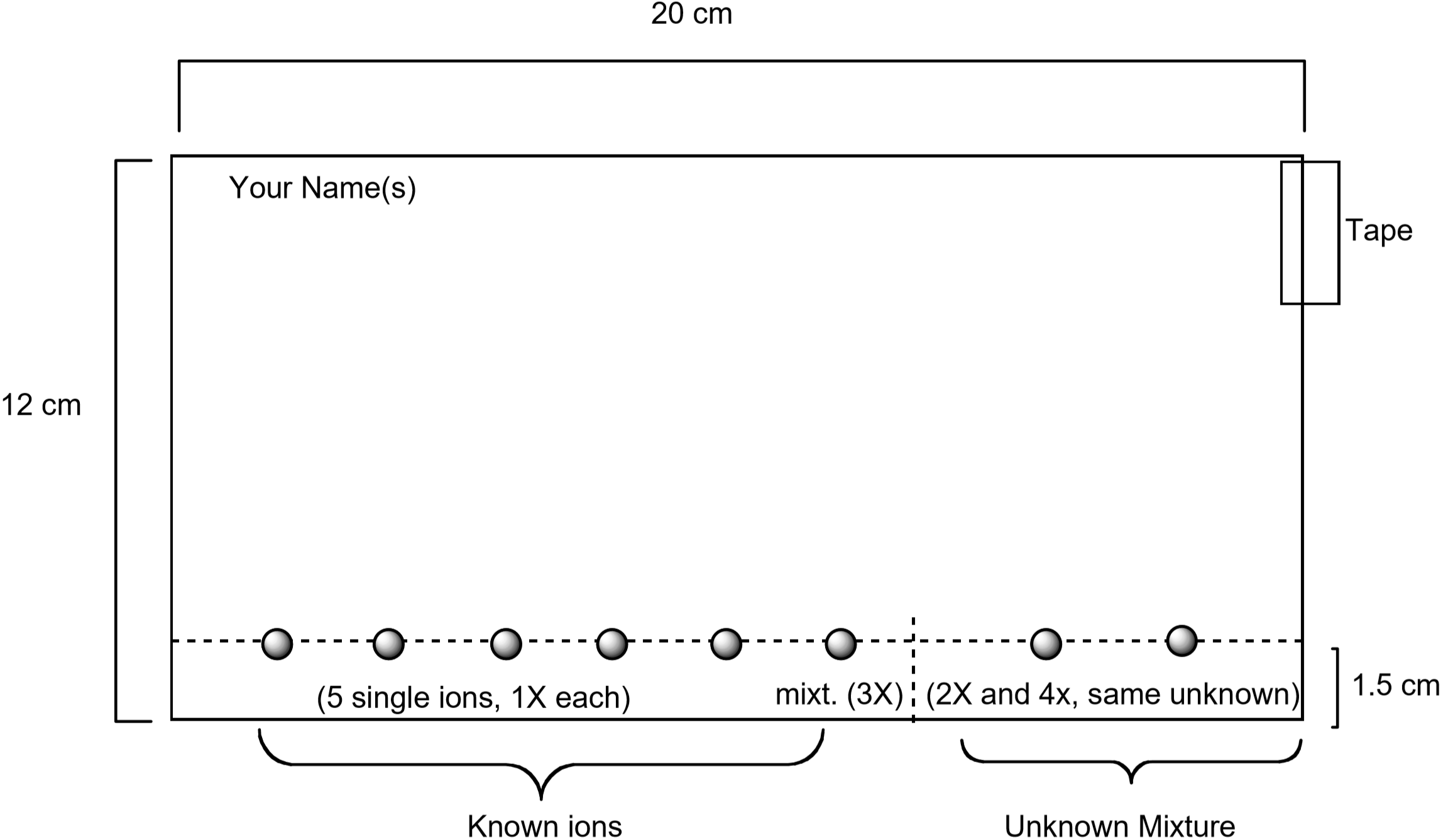
Figura 3: Diagrama que muestra cómo preparar el papel para el experimento de cromatografía
La distancia que el ion se mueve hacia arriba en el papel también se puede usar para identificar el ion. Sin embargo, dado que los estudiantes desarrollarán sus experimentos de cromatografía durante diferentes cantidades de tiempo y en condiciones ligeramente diferentes, cada estudiante tendrá una distancia medida algo diferente para un ion determinado. La relación entre la distancia movida por un ion (\(D\)) y la distancia movida por el disolvente (\(F\), frente al disolvente) es característica y debe ser casi la misma para todos los estudiantes. Esta relación se llama Rf, o «factor de retención».»
\
Procedimiento
Materiales y Equipos
productos Químicos: 0.1 M soluciones acuosas de \(\ce{AgNO3}\), \(\ce{Hg(NO3)2}\), \(\ce{Fe(NO3)3}\), \(\ce{Co(NO3)2}\), y \(\ce{Cu(NO3)2}\), cada uno con tubos capilares; liberadores de solución acuosa de \(\ce{HCl}\) con etilo y butilo alcohol); la visualización de la solución (solución acuosa de \(\ce{KI}\) y \(\ce{K4}\)).
Equipo: Papel de cromatografía limpio; guantes desechables de látex (los guantes de nitrilo están disponibles en el almacén para personas con alergias al látex); vaso de precipitados de 600 ml; envoltura de plástico; pinzas o pinzas para precipitados; regla*
* Artículos obtenidos del almacén
Seguridad
Evite el contacto con las soluciones de iones metálicos, el disolvente liberador y la solución de visualización. Use guantes desechables para tocar su cromatograma después de que se produzca la elución y durante el resto del experimento. No respire los vapores del disolvente liberador o de la solución visualizadora. Coloque el cromatograma húmedo sobre una toalla de papel, no directamente sobre el banco de laboratorio. Utilice la solución de visualización solo en el espacio proporcionado por el instructor. Deseche los guantes y el cromatograma en el contenedor de desechos especificado después de que termine el experimento. Lávese bien las manos después del contacto con todas las soluciones de este laboratorio.
Preparación del papel para cromatografía
- Cada pareja de estudiantes debe obtener un trozo de papel de filtro con las dimensiones mostradas en la Figura 3. Asegúrese de que el papel esté limpio y sin rasgaduras ni pliegues. Use un lápiz, no un bolígrafo, y una regla para dibujar una línea a través del papel a un cm del borde largo del papel. Usted detectará las soluciones de iones metálicos en esta línea. Escribe tu nombre a lápiz en la esquina superior izquierda del papel.
- Practique el manchado de agua y / o soluciones de iones en una tira de papel de filtro para que sepa cómo crear manchas del tamaño correcto. Use tubos capilares de vidrio para detectar los iones en el papel. La solución se aplica tocando ligera y rápidamente un tubo capilar que contiene la solución a la línea que dibujó en el papel. Las manchas deben tener entre 5 y 8 mm de diámetro. Las manchas más grandes se extenderán excesivamente durante el experimento y dificultarán el análisis.
- Conocido 0.1 M soluciones acuosas de \(\ce{AgNO3}\), \(\ce{Hg(NO3)2}\), \(\ce{Fe(NO3)3}\), \(\ce{Co(NO3)2}\), y \(\ce{Cu(NO3)2}\) se proporcionan en los tubos de ensayo, cada uno con dos o tres tubos capilares. Comenzando por la izquierda, marque la identidad del ion debajo de cada punto con un lápiz; luego, coloque cuidadosamente cada ion conocido en la línea. Tenga cuidado de evitar contaminar el tubo capilar con otros iones y vuelva a colocar los tubos capilares en el tubo de ensayo correcto. Un tubo de ensayo que contiene una mezcla conocida de los cinco iones también está provisto de un conjunto de tubos capilares. También coloque esta mezcla en la línea. Debido a que esta solución es más diluida que las soluciones conocidas de un solo ion, aplique la mezcla conocida tres veces, dejando que el punto se seque entre cada aplicación. Una lámpara de calor ayudará a secar el lugar más rápidamente.
- También se proporcionan varias incógnitas en tubos de ensayo, junto con tubos capilares. Su instructor le dirá qué desconocido debe usarse. Las incógnitas contendrán entre uno y cuatro cationes, y son más diluidas que las soluciones conocidas de un solo ion. Lo desconocido también tendrá que aplicarse dos y cuatro veces para los dos ensayos, dejando que el punto se seque entre cada aplicación. En caso de error, debe detectar lo desconocido en dos lugares a lo largo de la línea para que haya dos ensayos disponibles para su análisis.
Desarrollo del papel de cromatografía
- Coloque un trozo de cinta a lo largo del borde superior derecho, como se muestra en la Figura 3. Luego, forme un cilindro conectando los dos bordes cortos del papel con la cinta. Asegúrese de que los bordes no se toquen. El documento debe ser similar a la Figura 4.
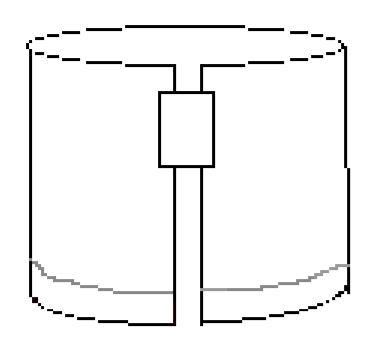
Figura 4: El papel doblado debe tener este aspecto antes de desarrollar el experimento.
- Obtener 15 ml de la solución liberadora. Vierta cuidadosamente un poco de este disolvente en un vaso de precipitados de 600 mL y revuelva cuidadosamente durante uno o dos segundos. Precaución: ¡No respire los vapores de esta solución! Asegúrese de que el nivel del líquido esté por debajo de la línea del punto en el papel una vez que el papel se coloque en la cámara de revelado.
- Coloque el cilindro de papel en el vaso de precipitados con el borde marcado hacia abajo. Las manchas deben estar por encima del nivel del disolvente. El papel no debe tocar los lados del vaso de precipitados. Cubra cuidadosamente el vaso de precipitados con envoltura de plástico y colóquelo en la capucha durante 75-90 minutos. El disolvente debe comenzar a subir por el papel. Una vez que el vaso de precipitados esté cubierto, asegúrese de que esté nivelado y no lo moleste durante el período de desarrollo. Es posible que su instructor tenga una tarea en la que pueda trabajar mientras espera.
Visualización y análisis del papel
- Una vez finalizado el período de desarrollo, use guantes desechables y retire el papel del vaso de precipitados. Los guantes de látex están disponibles en el laboratorio y los guantes de nitrilo están disponibles en el almacén para personas con alergias al látex. Deje que el disolvente vuelva a gotear en el vaso de precipitados y, a continuación, retire la cinta adhesiva. Coloque el papel de cromatografía sobre una toalla de papel e inmediatamente marque el frente del disolvente con un lápiz. Vierta el disolvente eluyente usado en el recipiente de residuos suministrado. Seque el papel bajo una lámpara de calor en el capó. Precaución: ¡No respire los vapores! Tenga cuidado de no quemar el papel debajo de la lámpara.
- Una vez que el papel esté seco, llévelo a la estación de visualización en la toalla de papel. Sumerja brevemente el papel en la solución de visualización ubicada en un plato poco profundo en la campana extractora de humos. Levante el papel de la solución inmediatamente y deje que el exceso gotee en la estación. Coloque el papel mojado sobre una toalla de papel seca y séquelo inmediatamente debajo de una lámpara de calor, luego llévelo a su banco para analizarlo.
- Encuentre primero cada ion único conocido y registre los colores que observe. Algunas manchas pueden desvanecerse con el tiempo, así que graba los colores mientras el papel todavía está mojado. Mida la distancia de cada punto movido, D, con una regla. Mida hasta el centro de cada punto. Registre sus datos en la tabla de datos.
- Mida la distancia al frente del disolvente, F. El valor de F debe ser aproximadamente el mismo en todo el papel. Utilice estos valores para calcular el Rf para cada ion. Haga sus mediciones como se muestra en la Figura 5. Cada punto observado tiene su propio valor de Rf. Registre sus resultados en la tabla de datos.
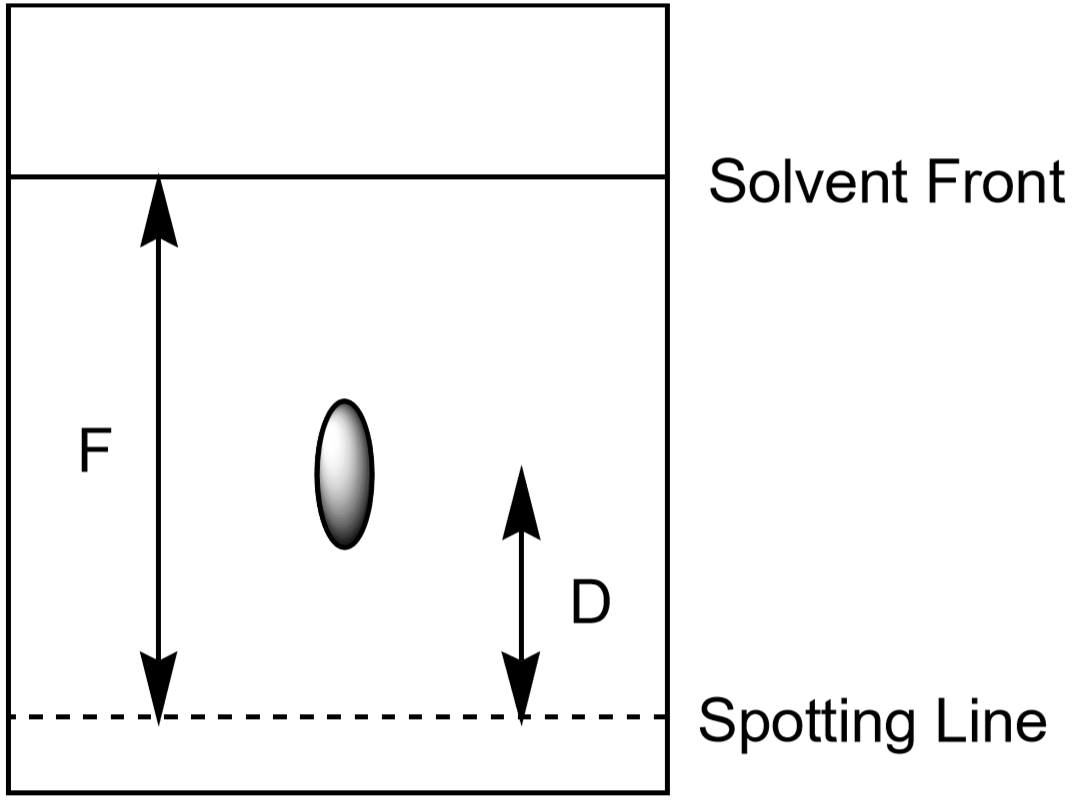
Figura 5: Medición de distancias utilizadas en el cálculo de Rf para un punto.
- En el carril que contiene la mezcla, encuentre cada ion y registre la distancia movida por cada ion. Calcule el Rf para cada ion en este carril. Los valores deben coincidir estrechamente con los observados en los conocidos de iones individuales.
- En el carril que contiene las incógnitas, localice el centro de cada punto observado y registre su distancia y calcule los valores de Rf. Use el carril que tenga los puntos más claros. Los valores de color y Rf para las manchas desconocidas deben coincidir estrechamente con algunos de los iones conocidos. Ahora debería ser capaz de identificar qué ion o iones se encuentran en su desconocido. Registre sus datos en la tabla correspondiente.
- Haga un boceto de su cromatograma en el espacio proporcionado en el formulario de informe de laboratorio, asegurándose de indicar la posición, el tamaño y la forma aproximados de cada punto en el papel. Deseche el papel en el contenedor de residuos.
Limpieza
Coloque el papel de cromatografía y los guantes usados en el contenedor de residuos proporcionado. La solución de elución utilizada ya debe haberse colocado en otro contenedor de residuos. Tenga en cuenta que se proporcionan dos contenedores de residuos diferentes para este experimento, así que asegúrese de leer las etiquetas para que use el correcto. Asegúrese de lavarse bien las manos antes de salir del laboratorio.
Asignación previa al laboratorio: Cromatografía en papel
- Se analiza una mezcla de dos componentes mediante cromatografía en papel. El componente A es más soluble en la fase móvil que el componente B. Se obtiene el siguiente resultado. Calcule el Rf para cada componente y etiquete la identidad de cada punto.
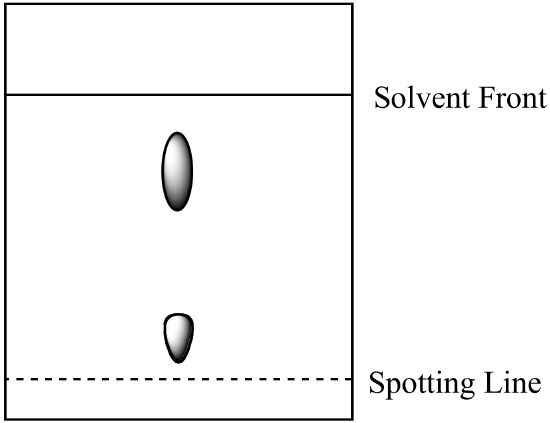
- La mezcla de la pregunta 1 (arriba) se analiza mediante cromatografía en columna utilizando la misma fase móvil y una fase estacionaria de gel de sílice. ¿Qué componente tiene el tiempo de retención más corto? Explica tu respuesta. (Supongamos que el mismo tipo de fuerzas de unión entre los componentes y la fase estacionaria están presentes tanto en la cromatografía en papel como en la cromatografía en columna.)
- Una muestra líquida desconocida se analiza utilizando cromatografía de papel utilizando solvente X como fase móvil. Se observa un punto después de que se desarrolla y visualiza la placa. La misma sustancia desconocida se vuelve a analizar utilizando el disolvente Y como fase móvil. Esta vez, se observan tres puntos después de que se desarrolla y visualiza la placa.
- ¿La muestra desconocida es una sustancia pura o una mezcla? Explique su respuesta, incluyendo una posible razón de las diferentes observaciones en los dos experimentos.
Lab Report for Paper Chromatography
Data, Observations, Calculations and Analysis Known Ions
Known Ions
|
Ion |
Spot Color (Stained) |
D (Single- Ion) |
F (Single- Ion) |
Rf |
D (Ion Mixt.) |
F (Ion Mixt.) |
Rf |
|---|---|---|---|---|---|---|---|
|
\(\ce{Ag^{+}}\) |
|||||||
|
\(\ce{Co^{2+}}\) |
|||||||
|
\(\ce{Cu^{2+}}\) |
|||||||
|
\(\ce{Fe^{3+}}\) |
|||||||
|
\(\ce{Hg^{2+}}\) |
Unknown ID Code _________________
Unknowns
|
Spot Number (from lowest Rr) |
Spot Color (Stained) |
D (Unknown) |
F (Unknown) |
Rf |
Identity of Spot |
|---|---|---|---|---|---|
- Sketch of Chromatogram:
Summary:
| Desconocido el Código de IDENTIFICACIÓN | Iones Identificados |
|---|---|
Preguntas y Conclusiones
- ¿Qué criterios se utilizaron para identificar los iones de litio(s) encontrado en su desconocido? Explica tu respuesta en al menos tres oraciones. Incluya cualquier dificultad en la identificación de iones.
- Si deja que el experimento se ejecute durante solo 30 minutos, ¿cuál sería el resultado probable? ¿Surgirían problemas en la identificación de lo desconocido?
- Si \(\ce{Co^{2+}}\) y \(\ce{Cu^{2+}}\) las manchas fueran del mismo color, ¿sería más difícil identificar un desconocido? Explica tu respuesta.