Objetivos de aprendizaje
Al final de esta sección, podrá:
- Explicar las relaciones entre las cantidades microscópicas y macroscópicas en un gas
- Resolver problemas relacionados con mezclas de gases
- Resolver problemas relacionados con la distancia y el tiempo entre las colisiones de una molécula de gas
- /li>
Hemos examinado la presión y la temperatura en función de sus definiciones macroscópicas. La presión es la fuerza dividida por el área sobre la que se ejerce la fuerza, y la temperatura se mide con un termómetro. Podemos obtener una mejor comprensión de la presión y la temperatura a partir de la teoría cinética de los gases, la teoría que relaciona las propiedades macroscópicas de los gases con el movimiento de las moléculas que los componen. Primero, hacemos dos suposiciones sobre moléculas en un gas ideal.
- Hay un número muy grande de moléculas N, todas idénticas y cada una con masa m.
- Las moléculas obedecen las leyes de Newton y están en movimiento continuo, que es aleatorio e isotrópico, es decir, lo mismo en todas las direcciones.
Para derivar la ley del gas ideal y la conexión entre cantidades microscópicas, como la energía de una molécula típica, y cantidades macroscópicas, como la temperatura, analizamos una muestra de un gas ideal en un recipiente rígido, sobre lo cual hacemos dos suposiciones adicionales:
- Las moléculas son mucho más pequeñas que la distancia media entre ellas, por lo que su volumen total es mucho menor que el de su contenedor (que tiene volumen V). En otras palabras, tomamos la constante de Van der Waals b, el volumen de un mol de moléculas de gas, como insignificante en comparación con el volumen de un mol de gas en el recipiente.
- Las moléculas hacen colisiones perfectamente elásticas con las paredes del recipiente y entre sí. Otras fuerzas sobre ellos, incluyendo la gravedad y las atracciones representadas por la constante a de Van der Waals, son insignificantes (como es necesario para la suposición de isotropía).
Las colisiones entre moléculas no aparecen en la derivación de la ley del gas ideal. Tampoco perturban la derivación, ya que las colisiones entre moléculas que se mueven con velocidades aleatorias dan nuevas velocidades aleatorias. Además, si las velocidades de las moléculas de gas en un recipiente inicialmente no son aleatorias e isotrópicas, las colisiones moleculares son las que las hacen aleatorias e isotrópicas.
Hacemos aún más suposiciones que simplifican los cálculos pero no afectan el resultado. Primero, dejamos que el contenedor sea una caja rectangular. En segundo lugar, comenzamos considerando los gases monoatómicos, aquellos cuyas moléculas consisten en átomos individuales, como el helio. Entonces, podemos suponer que los átomos no tienen energía excepto su energía cinética de traslación; por ejemplo, no tienen ni energía de rotación ni vibratoria. (Más adelante, discutiremos la validez de esta suposición para los gases monoatómicos reales y prescindiremos de ella para considerar los gases diatómicos y poliatómicos.)
Figura \(\pageIndex{1}\) muestra una colisión de una molécula de gas con la pared de un contenedor, de modo que ejerce una fuerza sobre la pared (según la tercera ley de Newton). Estas colisiones son la fuente de presión en un gas. A medida que aumenta el número de moléculas, aumenta el número de colisiones y, por lo tanto, la presión. De manera similar, si la velocidad promedio de las moléculas es mayor, la presión del gas es mayor.
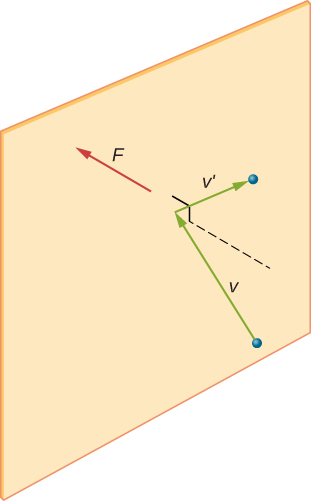
En una muestra de gas en un recipiente, la aleatoriedad del movimiento molecular hace que el número de colisiones de moléculas con cualquier parte de la pared en un tiempo dado fluctúe. Sin embargo, debido a que un gran número de moléculas colisionan con la pared en poco tiempo, el número de colisiones en las escalas de tiempo y espacio que medimos fluctúa solo en una pequeña fracción, generalmente no observable, de la media. Podemos comparar esta situación con la de un casino, donde los resultados de las apuestas son aleatorios y las ganancias del casino fluctúan por minuto y por hora. Sin embargo, durante mucho tiempo, como un año, las ganancias del casino están muy cerca de los promedios esperados de las probabilidades. Un tanque de gas tiene enormemente más moléculas que los apostantes de un casino en un año, y las moléculas hacen enormemente más colisiones en un segundo que las apuestas de un casino.
Un cálculo de la fuerza media ejercida por las moléculas en las paredes de la caja nos lleva a la ley del gas ideal y a la conexión entre la temperatura y la energía cinética molecular. (De hecho, tomaremos dos promedios: uno en el tiempo para obtener la fuerza media ejercida por una molécula con una velocidad dada, y luego otro promedio sobre moléculas con diferentes velocidades. Este enfoque fue desarrollado por Daniel Bernoulli (1700-1782), quien es mejor conocido en física por su trabajo sobre el flujo de fluidos (hidrodinámica). Sorprendentemente, Bernoulli hizo este trabajo antes de que Dalton estableciera la visión de la materia como compuesta de átomos.
La figura \(\pageIndex{2}\) muestra un contenedor lleno de gas y una vista expandida de una colisión elástica de una molécula de gas con una pared del contenedor, dividida en componentes. Hemos asumido que una molécula es pequeña en comparación con la separación de moléculas en el gas, y que su interacción con otras moléculas puede ser ignorada. Bajo estas condiciones, la ley de gas ideal es experimentalmente válida. Debido a que también hemos asumido que la pared es rígida y que las partículas son puntos, la colisión es elástica (por conservación de energía, no hay ningún lugar donde pueda ir la energía cinética de una partícula). Por lo tanto, la energía cinética de la molécula permanece constante, y por lo tanto, su velocidad y la magnitud de su momento también permanecen constantes. Esta suposición no siempre es válida, pero los resultados en el resto de este módulo también se obtienen en modelos que permiten que las moléculas intercambien energía e impulso con la pared.
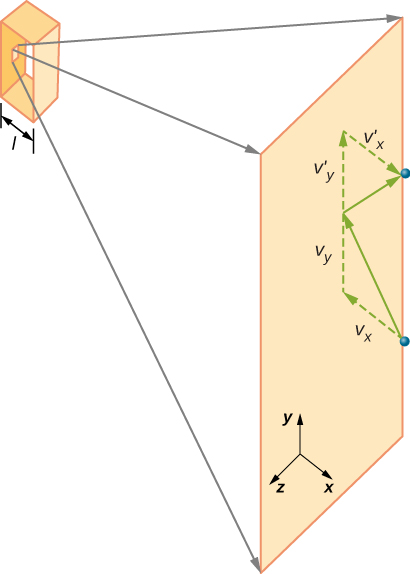
Si la velocidad de la molécula cambia en la dirección x, su momento cambia de \(- m_x\) a \(+mv_x\). Por lo tanto, su cambio en el momento es \(\Delta mv = +mv_x -(-mv_x) = 2mv_x\). De acuerdo con el teorema impulso-momento dado en el capítulo sobre momento lineal y colisiones, la fuerza ejercida sobre la i-ésima molécula, donde i etiqueta las moléculas de 1 a N, viene dada por \
(En esta ecuación solamente, p representa el momento, no la presión.) No hay fuerza entre la pared y la molécula, excepto cuando la molécula está tocando la pared. Durante el corto tiempo de la colisión, la fuerza entre la molécula y la pared es relativamente grande, pero esa no es la fuerza que estamos buscando. Estamos buscando la fuerza media, por lo que tomamos \(\Delta t\) como el tiempo promedio entre colisiones de la molécula dada con esta pared, que es el tiempo en el que esperamos encontrar una colisión. Deje que l represente la longitud de la caja en la dirección x. Entonces \(\Delta t\) es el tiempo que la molécula tardaría en cruzar la caja y volver, una distancia de 2l, a una velocidad de \(v_x\). Así, \(\delta t = 2l / v_x\), y la expresión de la fuerza se convierte en
\
Esta fuerza se debe a una molécula. Para encontrar la fuerza total en la pared, F, necesitamos agregar las contribuciones de todas las moléculas N:
\
Ahora usamos la definición del promedio, que denotamos con una barra, para encontrar la fuerza:
\
Queremos la fuerza en términos de la velocidad v, en lugar de la componente x de la velocidad. Tenga en cuenta que la velocidad total al cuadrado es la suma de los cuadrados de sus componentes, de modo que
\
Con la suposición de isotropía, los tres promedios del lado derecho son iguales, por lo que
\
Sustituyendo esto en la expresión para F da
\
La presión es F/A, por lo que obtenemos
\ donde usamos \(V = Al\) para el volumen. Esto da el resultado importante
\
Combinar esta ecuación con \(pV = Nk_BT\) da
\
Podemos obtener la energía cinética promedio de una molécula, \(\frac{1}{2}m\overline{v}^2\), del lado izquierdo de la ecuación dividiendo N y multiplicando por 3/2.
la Energía Cinética Media por Molécula
La energía cinética media de una molécula es directamente proporcional a su temperatura absoluta:
\
La ecuación \(\overline{K} = \frac{3}{2} k_BT\) es la energía cinética media por molécula. Tenga en cuenta en particular que nada en esta ecuación depende de la masa molecular (o cualquier otra propiedad) del gas, la presión o cualquier otra cosa que no sea la temperatura. Si las muestras de gas de helio y xenón, con masas moleculares muy diferentes, se encuentran a la misma temperatura, las moléculas tienen la misma energía cinética media.
La energía interna de un sistema termodinámico es la suma de las energías mecánicas de todas las moléculas en él. Ahora podemos dar una ecuación para la energía interna de un gas ideal monoatómico. En tal gas, la única energía de las moléculas es su energía cinética de traslación. Por lo tanto, denotando la energía interna por \(E_{int}\) simplemente tenemos \(E_{int} = N\overline{K}\), o
\
A menudo nos gustaría usar esta ecuación en términos de moles:
\
Podemos resolver \(\overline{K} = \frac{1}{2}m\overline{v}^2 = \frac{3}{2}k_BT\) para una velocidad típica de una molécula en un gas ideal en términos de temperatura para determinar lo que se conoce como la velocidad de raíz media cuadrada (rms) de una molécula.
Velocidad RMS de una molécula
La velocidad de la raíz-media cuadrada (rms) de una molécula, o la raíz cuadrada del promedio del cuadrado de la velocidad \(\overline{v}^2\), es
\
La velocidad rms no es el promedio o la velocidad más probable de las moléculas, como veremos en la Distribución de Velocidades Moleculares, pero proporciona una estimación fácilmente calculada de la velocidad de las moléculas que es relacionado con su energía cinética. De nuevo podemos escribir esta ecuación en términos de la constante de gas R y la masa molar M en kg / mol:
\
Nos desviamos por un momento para responder a una pregunta que se le puede haber ocurrido: Cuando aplicamos el modelo a átomos en lugar de partículas puntuales teóricas, ¿cambia la energía cinética rotacional nuestros resultados? Para responder a esta pregunta, tenemos que apelar a la mecánica cuántica. En mecánica cuántica, la energía cinética rotacional no puede tomar cualquier valor; está limitada a un conjunto discreto de valores, y el valor más pequeño es inversamente proporcional a la inercia rotacional. La inercia rotacional de un átomo es pequeña porque casi toda su masa está en el núcleo, que típicamente tiene un radio menor que \(10^{-14} m\). Por lo tanto, la energía de rotación mínima de un átomo es mucho más que \(\frac{1}{2}k_BT\) para cualquier temperatura alcanzable, y la energía disponible no es suficiente para hacer que un átomo gire. Volveremos a este punto cuando discutamos los gases diatómicos y poliatómicos en la siguiente sección.
Ejemplo \(\pageIndex{1}\): Cálculo de la Energía Cinética y la Velocidad de una Molécula de gas
- ¿Cuál es la energía cinética media de una molécula de gas a \(20,0^oC\) (temperatura ambiente)?
- Encuentre la velocidad rms de una molécula de nitrógeno (\(N_2\)) a esta temperatura.
Estrategia
(a) de Los conocidos en la ecuación para la energía cinética media es la temperatura:
\
Antes de sustituir valores en esta ecuación, debemos convertir la temperatura dada en grados kelvin: \(T = (20.0 + 273) \, K = 293 \, K\). Podemos encontrar la velocidad rms de una molécula de nitrógeno usando la ecuación
\
pero primero debemos encontrar la masa de una molécula de nitrógeno. Obteniendo la masa molar de nitrógeno \(N_2\) de la tabla periódica, encontramos
\
Solución
- La temperatura por sí sola es suficiente para que encontremos la energía cinética traslacional promedio. La sustitución de la temperatura en la ecuación de energía cinética traslacional da \
- La sustitución de esta masa y el valor de \(k_B\) en la ecuación de \(v_{rms}\) produce \
Significación
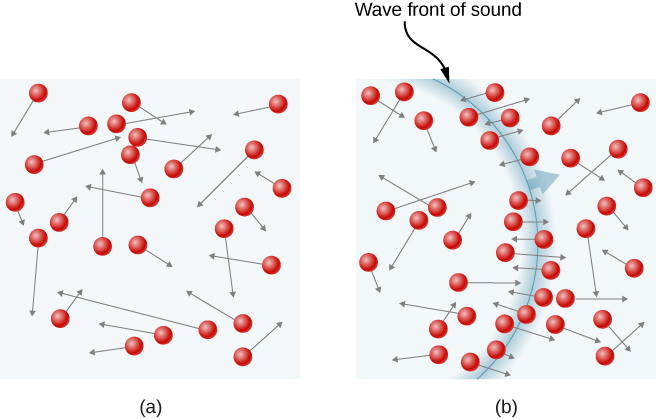
Tenga en cuenta que la energía cinética promedio de la molécula es independiente del tipo de molécula. La energía cinética traslacional promedio depende solo de la temperatura absoluta. La energía cinética es muy pequeña en comparación con las energías macroscópicas, por lo que no sentimos cuando una molécula de aire está golpeando nuestra piel. Por otro lado, es mucho mayor que la diferencia típica en energía potencial gravitacional cuando una molécula se mueve de, por ejemplo, la parte superior a la parte inferior de una habitación, por lo que nuestro descuido de la gravitación se justifica en situaciones típicas del mundo real. La velocidad rms de la molécula de nitrógeno es sorprendentemente grande. Estas grandes velocidades moleculares no producen movimiento macroscópico del aire, ya que las moléculas se mueven en todas las direcciones con la misma probabilidad. La trayectoria libre media (la distancia que una molécula se mueve en promedio entre colisiones, discutida un poco más adelante en esta sección) de las moléculas en el aire es muy pequeña, por lo que las moléculas se mueven rápidamente, pero no llegan muy lejos en un segundo. El alto valor de la velocidad rms se refleja en la velocidad del sonido, que es de aproximadamente 340 m/s a temperatura ambiente. Cuanto mayor sea la velocidad rms de las moléculas de aire, las vibraciones de sonido más rápidas se pueden transferir a través del aire. La velocidad del sonido aumenta con la temperatura y es mayor en gases con pequeñas masas moleculares ,como el helio(véase la Figura \(\pageIndex{3}\)).
Ejemplo \(\pageIndex{2}\): Cálculo de la Temperatura: Velocidad de escape de los átomos de helio
Para escapar de la gravedad de la Tierra, un objeto cerca de la parte superior de la atmósfera (a una altitud de 100 km) debe viajar lejos de la Tierra a 11,1 km/s. Esta velocidad se denomina velocidad de escape. ¿A qué temperatura los átomos de helio tendrían una velocidad rms igual a la velocidad de escape?
Estrategia
Identificar lo conocido y lo desconocido y determinar qué ecuaciones usar para resolver el problema.
Solución
- Identificar los conocidos: v es la velocidad de escape, 11,1 km/s.
- Identificar los desconocidos: Tenemos que resolver para la temperatura, T. También tenemos que resolver para la masa m del átomo de helio.
- Determine qué ecuaciones son necesarias.
- Para obtener la masa m del átomo de helio, podemos utilizar la información de la tabla periódica: \
- Para resolver la temperatura T, podemos reorganizar \ para obtener \
- Sustituir los valores conocidos en las ecuaciones y resolver las incógnitas, \y \
Significación
Esta temperatura es mucho más alta que la temperatura atmosférica, que es de aproximadamente 250 K (\(-25^oC\) o \(-10^oF\)) a alta elevación. Quedan muy pocos átomos de helio en la atmósfera, pero muchos estaban presentes cuando se formó la atmósfera, y siempre se crean más por desintegración radiactiva (ver el capítulo sobre física nuclear). La razón de la pérdida de átomos de helio es que un pequeño número de átomos de helio tienen velocidades más altas que la velocidad de escape de la Tierra, incluso a temperaturas normales. La velocidad de un átomo de helio cambia de una colisión a la siguiente, de modo que en cualquier instante, existe una pequeña pero distinta de cero posibilidad de que la velocidad del átomo sea mayor que la velocidad de escape. La probabilidad es lo suficientemente alta como para que a lo largo de la vida de la Tierra, casi todos los átomos de helio que han estado en la atmósfera hayan alcanzado la velocidad de escape a grandes altitudes y se hayan escapado de la atracción gravitacional de la Tierra. Las moléculas más pesadas, como el oxígeno, el nitrógeno y el agua, tienen velocidades de rms más pequeñas, por lo que es mucho menos probable que cualquiera de ellas tenga velocidades mayores que la velocidad de escape. De hecho, la probabilidad es tan pequeña que se requieren miles de millones de años para perder cantidades significativas de moléculas más pesadas de la atmósfera. La figura \(\pageIndex{4}\) muestra el efecto de la falta de atmósfera en la Luna. Debido a que la atracción gravitatoria de la Luna es mucho más débil, ha perdido casi toda su atmósfera. Las atmósferas de la Tierra y de otros cuerpos se comparan en los ejercicios de este capítulo.

Ejercicio \(\pageIndex{2}\)
Si se considera un objeto muy pequeño, como un grano de polen, en un gas, el número de moléculas que golpean su superficie también sería relativamente pequeño. ¿Esperarías que el grano de polen experimente fluctuaciones en la presión debido a fluctuaciones estadísticas en el número de moléculas de gas que lo golpean en un período de tiempo determinado?
Respuesta
Sí. Tales fluctuaciones en realidad ocurren para un cuerpo de cualquier tamaño en un gas, pero dado que el número de moléculas es inmenso para cuerpos macroscópicos, las fluctuaciones son un pequeño porcentaje del número de colisiones, y los promedios mencionados en esta sección varían imperceptiblemente. En términos generales, las fluctuaciones son inversamente proporcionales a la raíz cuadrada del número de colisiones, por lo que para cuerpos pequeños, pueden llegar a ser significativas. Esto se observó en el siglo XIX para los granos de polen en el agua y se conoce como movimiento browniano.
Presión de vapor, Presión Parcial y Ley de Dalton
La presión que un gas crearía si ocupara el volumen total disponible se denomina presión parcial del gas. Si se mezclan dos o más gases, llegarán al equilibrio térmico como resultado de colisiones entre moléculas; el proceso es análogo a la conducción de calor como se describe en el capítulo sobre temperatura y calor. Como hemos visto en la teoría cinética, cuando los gases tienen la misma temperatura, sus moléculas tienen la misma energía cinética promedio. Por lo tanto, cada gas obedece la ley del gas ideal por separado y ejerce la misma presión sobre las paredes de un contenedor que si estuviera solo. Por lo tanto, en una mezcla de gases, la presión total es la suma de las presiones parciales de los gases componentes, asumiendo un comportamiento ideal del gas y sin reacciones químicas entre los componentes. Esta ley es conocida como la ley de presiones parciales de Dalton, por el científico inglés John Dalton (1766-1844) que la propuso. La ley de Dalton es consistente con el hecho de que las presiones se suman de acuerdo con el principio de Pascal.
En una mezcla de gases ideales en equilibrio térmico, el número de moléculas de cada gas es proporcional a su presión parcial. Este resultado se deriva de la aplicación de la ley del gas ideal a cada uno en la forma \(p / n = RT / V\). Debido a que el lado derecho es el mismo para cualquier gas a una temperatura determinada en un recipiente de un volumen determinado, el lado izquierdo también es el mismo.
- La presión parcial es la presión que un gas crearía si existiera solo.
- La ley de Dalton establece que la presión total es la suma de las presiones parciales de todos los gases presentes.
- Para dos gases cualesquiera (etiquetados 1 y 2) en equilibrio en un contenedor, \(\frac{p_1}{n_1} = \frac{p_2}{n_2}.\)
Una aplicación importante de la presión parcial es que, en química, funciona como la concentración de un gas para determinar la velocidad de una reacción. Aquí, mencionamos solo que la presión parcial de oxígeno en los pulmones de una persona es crucial para la vida y la salud. Respirar aire que tiene una presión parcial de oxígeno por debajo de 0,16 atm puede afectar la coordinación y el juicio, particularmente en personas que no están aclimatadas a una elevación elevada. Las presiones parciales más bajas de \(O_2\) tienen efectos más graves; las presiones parciales por debajo de 0,06 atm pueden ser rápidamente fatales, y es probable que se produzcan daños permanentes incluso si la persona es rescatada. Sin embargo, la sensación de necesidad de respirar, como al contener la respiración, es causada mucho más por altas concentraciones de dióxido de carbono en la sangre que por bajas concentraciones de oxígeno. Por lo tanto, si una habitación pequeña o un armario está lleno de aire con una baja concentración de oxígeno, tal vez porque un cilindro con fugas de gas comprimido está almacenado allí, la persona no sentirá ninguna sensación de «asfixia» y puede entrar en convulsiones o perder el conocimiento sin notar nada malo. Los ingenieros de seguridad prestan considerable atención a este peligro.
Otra aplicación importante de la presión parcial es la presión de vapor, que es la presión parcial de un vapor a la que está en equilibrio con la fase líquida (o sólida, en el caso de sublimación) de la misma sustancia. A cualquier temperatura, la presión parcial del agua en el aire no puede exceder la presión de vapor del agua a esa temperatura, porque cuando la presión parcial alcanza la presión de vapor, el agua se condensa del aire. El rocío es un ejemplo de esta condensación. La temperatura a la que se produce la condensación de una muestra de aire se denomina punto de rocío. Se mide fácilmente enfriando lentamente una bola de metal; el punto de rocío es la temperatura a la que aparece por primera vez la condensación en la bola.
Las presiones de vapor del agua a algunas temperaturas de interés para la meteorología se dan en la Tabla\(\pageIndex{1}\).
| T(\(^oC\)) | Presión de Vapor (Pa) |
|---|---|
| 0 | 610.5 |
| 3 | 757.9 |
| 5 | 872.3 |
| 8 | 1073 |
| 10 | 1228 |
| 13 | 1497 |
| 15 | 1705 |
| 18 | 2063 |
| 20 | 2338 |
| 23 | 2809 |
| 25 | 3167 |
| 30 | 4243 |
| 35 | 5623 |
| 40 | 7376 |
The relative humidity (R.H.) a una temperatura T se define por
\
Una humedad relativa de \(100\%\) significa que la presión parcial del agua es igual a la presión de vapor; en otras palabras, el aire está saturado de agua.
Ejemplo \(\pageIndex{3}\): Calcular la humedad relativa
¿Cuál es la humedad relativa cuando la temperatura del aire es \(25^oC\) y el punto de rocío es \(15^oC\)?
Estrategia
Simplemente buscamos la presión de vapor a la temperatura dada y que en el punto de rocío y encontramos la relación.
Solución
\
Importancia
R. H. es importante para nuestra comodidad. El valor de \(53,8\%\) está dentro del rango de \(40\%\) a \(60\%\) recomendado para la comodidad en interiores.
Como se indica en el capítulo sobre temperatura y calor, la temperatura rara vez cae por debajo del punto de rocío, porque cuando alcanza el punto de rocío o el punto de escarcha, el agua se condensa y libera una cantidad relativamente grande de calor latente de vaporización.
Camino Libre Medio y Tiempo Libre Medio
Ahora consideramos explícitamente las colisiones. El primer paso habitual (que es todo lo que tomaremos) es calcular el camino libre medio, \(\lambda\), la distancia promedio que recorre una molécula entre colisiones con otras moléculas, y el tiempo libre medio \(\tau\), el tiempo promedio entre las colisiones de una molécula. Si asumimos que todas las moléculas son esferas con un radio \(r\), entonces una molécula chocará con otra si sus centros están a una distancia de 2 r entre sí. Para una partícula dada, decimos que el área de un círculo con ese radio, \(4 \ pi r^2\), es la «sección transversal» de las colisiones. A medida que la partícula se mueve, traza un cilindro con ese área de sección transversal. La trayectoria libre media es la longitud \(\lambda\) de forma que el número esperado de otras moléculas en un cilindro de longitud \(\lambda\) y sección transversal \(4\pi r^2\) es 1. Si ignoramos temporalmente el movimiento de las moléculas distintas de la que estamos viendo, el número esperado es la densidad numérica de las moléculas, N/V, veces el volumen, y el volumen es \(4\pi r^2 \lambda\), por lo que tenemos \((N/V)4\pi r^2 \lambda = 1\), o
\
Tener en cuenta el movimiento de todas las moléculas hace que el cálculo sea mucho más difícil, pero el único cambio es un factor de \(\sqrt{2}\). El resultado es
\
En un gas ideal, podemos sustituir \(V/N = k_BT/p\) para obtener
\
La media de tiempo libre \(\tau\) es simplemente el camino libre medio, dividido por una velocidad típica, y la opción habitual es la rapidez rms. Entonces
\
Calculando el tiempo Libre medio
Encuentre el tiempo libre medio para los átomos de argón (\(M = 39,9 \, g/mol\)) a una temperatura de \(0^oC\) y una presión de 1,00 atm. Tomar el radio de un átomo de argón a \(1.70 \times 10^{-10} espacio\m\).
Solución
- Identifique los conocidos y conviértalos en unidades SI. Sabemos que la masa molar es 0.0399 kg / mol, la temperatura es de 273 K, la presión es \(1.01 \ veces 10^5\, Pa\) y el radio es \(1.70 \veces 10^{-10} \, m\).
- Encuentre la velocidad rms: \(v_{rms} = \sqrt {\frac{3RT} {M}} = 413 \, m / s\).
- Sustituto en la ecuación para el tiempo libre medio: \
Significación
Difícilmente podemos comparar este resultado con nuestra intuición sobre las moléculas de gas, pero nos da una imagen de moléculas que chocan con frecuencia extremadamente alta.
Ejercicio \ (\pageIndex{4}\)
Que tiene un camino libre medio más largo, agua líquida o vapor de agua en el aire?
Respuesta
En un líquido, las moléculas están muy juntas, colisionando constantemente entre sí. Para que un gas sea casi ideal, ya que el aire está en condiciones normales, las moléculas deben estar muy separadas. Por lo tanto, el camino libre medio es mucho más largo en el aire.
Colaboradores y atribuciones
-
Samuel J. Ling (Truman State University), Jeff Sanny (Loyola Marymount University) y Bill Moebs con muchos autores colaboradores. Este trabajo está licenciado por OpenStax University Physics bajo una Licencia de Atribución Creative Commons (by 4.0).