Orbitales Moleculares de un Carbocatión alílico
La estabilidad del carbocatión del propeno se debe a un sistema de electrones π conjugado. Un «doble vínculo» no existe realmente. En cambio, es un grupo de 3 orbitales p adyacentes, superpuestos, no hibridados que llamamos un sistema de electrones π conjugado. Se pueden ver claramente las interacciones entre los tres orbitales p de los tres carbonos dando como resultado un catión realmente estable. Todo se reduce a la ubicación del carbono deficiente en electrones.
Las descripciones de orbitales moleculares pueden explicar la estabilidad alílica de otra manera utilizando 2-propenilo. Higo.6
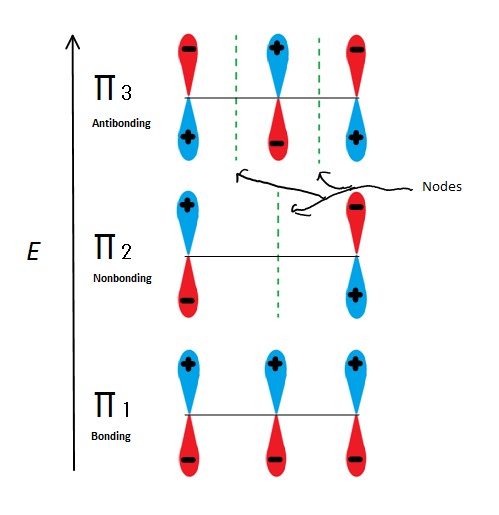
Fig.6 Muestra los 3 orbitales moleculares posibles de 2-propenilo
Si tomamos el orbital molecular π y no cualquiera de los s, obtenemos tres de ellos. π1 está enlazando sin nodos, π2 no es enlazante (en otras palabras, la misma energía que un orbital p regular) con un nodo, y π3 es enlazante con 2 nodos (ninguno de los orbitales interactúa). Los dos primeros electrones entrarán en el orbital molecular π1, independientemente de si se trata de un catión, un radical o un anión. Si es un radical o anión, el siguiente electrón entra en el orbital molecular π2. El último anión electrón entra también en el orbital no enlazante. Así que no importa qué tipo de centro de carbono exista, ningún electrón entrará en el orbital antibonding.
Los orbitales de unión son los orbitales de menor energía y son favorables, por lo que se llenan primero. A pesar de que los orbitales no enlazantes se pueden llenar, la energía general del sistema sigue siendo más baja y más estable debido a los orbitales moleculares de unión llenos.
Esta figura también muestra que π2 es el único orbital molecular donde el electrión difiere, y también es donde un solo nodo pasa a través del centro. Debido a esto, las cargas de la molécula están principalmente en los dos carbonos terminales y no en el carbono medio.
Esta descripción del orbital molecular también puede ilustrar la estabilidad de los centros de carbono alílico en la figura 7.
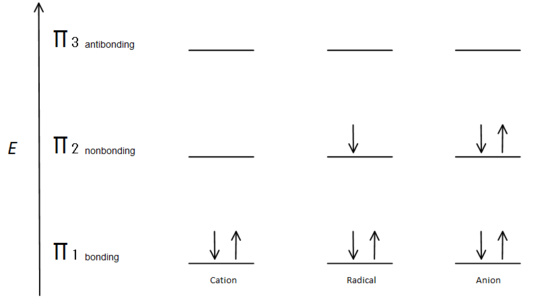
Fig.7 diagrama que muestra cómo se llenan los electrones basado en el principio de Aufbau.
El orbital de enlace π es más bajo en energía que el orbital p no enlazante. Dado que cada centro de carbono mostrado tiene dos electrones en los orbitales π de enlace de energía inferior, la energía de cada sistema se reduce en general (y por lo tanto es más estable), independientemente de cationes, radicales o aniones.