Quellen finden: „Single Bond“ – Nachrichten · Zeitungen · Bücher · scholar · JSTOR (August 2012) (Erfahren Sie, wie und wann Sie diese Vorlagennachricht entfernen können)
In der Chemie ist eine Einfachbindung eine chemische Bindung zwischen zwei Atomen mit zwei Valenzelektronen. Das heißt, die Atome teilen sich ein Elektronenpaar, in dem sich die Bindung bildet. Daher ist eine Einfachbindung eine Art kovalente Bindung. Wenn es geteilt wird, befindet sich jedes der beiden beteiligten Elektronen nicht mehr im alleinigen Besitz des Orbitals, aus dem es stammt. Vielmehr verbringen beide Elektronen Zeit in einem der Orbitale, die sich im Bondprozess überlappen. Als Lewis-Struktur wird eine Einfachbindung als A-A oder A-A bezeichnet, für die A ein Element darstellt (Moore, Stanitski und Jurs 329). In der ersten Darstellung repräsentiert jeder Punkt ein gemeinsames Elektron, und in der zweiten Darstellung repräsentiert der Balken beide Elektronen, die in der Einfachbindung geteilt sind.

Eine kovalente Bindung kann auch eine Doppelbindung oder eine Dreifachbindung sein. Eine Einfachbindung ist schwächer als eine Doppelbindung oder eine Dreifachbindung. Dieser Festigkeitsunterschied kann durch Untersuchung der Komponentenbindungen erklärt werden, aus denen jede dieser Arten von kovalenten Bindungen besteht (Moore, Stanitski und Jurs 393).
Normalerweise ist eine Einfachbindung eine Sigma-Bindung. Eine Ausnahme bildet die Bindung in Dibor, die eine Pi-Bindung ist. Im Gegensatz dazu besteht die Doppelbindung aus einer Sigma-Bindung und einer Pi-Bindung, und eine Dreifachbindung besteht aus einer Sigma-Bindung und zwei Pi-Bindungen (Moore, Stanitski und Jurs 396). Die Anzahl der Komponentenbindungen bestimmt die Festigkeitsdisparität. Es liegt nahe, dass die Einfachbindung die schwächste der drei ist, da sie nur aus einer Sigma-Bindung besteht, und die Doppel- oder Dreifachbindung besteht nicht nur aus dieser Art von Komponentenbindung, sondern auch aus mindestens einer zusätzlichen Bindung.
Die Einfachbindung hat die Fähigkeit zur Rotation, eine Eigenschaft, die die Doppelbindung oder die Dreifachbindung nicht besitzt. Die Struktur von Pi-Bindungen erlaubt keine Rotation (zumindest nicht bei 298 K), so dass die Doppelbindung und die Dreifachbindung, die Pi-Bindungen enthalten, aufgrund dieser Eigenschaft gehalten werden. Die Sigma-Bindung ist nicht so restriktiv, und die Einfachbindung kann sich unter Verwendung der Sigma-Bindung als Rotationsachse drehen (Moore, Stanitski und Jurs 396-397).
Ein weiterer Eigenschaftsvergleich kann in der Bindungslänge vorgenommen werden. Einfachbindungen sind die längsten der drei Arten von kovalenten Bindungen, da die interatomare Anziehung bei den beiden anderen Typen, Doppel- und Dreifachbindungen, größer ist. Die Zunahme der Komponentenbindungen ist der Grund für diese Anziehungszunahme, da mehr Elektronen zwischen den gebundenen Atomen geteilt werden (Moore, Stanitski und Jurs 343).
Einzelbindungen werden oft in zweiatomigen Molekülen gesehen. Beispiele für diese Verwendung von Einfachbindungen umfassen H2, F2 und HCl.
Einzelbindungen werden auch in Molekülen gesehen, die aus mehr als zwei Atomen bestehen. Beispiele für diese Verwendung von Einzelbindungen sind:
- Beide Bindungen in H2O
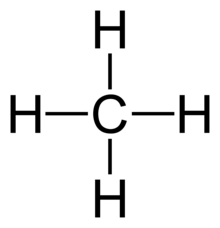
- Alle 4 Bindungen in CH4
Die Einzelbindung tritt sogar in Molekülen auf, die so komplex sind wie Kohlenwasserstoffe, die größer als Methan sind. Die Art der kovalenten Bindung in Kohlenwasserstoffen ist in der Nomenklatur dieser Moleküle äußerst wichtig. Kohlenwasserstoffe, die nur Einfachbindungen enthalten, werden als Alkane bezeichnet (Moore, Stanitski und Jurs 334). Die Namen spezifischer Moleküle, die zu dieser Gruppe gehören, enden mit dem Suffix -ane. Beispiele umfassen Ethan, 2-Methylbutan und Cyclopentan (Moore, Stanitski und Jurs 335).