Das Lewis-Diagramm vieler Moleküle stimmt jedoch nicht mit den beobachteten Eigenschaften des Moleküls überein.
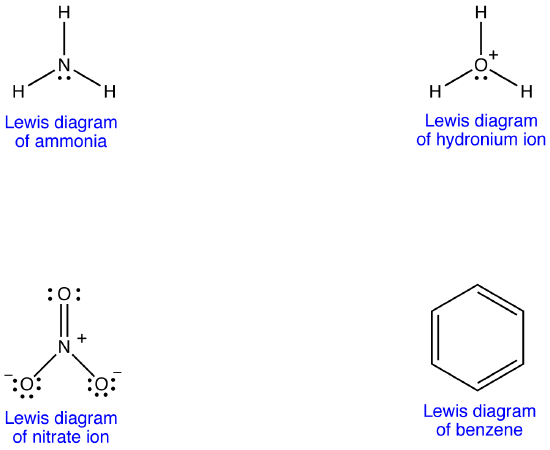
Beispiel 1: Nitrat-Ion
Das Nitrat-Ion hat gemäß seinem Lewis-Diagramm zwei Arten von Stickstoff-Sauerstoff-Bindungen, eine Doppelbindung und zwei Einfachbindungen, was darauf hindeutet, dass eine Stickstoff-Sauerstoff-Bindung im Nitrat-Ion kürzer und stärker ist als jede der beiden anderen. Ebenfalls, Die Lewis-Struktur impliziert, in Bezug auf die formale Ladung, dass es zwei Arten von Sauerstoffatomen im Nitrationion gibt, eine formal neutral und jede der beiden anderen trägt eine formale Ladung von -1. Experimentell haben jedoch die drei Stickstoff-Sauerstoff-Bindungen im Nitrationion die gleiche Bindungslänge und die gleiche Bindungsenergie, und die drei Sauerstoffatome sind nicht zu unterscheiden. Das Lewis-Diagramm erklärt die Struktur und Bindung des Nitrat-Ions nicht zufriedenstellend.
Für das Nitrat-Ion können zwei zusätzliche Lewis-Diagramme gezeichnet werden.
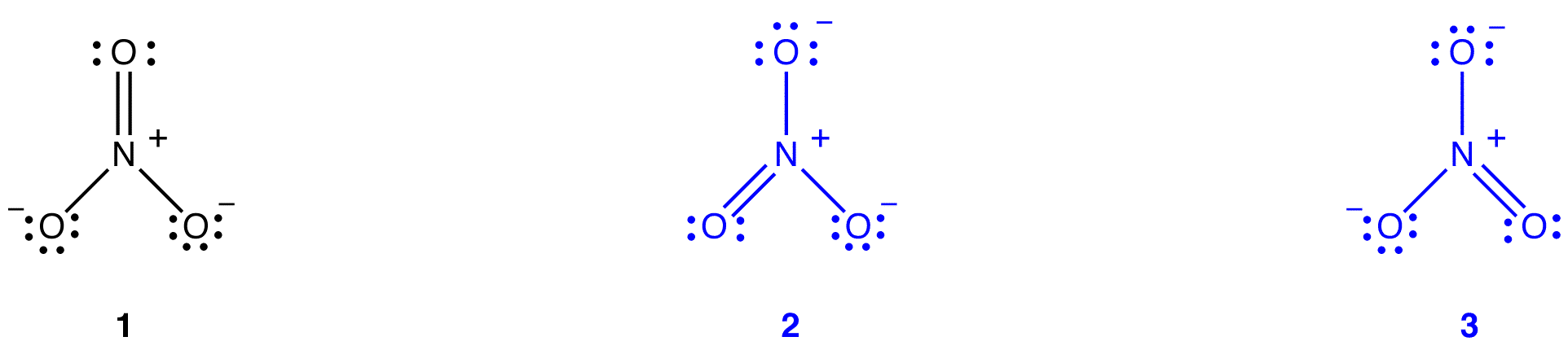
Keiner von ihnen stimmt jedoch mit den beobachteten Eigenschaften des Nitrationens überein und zeigt daher das Nitrationens nicht korrekt an.
Beispiel 2: Benzol hat gemäß seinem Lewis-Diagramm zwei Arten von Kohlenstoff-Kohlenstoff-Bindungen, drei Doppelbindungen und drei Einfachbindungen, was darauf hindeutet, dass jede der drei Kohlenstoff-Kohlenstoff-Bindungen in Benzol kürzer und stärker ist als jede der anderen drei. Experimentell haben jedoch die sechs Kohlenstoff-Kohlenstoff-Bindungen in Benzol die gleiche Bindungslänge und die gleiche Bindungsenergie. Das Lewis-Diagramm erklärt die Struktur und Bindung von Benzol nicht zufriedenstellend.
Ein Attribut von Molekülen, deren klassisches Lewis-Diagramm nicht mit den beobachteten Eigenschaften übereinstimmt, ist, dass andere gültige Lewis-Diagramme für sie generiert werden können. Ein zusätzliches Lewis-Diagramm kann für Benzol gezeichnet werden.

Keiner von ihnen stimmt jedoch mit den beobachteten Eigenschaften von Benzol überein und zeigt daher Benzol nicht korrekt an.
Die Resonanztheorie ist ein Versuch, die Struktur einer Spezies zu erklären, wie das Nitrationion oder Benzol, von denen kein Lewis-Diagramm mit den beobachteten Eigenschaften der Spezies übereinstimmt. Der Hauptvorteil der Resonanztheorie besteht darin, dass die Resonanztheorie, obwohl sie auf einer strengen mathematischen Analyse basiert, erfolgreich unter Berufung auf wenig oder keine Mathematik angewendet werden kann. Die Resonanztheorie wird im Folgenden am Beispiel des Nitrationens erläutert.
Nach der Resonanztheorie ist die Struktur des Nitrat-Ions nicht 1 noch 2 noch 3, sondern der Durchschnitt aller drei, gewichtet nach Stabilität. Lewis-Diagramme 1, 2 und 3 werden als Resonanzformen, Resonanzstrukturen oder Resonanzbeitragende des Nitrationens bezeichnet. Die Struktur des Nitrationens wird als Resonanzhybrid oder einfach als Hybrid der Resonanzformen 1, 2 und 3 bezeichnet. Wann immer es notwendig ist, die Struktur des Nitrationsions zu zeigen, werden die Resonanzformen 1, 2 und 3 gezeichnet, die durch Doppelpfeile verbunden sind.
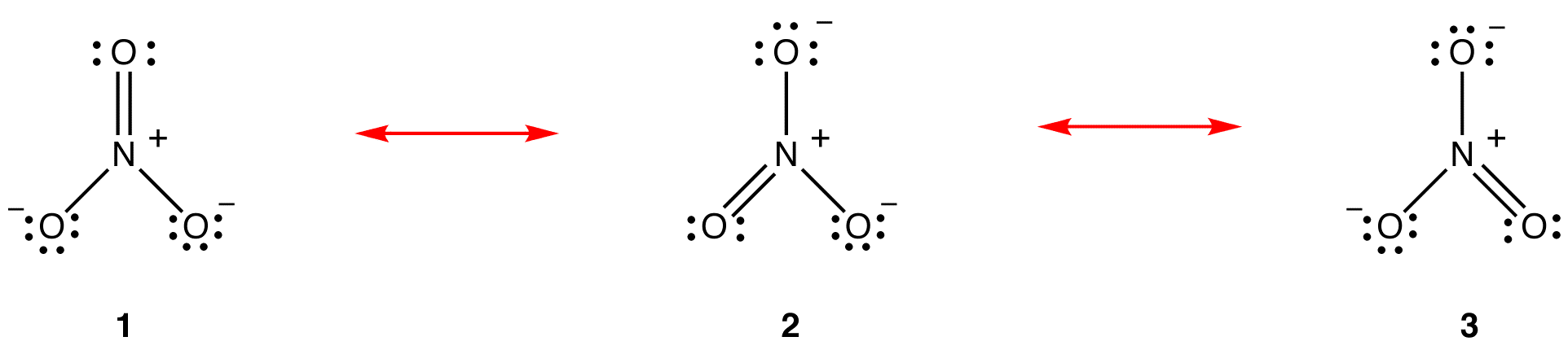
Die drei Resonanzformen des Nitrat-Ions, 1, 2 und 3, sind identisch, haben also die gleiche Stabilität und tragen daher gleichermaßen zum Hybrid bei. Da das genaue Ausmaß, in dem jede Resonanzform des Nitrationens zum Hybrid beiträgt, bekannt ist, Die Bindungsreihenfolge jeder Stickstoff-Sauerstoff-Bindung sowie die formale Ladung an jedem Sauerstoffatom im Hybrid können leicht bestimmt werden:
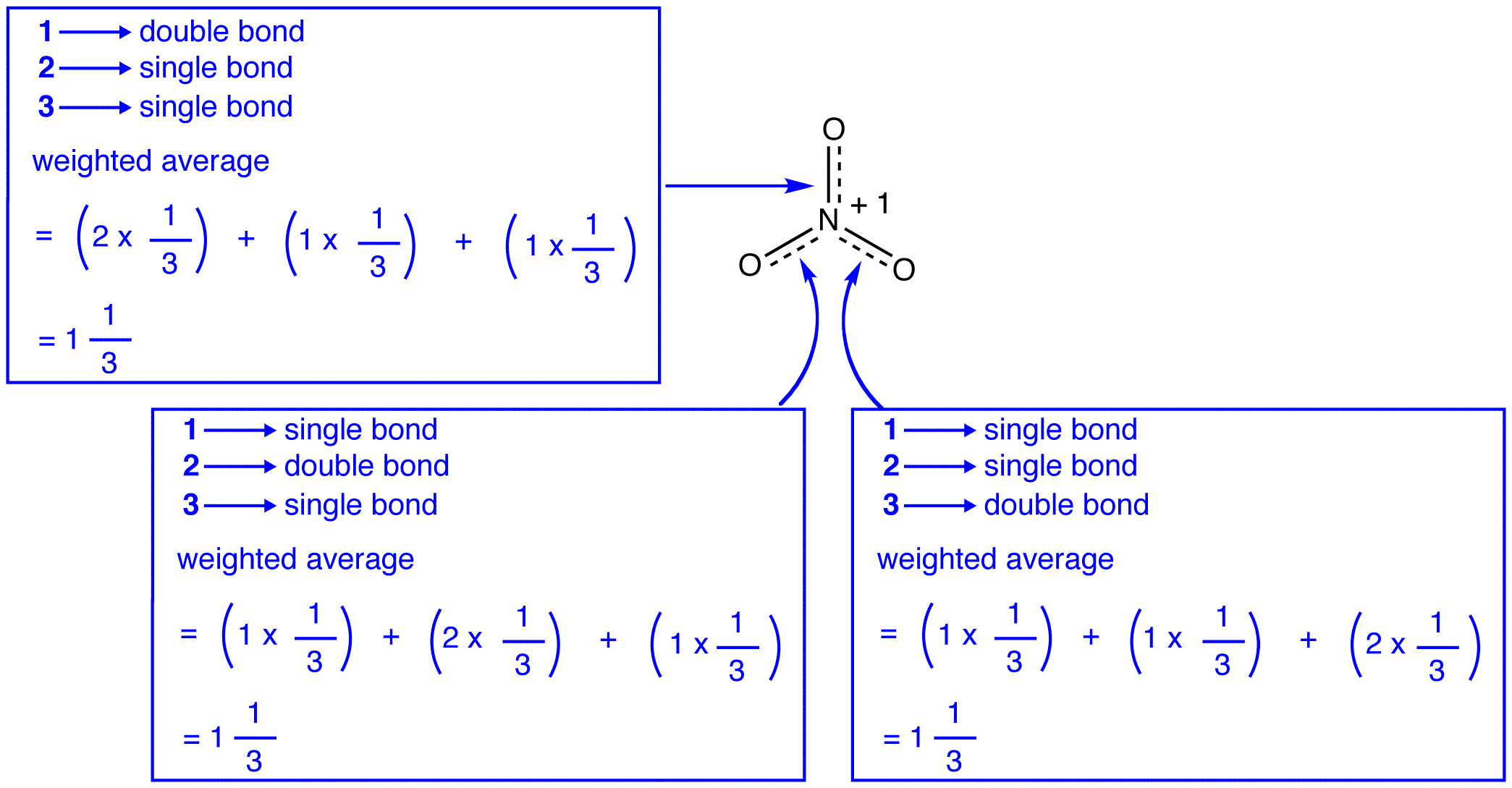
Nach der Resonanztheorie ist jede Bindung im Nitrationion eins und ein Drittel einer Bindung, was mit der Beobachtung übereinstimmt, dass die drei Bindungen im Nitrationon die gleiche Bindungslänge und die gleiche Bindungsenergie haben.
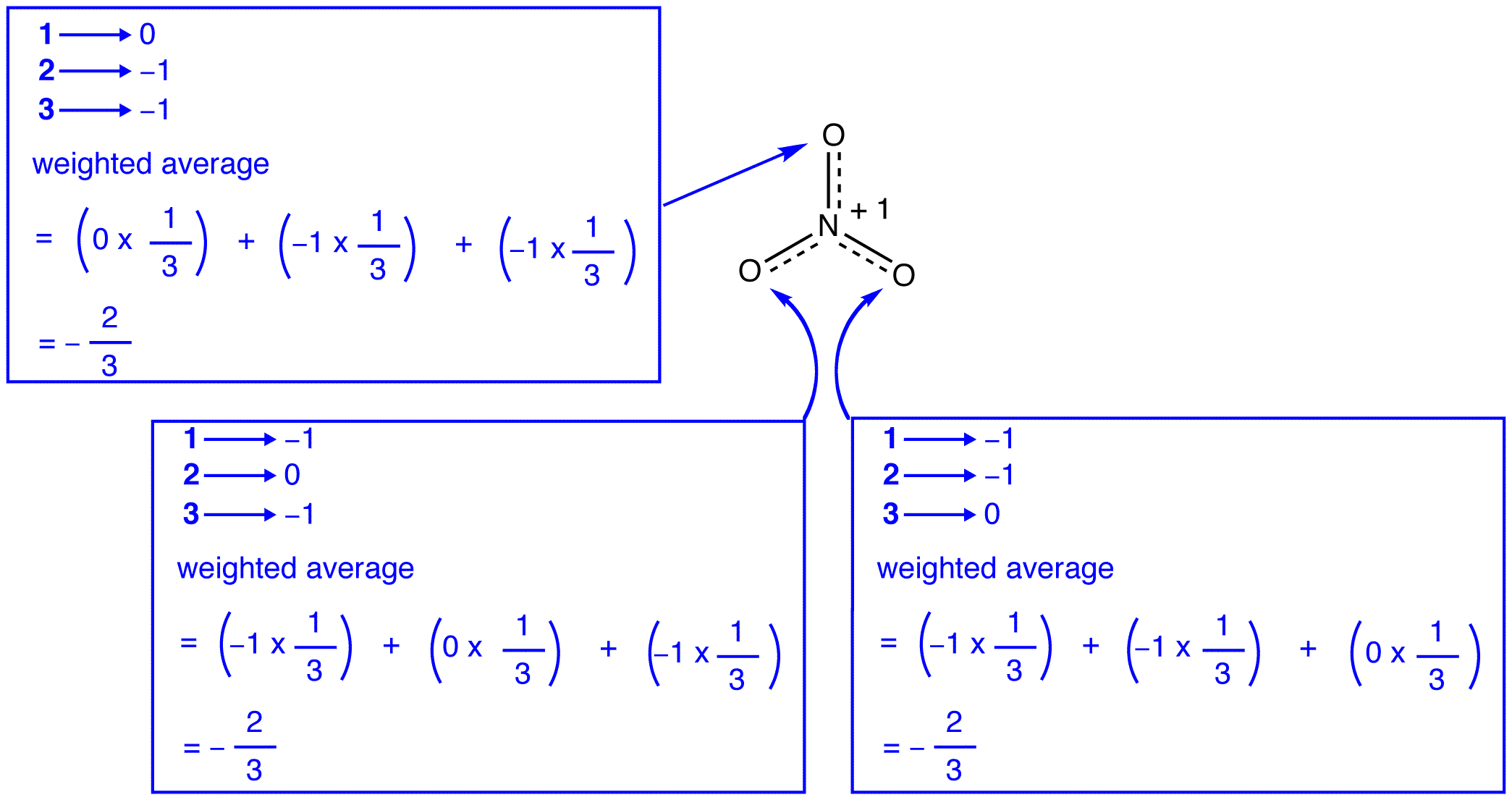
Nach der Resonanztheorie hat jedes Sauerstoffatom im Nitrationion eine formale Ladung von -2/3, was in Verbindung mit der Tatsache, dass die drei Stickstoff-Sauerstoff-Bindungen identisch sind, mit der Beobachtung übereinstimmt, dass die drei Sauerstoffatome im Nitrationon nicht unterscheidbar sind.
In jeder Resonanzform des Nitrat-Ions gibt es zwei pi-Elektronen, und sie werden nur von zwei Atomen geteilt. Ein Elektron, das nur von zwei Atomen geteilt wird, soll lokalisiert sein. Somit sind die beiden pi-Elektronen in jeder Resonanzform des Nitrationens lokalisiert. Das Nitrat-Ion, wie es durch den Hybrid dargestellt wird, hat zwei Pi-Elektronen:
# Elektronen in einer Pi-Bindung = 2
# Elektronen in einem Drittel einer Pi-Bindung = 2/3
# Elektronen in drei von ihnen = 3 x (2/3) = 2
Die beiden Pi-Elektronen im Nitrat-Ion teilen sich insgesamt vier Atome, ein Stickstoffatom und drei Sauerstoffatome. Ein Elektron, das von mehr als zwei Atomen geteilt wird, wird als delokalisiert bezeichnet. Somit werden die beiden pi-Elektronen im Nitrat-Ion delokalisiert. Die Delokalisierung von pi-Elektronen im Nitrationion erfordert, dass sich die vier Atome in derselben Ebene befinden, was eine laterale Überlappung der p-Orbitale auf ihnen ermöglicht.

Wenn die Energie des Nitrat-Ions der gewichtete Durchschnitt der Energien seiner drei Resonanzformen wäre, so wie die Struktur des Nitrat-Ions der gewichtete Durchschnitt der Strukturen seiner drei Resonanzformen ist, sollte sie gleich der Energie einer der drei identischen Resonanzformen sein:

Wenn die Energie des Hybrids gleich der einer Resonanzform wäre, da alle chemischen Einheiten (Elementarteilchen, Atome, Moleküle usw.) natürlich dazu neigen, sich im niedrigstmöglichen Energiezustand zu befinden, wäre es für das Nitrationion nicht von Vorteil, als Hybrid zu existieren; es könnte einfach als Resonanzform existieren. Da das Nitrationion als Hybrid und nicht als Resonanzform vorliegt, kann gefolgert werden, dass die Energie des Hybrids niedriger ist als die einer der Resonanzformen.

Nach der Resonanztheorie ist dann die Energie eines Moleküls niedriger als die der Resonanzform mit der niedrigsten Energie. Da das Nitrationion eine geringere Energie aufweist und daher stabiler ist als jede seiner Resonanzformen, wird das Nitrationon als resonanzstabilisiert bezeichnet.
Es gibt zwei Missverständnisse über die Resonanztheorie unter Anfängern, wahrscheinlich aufgrund der wörtlichen Interpretation des Wortes Resonanz. Sie werden nachfolgend am Beispiel des Nitrationes beschrieben.
Missverständnis 1: Das Nitrationion existiert für einen Moment als Resonanzform 1 und ändert sich dann entweder in Resonanzform 2 oder in Resonanzform 3, die sich ineinander umwandeln oder zu 1 zurückkehren.

Die Struktur des Nitrationons ist nicht 1 noch 2 noch 3, sondern das Hybrid und ändert sich nicht mit der Zeit, es sei denn, es wird einer Reaktion unterzogen.Missverständnis 2: In einer Probe von Nitrationen existiert zu einem bestimmten Zeitpunkt ein Drittel der Ionen als Resonanzform 1, ein weiteres Drittel als Resonanzform 2 und das verbleibende Drittel als Resonanzform 3.

In einer Probe von Nitrationen haben zu einem bestimmten Zeitpunkt alle Ionen die gleiche Struktur, die die Hybride ist.Die klassische Analogie zur Klärung dieser beiden Missverständnisse ist das Maultier (Morrison, R. T.; Boyd, R. N. Organic Chemistry, fünfte Ausgabe; Allyn und Bacon: Boston, 1987, pg. 373). Biologisch gesehen ist ein Maultier eine Mischung aus Pferd und Esel. Dies bedeutet nicht, dass ein Maultier einen Moment lang einem Pferd ähnelt und dann einem Esel ähnelt. Das Aussehen eines Maultiers ist eine Kombination aus dem eines Pferdes und dem eines Esels und ändert sich nicht mit der Zeit. Es bedeutet auch nicht, dass in einer Herde einige Maultiere einem Pferd und die anderen einem Esel ähneln. In einer Herde haben alle Maultiere das gleiche Aussehen, eine Kombination aus Pferd und Esel. Die Schwäche dieser Analogie ist, dass Pferde und Esel existieren, während Resonanzformen streng hypothetisch sind. Eine bessere Analogie, zitiert in Morrison und Boyd, ist das Nashorn. Wenn man ein Nashorn sieht, könnte man es als Hybride aus einem Drachen und einem Einhorn beschreiben, zwei Kreaturen, die es nicht gibt.
Regeln für das Zeichnen von Resonanzformen
1. Resonanzformen sind Lewis-Diagramme, die auf der Valenzbindungstheorie basieren.Sie müssen daher den Grundregeln der Valenzbindungstheorie folgen. Somit kann Wasserstoff nicht mehr als zwei Valenzelektronen haben; Periode-zwei Elemente können nicht mehr als acht Valenzelektronen haben; Elemente in Periode drei und darunter können mehr als acht Valenzelektronen haben. zB: In jeder Resonanzform des Nitrationens gibt es zwei Elemente, Stickstoff und Sauerstoff, die Periodenzwei Elemente sind. In keiner der Resonanzformen des Nitrationens befinden sich mehr als acht Valenzelektronen an einem der Atome.
2. Alle Resonanzformen müssen das gleiche Sigma-Bindungsgerüst haben, das sich nur in den Positionen von Pi-Elektronen und nicht gebundenen Valenzelektronen unterscheidet. zB: Alle drei Resonanzformen des Nitrationens haben das gleiche Sigma-Bindungsgerüst:
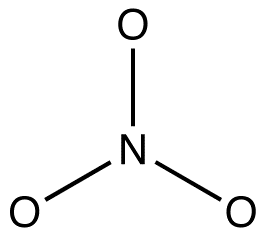
Sie unterscheiden sich nur in den Positionen von Pi-Elektronen und einsamen Paaren voneinander.Organische Chemiker verstoßen zunehmend gegen diese Regel, um die Strukturen reaktiver Zwischenprodukte als resonanzstabilisierte Spezies zu erklären. zB: oxymercuration
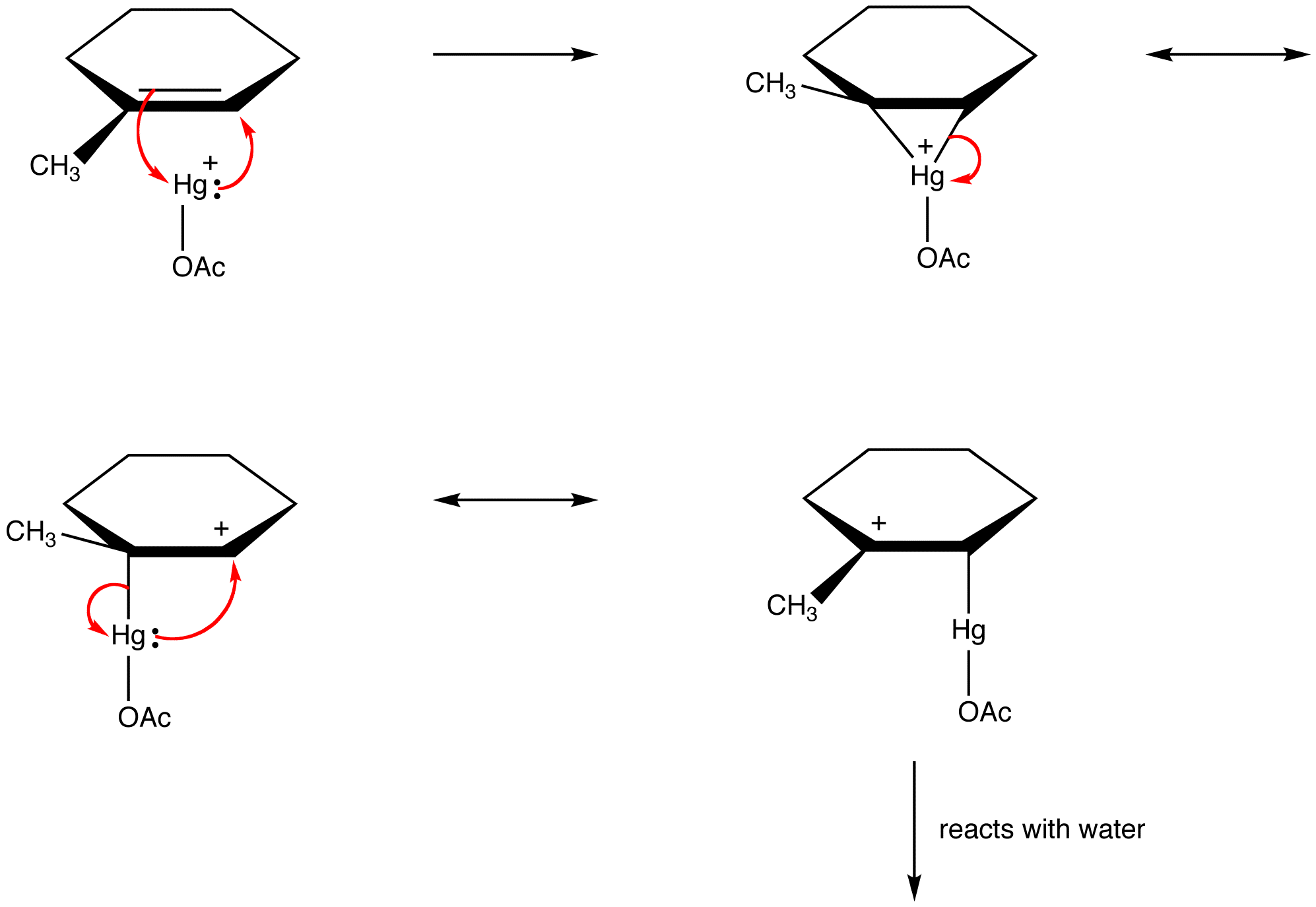
Bestimmung des relativen Beitrags von Resonanzformen zum Hybrid
Die drei Formen des Nitrationens sind identisch und haben daher die gleiche Stabilität. Folglich tragen sie gleichermaßen zum Hybrid bei. Die Resonanzformen der meisten resonanzstabilisierten Moleküle unterscheiden sich voneinander, so dass sie nicht gleichermaßen zum Hybrid beitragen. Je stabiler die Resonanzform ist, desto mehr trägt sie zum Hybrid bei. Daher erfordert die Bestimmung des relativen Beitrags oder der Resonanzformen zum Hybrid die Bestimmung ihrer relativen Stabilität. Verwenden Sie die folgenden Regeln, um die relative Stabilität von Resonanzformen zu bestimmen. Regel 1:Eine Resonanzform, in der alle Atome ein Oktett von Valenzelektronen haben, ist stabiler als eine, in der mindestens ein Atom dies nicht tut. z:
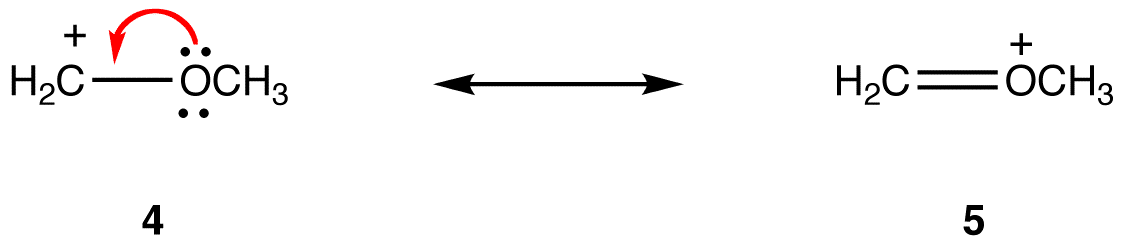
In der Resonanzform 5 haben alle Atome ein Oktett von Valenzelektronen; In 4 hat ein Atom, das Kohlenstoffatom mit der formalen Ladung von +1, nicht. Somit ist die Resonanzform 5 stabiler als die Resonanzform 4.Regel 2:Wenn alles andere gleich ist, ist eine Resonanzform, die eine formale negative Ladung auf einem elektronegativeren Atom hat, stabiler als eine, die eine formale negative Ladung auf einem weniger elektronegativen Atom hat. z:
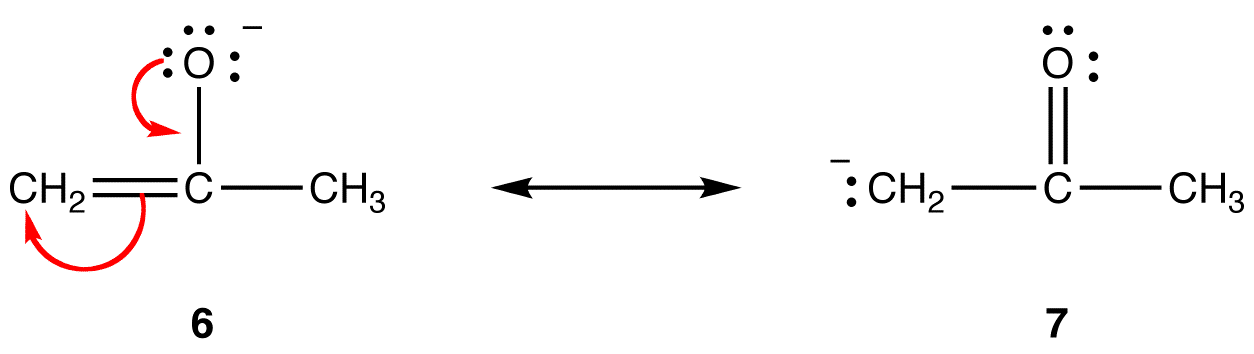
In Resonanzform 6 befindet sich die formale negative Ladung an einem Sauerstoffatom; in 7 ist es an einem Kohlenstoffatom. Sauerstoff ist elektronegativer als Kohlenstoff. Somit ist die Resonanzform 6 stabiler als die Resonanzform 7.
Der Trend ist in Bezug auf formale positive Ladungen entgegengesetzt. Wenn alles andere gleich ist, ist eine Resonanzform, die eine formale positive Ladung auf einem weniger elektronegativen Atom hat, stabiler als eine, die eine formale positive Ladung auf einem elektronegativeren Atom hat. z:
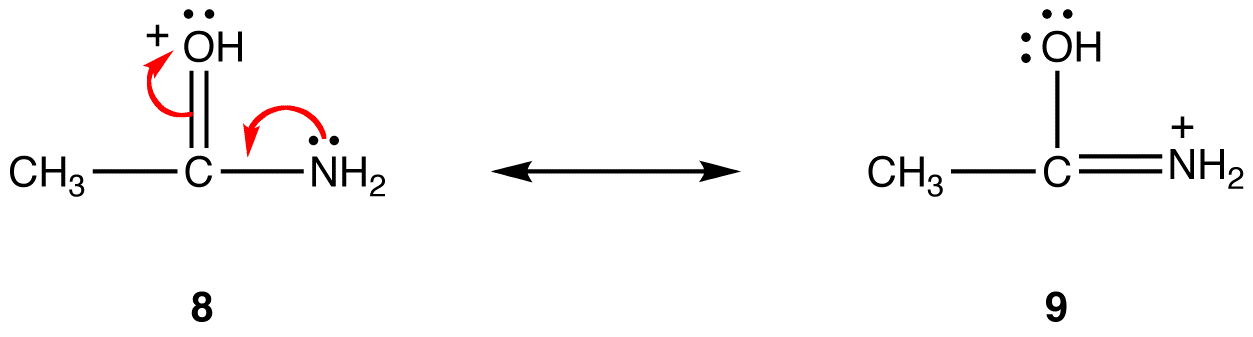
In Resonanzform 8 befindet sich die formale positive Ladung an einem Sauerstoffatom; in 9 ist es an einem Stickstoffatom. Stickstoff ist weniger elektronegativ als Sauerstoff, daher ist die Resonanzform 9 stabiler als die Resonanzform 8.
Regel 3:
Wenn alles andere gleich ist, ist eine Resonanzform, die keine Ladungstrennung aufweist, die als dipolare Resonanzform bezeichnet wird, stabiler als eine solche. zB:
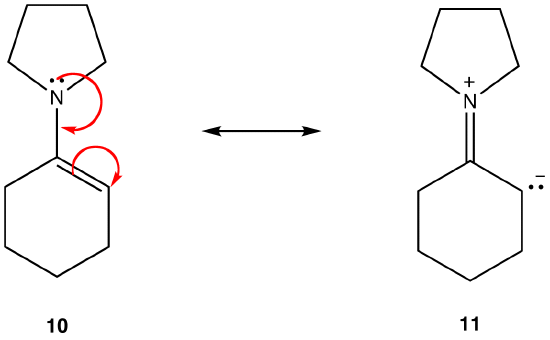
Resonanzform 11 ist eine dipolare Resonanzform; 10 ist nicht. Somit ist 10 stabiler als 11. Diese Regel ist eine Folge der Vektorform des Coloumb-Gesetzes, nach der sich entgegengesetzte Ladungen anziehen. Die Folge ist, dass, um entgegengesetzte Ladungen getrennt zu halten, Energie benötigt wird, was bedeutet, dass 11 eine höhere Energie als 10 hat, also 10 stabiler als 11 ist.
Regel 4:
Bei dipolaren Resonanzformen ist die Resonanzform umso stabiler, je größer der Abstand zwischen getrennten Ladungen ist. zB:
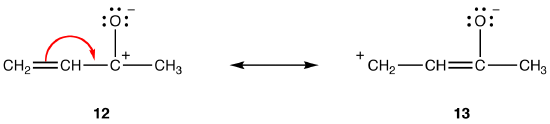
Beide Resonanzformen 12 und 13 sind dipolare Resonanzformen. Der Abstand zwischen den getrennten Ladungen ist in 13 (drei Bindungen) größer als in 12 (eine Bindung), so dass 13 stabiler ist als 12. Diese Regel ist eine Folge der skalaren Form des Coloumb-Gesetzes, die besagt, dass die Anziehungskraft zwischen entgegengesetzten Ladungen umgekehrt proportional zum Quadrat des Abstands zwischen ihnen ist. Somit ist die Energie, die benötigt wird, um die entgegengesetzten Ladungen in 12 getrennt zu halten, höher als die in 13, was bedeutet, dass 12 eine höhere Energie als 13 hat, so dass 13 stabiler als 12 ist.
Die obigen Regeln gelten möglicherweise nicht für Resonanzen mit Elementen der Periode drei und darunter, da sie mehr als acht Elektronen in der Valenzschale aufnehmen können. zB:
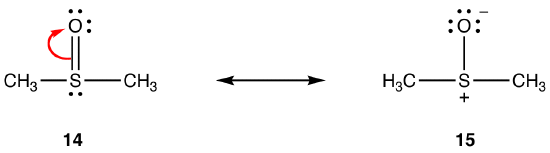
Die Doppelbindung in 14 besteht aus einer Sigma-Bindung und einer Bindung, die durch die Überlappung eines 2p-Orbitals mit zwei Elektronen im Sauerstoffatom und eines leeren 3d-Orbitals im Schwefelatom gebildet wird. Diese beiden Orbitale haben sehr unterschiedliche Energien, Größen und Formen, so dass die Überlappung zwischen ihnen, bekannt als pn–dn-Wechselwirkung, schwach ist. Folglich hat die Schwefel-Sauerstoff-Bindung im Hybrid wenig Doppelbindungscharakter, d. H. 15 ist die Hauptresonanzform.
Mitwirkende und Zuschreibungen
- Gamini Gunawardena von der OChemPal Site (Utah Valley University)