Lernziele
Am Ende dieses Abschnitts können Sie:
- Wärmeübertragung untersuchen.
- Berechnen Sie die Endtemperatur aus der Wärmeübertragung.
Bisher haben wir Temperaturänderungen aufgrund von Wärmeübertragung diskutiert. Keine Temperaturänderung tritt von der Wärmeübertragung auf, wenn Eis schmilzt und flüssiges Wasser wird (d. h. während einer Phasenänderung). Betrachten Sie zum Beispiel Wasser, das von Eiszapfen tropft, die auf einem von der Sonne erwärmten Dach schmelzen. Umgekehrt gefriert Wasser in einer Eisschale, die durch eine Umgebung mit niedrigerer Temperatur gekühlt wird.

Abbildung 1. Wärme aus der Luft überträgt sich auf das Eis, wodurch es schmilzt. (credit: Mike Brand)
Zum Schmelzen eines Feststoffs ist Energie erforderlich, da die kohäsiven Bindungen zwischen den Molekülen im Feststoff so aufgebrochen werden müssen, dass sich die Moleküle in der Flüssigkeit mit vergleichbaren kinetischen Energien bewegen können; somit gibt es keinen Temperaturanstieg. In ähnlicher Weise wird Energie benötigt, um eine Flüssigkeit zu verdampfen, da Moleküle in einer Flüssigkeit über Anziehungskräfte miteinander interagieren. Es gibt keine Temperaturänderung, bis eine Phasenänderung abgeschlossen ist. Die Temperatur einer Tasse Soda anfänglich bei 0ºC bleibt bei 0ºC, bis das gesamte Eis geschmolzen ist. Umgekehrt wird beim Gefrieren und Kondensieren Energie freigesetzt, meist in Form von Wärmeenergie. Arbeit wird durch Kohäsionskräfte geleistet, wenn Moleküle zusammengebracht werden. Die entsprechende Energie muss abgegeben (abgeführt) werden, damit sie zusammen bleiben können Abbildung 2.
Die an einem Phasenwechsel beteiligte Energie hängt von zwei Hauptfaktoren ab: der Anzahl und Stärke von Bindungen oder Kraftpaaren. Die Anzahl der Bindungen ist proportional zur Anzahl der Moleküle und damit zur Masse der Probe. Die Stärke der Kräfte hängt von der Art der Moleküle ab. Die Wärme Q, die benötigt wird, um die Phase einer Probe der Masse m zu ändern, ist gegeben durch
Q = mLf (Schmelzen /Gefrieren,
Q = mLv (Verdampfung /Kondensation),
wobei die latente Schmelzwärme Lf und die latente Verdampfungswärme Lv Materialkonstanten sind, die experimentell bestimmt werden. Siehe (Tabelle 1).

Abbildung 2. (a) Energie wird benötigt, um die Anziehungskräfte zwischen Molekülen in einem Feststoff teilweise zu überwinden, um eine Flüssigkeit zu bilden. Dieselbe Energie muss entfernt werden, damit das Einfrieren stattfinden kann. (b) Moleküle sind beim Übergang von Flüssigkeit zu Dampf durch große Entfernungen voneinander getrennt, was erhebliche Energie erfordert, um die molekulare Anziehung zu überwinden. Die gleiche Energie muss entfernt werden, damit Kondensation stattfinden kann. Es gibt keine Temperaturänderung, bis eine Phasenänderung abgeschlossen ist.
Die latente Wärme wird in Einheiten von J/kg gemessen. Sowohl Lf als auch Lv hängen von der Substanz ab, insbesondere von der Stärke ihrer molekularen Kräfte, wie bereits erwähnt. Lf und Lv werden zusammen als Latentwärmekoeffizienten bezeichnet. Sie sind latent oder verborgen, weil bei Phasenänderungen Energie in ein System eintritt oder es verlässt, ohne eine Temperaturänderung im System zu verursachen. In Tabelle 1 sind repräsentative Werte von Lf und Lv sowie Schmelz- und Siedepunkte aufgeführt.
Die Tabelle zeigt, dass an Phasenänderungen erhebliche Energiemengen beteiligt sind. Schauen wir uns zum Beispiel an, wie viel Energie benötigt wird, um ein Kilogramm Eis bei 0ºC zu schmelzen, um ein Kilogramm Wasser bei 0 ° C zu erzeugen. Unter Verwendung der Gleichung für eine Temperaturänderung und des Wertes für Wasser aus Tabelle 1 finden wir, dass Q = mLf = (1.0 kg)(334 kJ / kg) = 334 kJ ist die Energie, um ein Kilogramm Eis zu schmelzen. Dies ist eine Menge Energie, da es die gleiche Menge an Energie darstellt, die benötigt wird, um die Temperatur von 1 kg flüssigem Wasser von 0ºC auf 79,8 ºC zu erhöhen. Noch mehr Energie wird benötigt, um Wasser zu verdampfen; Es würden 2256 kJ benötigt, um 1 kg flüssiges Wasser bei normalem Siedepunkt (100ºC bei Atmosphärendruck) in Dampf (Wasserdampf) umzuwandeln. Dieses Beispiel zeigt, dass die Energie für einen Phasenwechsel im Vergleich zu Energie, die mit Temperaturänderungen ohne Phasenwechsel verbunden ist, enorm ist.
| Table 1. Heats of Fusion and Vaporization | ||||||
|---|---|---|---|---|---|---|
| Lf | Lv | |||||
| Substance | Melting point (ºC) | kJ/kg | kcal/kg | Boiling point (°C) | kJ/kg | kcal/kg |
| Helium | −269.7 | 5.23 | 1.25 | −268.9 | 20.9 | 4.99 |
| Hydrogen | −259.3 | 58.6 | 14.0 | −252.9 | 452 | 108 |
| Nitrogen | −210.0 | 25.5 | 6.09 | −195.8 | 201 | 48.0 |
| Oxygen | −218.8 | 13.8 | 3.30 | −183.0 | 213 | 50.9 |
| Ethanol | −114 | 104 | 24.9 | 78.3 | 854 | 204 |
| Ammonia | −75 | 108 | −33.4 | 1370 | 327 | |
| Mercury | −38.9 | 11.8 | 2.82 | 357 | 272 | 65.0 |
| Water | 0.00 | 334 | 79.8 | 100.0 | 2256 | 539 |
| Sulfur | 119 | 38.1 | 9.10 | 444.6 | 326 | 77.9 |
| Lead | 327 | 24.5 | 5.85 | 1750 | 871 | 208 |
| Antimony | 631 | 165 | 39.4 | 1440 | 561 | 134 |
| Aluminum | 660 | 380 | 90 | 2450 | 11400 | 2720 |
| Silver | 961 | 88.3 | 21.1 | 2193 | 2336 | 558 |
| Gold | 1063 | 64.5 | 15.4 | 2660 | 1578 | 377 |
| Copper | 1083 | 134 | 32.0 | 2595 | 5069 | 1211 |
| Uranium | 1133 | 84 | 20 | 3900 | 1900 | 454 |
| Tungsten | 3410 | 184 | 44 | 5900 | 4810 | 1150 |
Phase changes can have a tremendous stabilizing effect even on temperatures that are not near the melting and boiling points, because evaporation and condensation (conversion of a gas into a liquid state) occur even at temperatures below the boiling point. Nehmen wir zum Beispiel die Tatsache, dass die Lufttemperaturen in feuchten Klimazonen selten über 35,0 ºC steigen, weil die meiste Wärmeübertragung in verdunstendes Wasser in die Luft geht. Ebenso fallen die Temperaturen bei feuchtem Wetter selten unter den Taupunkt, da beim Kondensieren von Wasserdampf enorme Wärme freigesetzt wird.
Wir untersuchen die Auswirkungen des Phasenwechsels genauer, indem wir die Zugabe von Wärme in eine Eisprobe bei −20ºC in Betracht ziehen (Abbildung 3). Die Temperatur des Eises steigt linear an und absorbiert Wärme mit einer konstanten Rate von 0,50 cal / g⋅ ºC, bis sie 0ºC erreicht. Bei dieser Temperatur beginnt das Eis zu schmelzen, bis das gesamte Eis geschmolzen ist und 79,8 cal / g Wärme absorbiert. Die Temperatur bleibt während dieser Phasenänderung konstant bei 0ºC. Sobald das gesamte Eis geschmolzen ist, steigt die Temperatur des flüssigen Wassers an und absorbiert Wärme mit einer neuen konstanten Rate von 1,00 cal / g⋅ºC. Bei 100ºC beginnt das Wasser zu kochen und die Temperatur bleibt wieder konstant, während das Wasser während dieses Phasenwechsels 539 cal / g Wärme aufnimmt. Wenn die gesamte Flüssigkeit zu Dampfdampf geworden ist, steigt die Temperatur wieder an und absorbiert Wärme mit einer Geschwindigkeit von 0,482 cal / g⋅ºC.
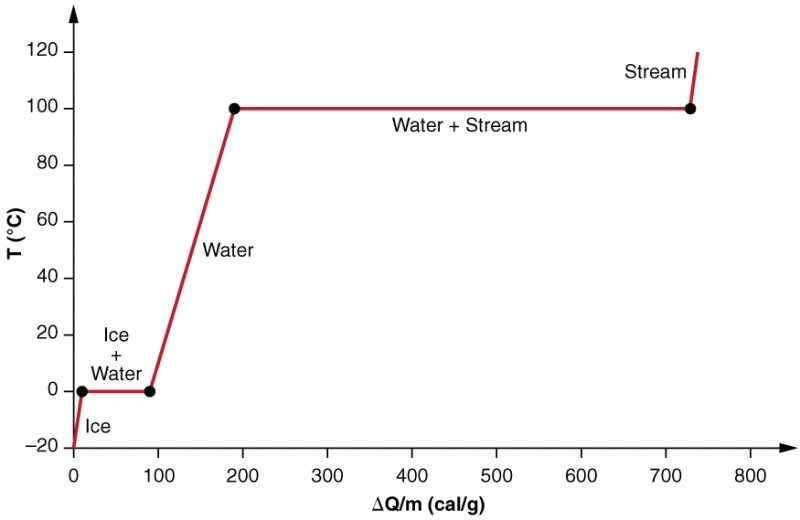
Abbildung 3. Ein Diagramm der Temperatur im Vergleich zu Energie hinzugefügt. Das System ist so konstruiert, dass kein Dampf verdampft, während sich Eis erwärmt, um flüssiges Wasser zu werden, und dass der Dampf bei Verdampfung im System verbleibt. Die langen Strecken konstanter Temperaturwerte bei 0ºC und 100ºC spiegeln die große latente Schmelz- bzw. Verdampfungswärme wider.
Wasser kann bei Temperaturen unterhalb des Siedepunktes verdampfen. Es wird mehr Energie benötigt als am Siedepunkt, da die kinetische Energie von Wassermolekülen bei Temperaturen unter 100ºC geringer ist als bei 100ºC, daher steht weniger Energie aus zufälligen thermischen Bewegungen zur Verfügung. Nehmen wir zum Beispiel die Tatsache, dass Schweiß von der Haut bei Körpertemperatur einen Wärmeeintrag von 2428 kJ / kg erfordert, was etwa 10 Prozent höher ist als die latente Verdampfungswärme bei 100ºC. Diese Wärme kommt von der Haut und sorgt so für einen effektiven Kühlmechanismus bei heißem Wetter. Hohe Luftfeuchtigkeit hemmt die Verdunstung, so dass die Körpertemperatur ansteigen kann und nicht verdampfter Schweiß auf der Stirn verbleibt.
Beispiel 1. Berechnen Sie die Endtemperatur aus der Phasenänderung: Soda mit Eiswürfeln kühlen
Drei Eiswürfel werden verwendet, um eine Soda bei 20ºC mit der Masse msoda = 0,25 kg zu kühlen. Das Eis hat 0ºC und jeder Eiswürfel hat eine Masse von 6,0 g. Angenommen, das Soda wird in einem Schaumbehälter aufbewahrt, damit der Wärmeverlust ignoriert werden kann. Angenommen, das Soda hat die gleiche Wärmekapazität wie Wasser. Finden Sie die Endtemperatur, wenn alles Eis geschmolzen ist.
Strategie
Die Eiswürfel haben eine Schmelztemperatur von 0ºC. Wärme wird von der Soda zum Schmelzen auf das Eis übertragen. Das Schmelzen von Eis erfolgt in zwei Schritten: Zuerst tritt der Phasenwechsel auf und Feststoff (Eis) wandelt sich bei der Schmelztemperatur in flüssiges Wasser um, dann steigt die Temperatur dieses Wassers an. Das Schmelzen ergibt Wasser bei 0ºC, so dass mehr Wärme von der Soda auf dieses Wasser übertragen wird, bis das Wasser−plus-Soda-System ein thermisches Gleichgewicht erreicht, Qice = – Qsoda.
Die auf das Eis übertragene Wärme ist
Qice = = Lf + micecW(Tf−0ºC).
Die von der Soda abgegebene Wärme ist Qsoda = msodacW(Tf−20ºC). Da keine Wärme verloren geht, Qice = -Qsoda, so dass
= Lf + micecW(Tf−0ºC) = –msodacW(Tf−20ºC).
Bringen Sie alle Terme, die Tf betreffen, auf die linke Seite und alle anderen Terme auf die rechte Seite. Löse nach der unbekannten Größe Tf:
\displaystyle{T}_{\text{f}}=\frac{m_{\text{soda}}c_{\text{W}}\left(20^{\circ}\text{C}\right)-m_{\text{ice}}L_{\text{f}}}{\left(m_{\text{soda}}+m_{\text{ice}}\right)c_{\text{W}}}\\
Lösung
- Identifizieren Sie die bekannten Größen. Die Masse des Eises ist Mäuse = 3 × 6,0 g = 0,018 kg und die Masse der Soda ist msoda = 0,25 kg.
- Berechnen Sie die Terme im Zähler: m sodacW(20ºC)=(0,25 kg)(4186 J/kg ⋅ ºC)(20ºC) = 20.930 J und miceLf = (0,018 kg)(334.000 J/kg) = 6012 J.
- Berechnen Sie den Nenner: (msoda + 0)cW = (0,25 kg + 0.018 Kilogramm) (4186 K/(Kilogramm⋅ºC) = 1122 J/ºC.
- Berechne die Endtemperatur: \displaystyle{T}_{\text{f}}=\frac{20,930\text{J}-6012\text{ J}}{1122\text{ J/}^{\circ}\text{C}}=13^{\circ}\text{C}\\
Diskussion
Dieses Beispiel veranschaulicht die enormen Energien, die während eines Phasenwechsels involviert sind. Die Masse des Eises ist etwa 7 Prozent der Masse des Wassers, sondern führt zu einer spürbaren Änderung der Temperatur von Soda. Obwohl wir angenommen haben, dass das Eis die Gefriertemperatur hatte, ist dies falsch: Die typische Temperatur beträgt −6ºC. Diese Korrektur ergibt jedoch eine Endtemperatur, die im Wesentlichen mit dem gefundenen Ergebnis identisch ist. Können Sie erklären, warum?

Abbildung 4. Kondensation auf einem Glas Eistee. (credit: Jenny Downing)
Wir haben gesehen, dass die Verdampfung eine Wärmeübertragung von der Umgebung auf eine Flüssigkeit erfordert, so dass Energie von der Umgebung freigesetzt wird. Kondensation ist der umgekehrte Prozess, der die Temperatur der Umgebung erhöht. Dieser Anstieg mag überraschend erscheinen, da wir Kondensation mit kalten Objekten in Verbindung bringen — zum Beispiel dem Glas in der Abbildung. Den kondensierenden Molekülen muss jedoch Energie entzogen werden, damit ein Dampf kondensiert. Die Energie ist genau die gleiche wie die, die erforderlich ist, um die Phasenänderung in die andere Richtung von Flüssigkeit zu Dampf vorzunehmen, und kann daher aus Q = mLv berechnet werden.
In Abbildung 4 bildet sich Kondenswasser, weil die Temperatur der Umgebungsluft unter den Taupunkt sinkt. Die Luft kann nicht so viel Wasser aufnehmen wie bei Raumtemperatur, und so kondensiert Wasser. Energie wird freigesetzt, wenn das Wasser kondensiert, wodurch das Schmelzen des Eises im Glas beschleunigt wird.
Reale Anwendung
Energie wird auch freigesetzt, wenn eine Flüssigkeit gefriert. Dieses Phänomen wird von Obstbauern in Florida genutzt, um Orangen zu schützen, wenn die Temperatur nahe dem Gefrierpunkt (0ºC) liegt. Züchter sprühen Wasser auf die Pflanzen in Obstgärten, so dass das Wasser gefriert und Wärme an die wachsenden Orangen auf den Bäumen abgegeben wird. Dies verhindert, dass die Temperatur in der Orange unter den Gefrierpunkt fällt, was die Frucht beschädigen würde.

Abbildung 14.11. Das Eis auf diesen Bäumen setzte beim Gefrieren große Mengen an Energie frei, um zu verhindern, dass die Temperatur der Bäume unter 0ºC fiel. Wasser wird absichtlich auf Obstgärten gesprüht, um harten Frost zu verhindern. (kredit: Hermann Hammer)
Sublimation ist der Übergang von der festen zur Dampfphase. Sie haben vielleicht bemerkt, dass Schnee ohne eine Spur von flüssigem Wasser oder das Verschwinden von Eiswürfeln in einem Gefrierschrank in dünner Luft verschwinden kann. Das Gegenteil ist auch der Fall: An sehr kalten Fenstern kann sich Frost bilden, ohne die flüssige Stufe zu durchlaufen. Ein beliebter Effekt ist die Herstellung von „Rauch“ aus Trockeneis, das festes Kohlendioxid ist. Sublimation tritt auf, weil der Gleichgewichtsdampfdruck von Feststoffen nicht Null ist. Bestimmte Lufterfrischer verwenden die Sublimation eines Feststoffs, um ein Parfüm in den Raum zu injizieren. Mottenkugeln sind ein leicht giftiges Beispiel für ein Phenol (eine organische Verbindung), das sublimiert, während einige Feststoffe, wie Osmiumtetroxid, so giftig sind, dass sie in verschlossenen Behältern aufbewahrt werden müssen, um die Exposition des Menschen gegenüber ihren durch Sublimation erzeugten Dämpfen zu verhindern.

Abbildung 5. Direkte Übergänge zwischen Feststoff und Dampf sind üblich, manchmal nützlich und sogar schön. (a) Trockeneis sublimiert direkt zu Kohlendioxidgas. Der sichtbare Dampf besteht aus Wassertropfen. (Kredit: Windell Oskay) (b) Frost bildet Muster auf einem sehr kalten Fenster, ein Beispiel für einen Feststoff, der direkt aus einem Dampf gebildet wird. (credit: Liz West)
Alle Phasenübergänge beinhalten Wärme. Bei direkten Festdampf-Übergängen ist die erforderliche Energie durch die Gleichung Q = mLs gegeben, wobei Ls die Sublimationswärme ist, die die zur Änderung von 1 erforderliche Energie ist.00 kg einer Substanz von der Festphase in die Dampfphase. Ls ist analog zu Lf und Lv und sein Wert hängt von der Substanz ab. Sublimation erfordert Energiezufuhr, so dass Trockeneis ein effektives Kühlmittel ist, während der umgekehrte Prozess (d. H. Zuckerguss) Energie freisetzt. Die für die Sublimation erforderliche Energiemenge liegt in der gleichen Größenordnung wie bei anderen Phasenübergängen.
Das in diesem Abschnitt und im vorhergehenden Abschnitt vorgestellte Material ermöglicht es uns, eine beliebige Anzahl von Effekten in Bezug auf Temperatur und Phasenänderung zu berechnen. In jedem Fall ist es notwendig, zu identifizieren, welche Temperatur- und Phasenänderungen stattfinden, und dann die entsprechende Gleichung anzuwenden. Denken Sie daran, dass Wärmeübertragung und Arbeit sowohl Temperatur- als auch Phasenänderungen verursachen können.
Problemlösungsstrategien für die Auswirkungen der Wärmeübertragung
- Untersuchen Sie die Situation, um festzustellen, ob sich die Temperatur oder die Phase ändert. Gibt es Wärmeübertragung in oder aus dem System? Wenn das Vorhandensein oder Fehlen einer Phasenänderung nicht offensichtlich ist, möchten Sie möglicherweise zuerst das Problem lösen, als ob es keine Phasenänderungen gäbe, und die erhaltene Temperaturänderung untersuchen. Wenn es ausreicht, Sie an einem Siedepunkt oder Schmelzpunkt vorbeizuführen, sollten Sie zurückgehen und das Problem in Schritten ausführen — Temperaturänderung, Phasenänderung, nachfolgende Temperaturänderung usw.
- Identifizieren und listen Sie alle Objekte auf, die Temperatur und Phase ändern.
- Identifizieren Sie genau, was im Problem bestimmt werden muss (identifizieren Sie die Unbekannten). Eine schriftliche Liste ist hilfreich.
- Machen Sie eine Liste dessen, was gegeben ist oder was aus dem Problem wie angegeben abgeleitet werden kann (identifizieren Sie die Bekannten).
- Löse die entsprechende Gleichung für die zu bestimmende Größe (das Unbekannte). Bei einer Temperaturänderung hängt die übertragene Wärme von der spezifischen Wärme ab (siehe Tabelle 1 in Temperaturänderung und Wärmekapazität), während bei einer Phasenänderung die übertragene Wärme von der latenten Wärme abhängt. Siehe Tabelle 1.
- Setzen Sie die Bekannten zusammen mit ihren Einheiten in die entsprechende Gleichung ein und erhalten Sie numerische Lösungen mit Einheiten. Sie müssen dies schrittweise tun, wenn der Prozess mehr als eine Stufe umfasst (z. B. eine Temperaturänderung gefolgt von einer Phasenänderung).
- Überprüfen Sie die Antwort, um festzustellen, ob sie vernünftig ist: Macht sie Sinn? Stellen Sie beispielsweise sicher, dass die Temperaturänderung nicht auch eine Phasenänderung verursacht, die Sie nicht berücksichtigt haben.
Überprüfen Sie Ihr Verständnis
Warum bleibt Schnee an Berghängen, auch wenn die Tagestemperaturen über dem Gefrierpunkt liegen?
Lösung
Schnee wird aus Eiskristallen gebildet und ist somit die feste Phase von Wasser. Da für Phasenwechsel enorme Wärme notwendig ist, dauert es eine gewisse Zeit, bis sich diese Wärme aus der Luft ansammelt, auch wenn die Luft über 0ºC liegt. Je wärmer die Luft ist, desto schneller findet dieser Wärmeaustausch statt und desto schneller schmilzt der Schnee.
Zusammenfassung des Abschnitts
- Die meisten Substanzen können entweder in fester, flüssiger und gasförmiger Form vorliegen, die als „Phasen“ bezeichnet werden.“
- Phasenänderungen treten bei festen Temperaturen für eine bestimmte Substanz bei einem bestimmten Druck auf, und diese Temperaturen werden als Siede- und Gefrierpunkte (oder Schmelzpunkte) bezeichnet.
- Bei Phasenwechseln ist die aufgenommene oder abgegebene Wärme gegeben durch: Q = mL wobei L der latente Wärmekoeffizient ist.
Konzeptionelle Fragen
- Wärmeübertragung kann Temperatur- und Phasenänderungen verursachen. Was kann diese Änderungen sonst noch verursachen?
- Wie hilft die latente Wärme der Fusion von Wasser, den Rückgang der Lufttemperaturen zu verlangsamen und vielleicht zu verhindern, dass die Temperaturen in der Nähe großer Gewässer deutlich unter ºC fallen?
- Wie ist die Temperatur von Eis, nachdem es durch Einfrieren von Wasser gebildet wurde?
- Was passiert, wenn Sie ºC-Eis in einem isolierten Behälter in ºC-Wasser geben? Wird etwas Eis schmelzen, wird mehr Wasser gefrieren oder wird beides nicht stattfinden?
- Welchen Einfluss hat Kondensation auf ein Glas Eiswasser auf die Geschwindigkeit, mit der das Eis schmilzt? Wird die Kondensation den Schmelzprozess beschleunigen oder verlangsamen?In sehr feuchten Klimazonen, in denen es zahlreiche Gewässer gibt, wie in Florida, ist es ungewöhnlich, dass die Temperaturen über etwa 35ºC (95ºF) steigen. In Wüsten können die Temperaturen jedoch weit darüber steigen. Erklären Sie, wie die Verdunstung von Wasser dazu beiträgt, hohe Temperaturen in feuchten Klimazonen zu begrenzen.
- Im Winter ist es in San Francisco oft wärmer als im nahe gelegenen Sacramento, 150 km landeinwärts. Im Sommer ist es in Sacramento fast immer heißer. Erklären Sie, wie die Gewässer um San Francisco die extremen Temperaturen mildern.
- Wenn Sie einen Deckel auf einen Kochtopf legen, wird die Wärmeübertragung, die zum Kochen erforderlich ist, erheblich verringert. Erklären Sie, warum.
- Gefriergetrocknete Lebensmittel wurden im Vakuum dehydriert. Während des Prozesses gefriert das Lebensmittel und muss erhitzt werden, um die Dehydrierung zu erleichtern. Erklären Sie, wie das Vakuum die Austrocknung beschleunigt und warum die Lebensmittel dadurch gefrieren.
- Wenn stille Luft nachts durch Strahlung abkühlt, ist es ungewöhnlich, dass die Temperaturen unter den Taupunkt fallen. Erklären Sie, warum.
- Bei einer Demonstration im Physikunterricht bläst ein Ausbilder einen Ballon mit dem Mund auf und kühlt ihn dann in flüssigem Stickstoff. Wenn es kalt ist, enthält der geschrumpfte Ballon eine kleine Menge hellblauer Flüssigkeit sowie einige schneeähnliche Kristalle. Wenn es sich erwärmt, kocht die Flüssigkeit und ein Teil der Kristalle sublimiert, wobei einige Kristalle eine Weile verweilen und dann eine Flüssigkeit erzeugen. Identifizieren Sie die blaue Flüssigkeit und die beiden Feststoffe im kalten Ballon. Begründen Sie Ihre Identifikationen anhand der Daten aus Tabelle 1.
Probleme & Übungen
- Wie viel Wärmeübertragung (in Kilokalorien) ist erforderlich, um eine 0,450 kg schwere Packung gefrorenes Gemüse ursprünglich bei 0ºC aufzutauen, wenn ihre Schmelzwärme der von Wasser entspricht?
- Ein Beutel mit 0ºC Eis absorbiert viel effektiver Energie als ein Beutel mit der gleichen Menge an 0ºC Wasser. (a) Wie viel Wärmeübertragung ist notwendig, um die Temperatur von 0,800 kg Wasser von 0ºC auf 30,0 ºC zu erhöhen? (b) Wie viel Wärmeübertragung erforderlich ist, um zuerst 0 zu schmelzen.800 kg 0ºC Eis und dann seine Temperatur erhöhen? (c) Erklären Sie, wie Ihre Antwort die Behauptung unterstützt, dass das Ice effektiver ist.(a) Wie viel Wärmeübertragung ist erforderlich, um die Temperatur eines 0,750 kg schweren Aluminiumtopfes mit 2,50 kg Wasser von 30,0 ºC auf den Siedepunkt zu erhöhen und dann 0,750 kg Wasser wegzukochen? (b) Wie lange dauert dies, wenn die Wärmeübertragungsrate 500 W 1 Watt = 1 Joule / Sekunde (1 W = 1 J / s) beträgt?
- Durch die Bildung von Kondenswasser auf einem Glas Eiswasser schmilzt das Eis schneller als sonst. Wenn 8.00 g Kondensation bilden sich auf einem Glas, das sowohl Wasser als auch 200 g Eis enthält, wie viele Gramm des Eises schmelzen dadurch? Angenommen, es findet keine andere Wärmeübertragung statt.
- Auf einer Reise stellen Sie fest, dass ein 3,50 kg schwerer Eisbeutel durchschnittlich einen Tag in Ihrer Kühlbox hält. Was ist die durchschnittliche Leistung in Watt, die in das Eis eintritt, wenn es bei 0ºC beginnt und an genau einem Tag vollständig zu 0ºC Wasser schmilzt 1 Watt = 1 Joule / Sekunde (1 W = 1 J / s)?
- An einem bestimmten trockenen sonnigen Tag würde die Temperatur eines Schwimmbades um 1,50 ºC steigen, wenn nicht verdampft wäre. Welcher Anteil des Wassers muss verdampfen, um genau genug Energie abzuführen, um die Temperatur konstant zu halten?
- (a) Wie viel Wärmeübertragung ist erforderlich, um die Temperatur eines 0,200 kg schweren Eisstücks von -20,0 ºC auf 130ºC zu erhöhen, einschließlich der Energie, die für Phasenänderungen benötigt wird? (b) Wie viel Zeit wird für jede Stufe benötigt, unter der Annahme einer konstanten Wärmeübertragungsrate von 20,0 kJ / s? (c) Machen Sie ein Diagramm der Temperatur im Vergleich zur Zeit für diesen Prozess.
- 1986 löste sich ein gigantischer Eisberg vom Ross-Schelfeis in der Antarktis. Es war ungefähr ein Rechteck von 160 km Länge, 40.0 km breit und 250 m dick. (a) Wie groß ist die Masse dieses Eisbergs, wenn man bedenkt, dass die Eisdichte 917 kg/m3 beträgt? (b) Wie viel Wärmeübertragung (in Joule) wird benötigt, um es zu schmelzen? (c) Wie viele Jahre würde das Sonnenlicht allein brauchen, um so dickes Eis zu schmelzen, wenn das Eis durchschnittlich 100 W / m2, 12,00 h pro Tag absorbiert?
- Wie viele Gramm Kaffee müssen aus 350 g Kaffee in einer 100-g-Glasschale verdampfen, um den Kaffee von 95,0 ºC auf 45,0 ºC abzukühlen? Sie können davon ausgehen, dass der Kaffee die gleichen thermischen Eigenschaften wie Wasser hat und dass die durchschnittliche Verdampfungswärme 2340 kJ / kg (560 cal / g) beträgt. (Sie können die Änderung der Masse des Kaffees vernachlässigen, wenn er abkühlt, was Ihnen eine Antwort gibt, die etwas größer als richtig ist.)
- (a) Es ist schwierig, ein Feuer auf einem Rohöltanker zu löschen, da jeder Liter Rohöl beim Verbrennen 2,80 × 107 J Energie freisetzt. Um diese Schwierigkeit zu veranschaulichen, berechnen Sie die Anzahl der Liter Wasser, die aufgewendet werden müssen, um die Energie zu absorbieren, die durch das Verbrennen von 1, 00 L Rohöl freigesetzt wird. Wenn die Temperatur des Wassers von 20, 0 ºC auf 100ºC erhöht wird, kocht es und der resultierende Dampf wird auf 300ºC erhöht. (b) Diskutieren Sie zusätzliche Komplikationen, die durch die Tatsache verursacht werden, dass Rohöl eine geringere Dichte als Wasser hat.
- Die Energie, die bei Gewittern durch Kondensation freigesetzt wird, kann sehr groß sein. Berechnen Sie die Energie, die für einen kleinen Sturm mit einem Radius von 1 km in die Atmosphäre freigesetzt wird, unter der Annahme, dass 1, 0 cm Regen gleichmäßig über diesem Gebiet ausfallen.
- Um Frostschäden vorzubeugen, werden 4,00 kg 0ºC Wasser auf einen Obstbaum gesprüht. (a) Wie viel Wärmeübertragung tritt auf, wenn das Wasser gefriert? (b) Um wie viel würde die Temperatur des 200 kg schweren Baumes sinken, wenn diese Wärmemenge vom Baum übertragen würde? Nehmen Sie die spezifische Wärme auf 3,35 kJ · kg * ºC und nehmen Sie an, dass keine Phasenänderung auftritt.
- Eine 0,250 kg schwere Aluminiumschüssel mit 0,800 kg Suppe bei 25,0 ºC wird in einen Gefrierschrank gestellt. Was ist die Endtemperatur, wenn 377 kJ Energie aus der Schüssel und der Suppe übertragen werden, vorausgesetzt, die thermischen Eigenschaften der Suppe sind die gleichen wie die von Wasser?
- Ein Eiswürfel von 0,0500 kg bei -30,0 ºC wird in einem sehr gut isolierten Behälter in 0,400 kg 35,0ºC Wasser gegeben. Was ist die Endtemperatur?
- Wenn Sie 0,0100 kg 20,0 ºC Wasser auf einen 1,20 kg schweren Eisblock (der anfangs -15,0 ºC hat) gießen, wie hoch ist die Endtemperatur? Sie können davon ausgehen, dass das Wasser so schnell abkühlt, dass die Auswirkungen der Umgebung vernachlässigbar sind.Indigene Völker kochen manchmal in wasserdichten Körben, indem sie heiße Steine in Wasser legen, um es zum Kochen zu bringen. Welche Masse von 500ºC Gestein muss in 4,00 kg 15,0ºC Wasser gegeben werden, um seine Temperatur auf 100ºC zu bringen, wenn 0,0250 kg Wasser als Dampf aus dem anfänglichen Brutzeln entweicht? Sie können die Auswirkungen der Umgebung vernachlässigen und die durchschnittliche spezifische Wärme der Gesteine als die von Granit annehmen.
- Was wäre die Endtemperatur der Pfanne und des Wassers bei der Berechnung der Endtemperatur, wenn Wärme zwischen zwei Körpern übertragen wird: Kaltes Wasser in eine heiße Pfanne gießen, wenn 0,260 kg Wasser in die Pfanne gegeben werden und 0,0100 kg des Wassers sofort verdampfen und der Rest auf eine gemeinsame Temperatur mit der Pfanne kommen?
- In einigen Ländern wird flüssiger Stickstoff auf Milchwagen anstelle von mechanischen Kühlschränken verwendet. EIN 3.00-Stunden-Lieferfahrt erfordert 200 L flüssigen Stickstoff, der eine Dichte von 808 kg / m3 hat. (a) Berechnen Sie die Wärmeübertragung, die erforderlich ist, um diese Menge flüssigen Stickstoffs zu verdampfen und seine Temperatur auf 3,00 ºC zu erhöhen. (Verwenden Sie cp und nehmen Sie an, dass es über den Temperaturbereich konstant ist.) Dieser Wert ist die Kühlmenge, die der flüssige Stickstoff liefert. (b) Was ist diese Wärmeübertragungsrate in Kilowattstunden? (c) Vergleichen Sie die Kühlmenge, die durch Schmelzen einer identischen Masse von 0ºC Eis mit der durch Verdampfen des flüssigen Stickstoffs erhalten wird.
- Einige Waffenfans stellen ihre eigenen Kugeln her, bei denen die Bleischnecken geschmolzen und gegossen werden. Wie viel Wärmeübertragung ist erforderlich, um die Temperatur zu erhöhen und 0,500 kg Blei ab 25,0 ºC zu schmelzen?
Glossar
Sublimationswärme: Die Energie, die benötigt wird, um einen Stoff von der festen Phase in die Dampfphase zu überführen
Latentwärmekoeffizient: eine physikalische Konstante, die der Wärmemenge entspricht, die für jedes 1 kg eines Stoffes während des Phasenwechsels des Stoffes übertragen wird
Sublimationskoeffizient:eine physikalische Konstante, die: der Übergang von der Festphase zur Dampfphase
Ausgewählte Problemlösungen & Übungen
1. 35,9 kcal
3. (ein) 591 kcal; (b) 4.94 × 103 s
5. 13,5 Watt
7. (ein) 148 kcal; (b) 0.418 s, 3.34 s, 4.19 s, 22.6 s, 0.456 s
9. 33,0 g
10. (a) 9,67 L; (b) Rohöl ist weniger dicht als Wasser, daher schwimmt es auf dem Wasser und setzt es dadurch dem Sauerstoff in der Luft aus, den es zum Verbrennen verwendet. Wenn sich das Wasser unter dem Öl befindet, absorbiert es die vom Öl erzeugte Wärme weniger effizient.
12. (ein) 319 kcal; (b) 2,00 ºC
14. 20,6ºC
16. 4,38 kg
18. (a) 1,57 × 104 kcal; (b) 18,3 kW ⋅ h; (c) 1,29 × 104 kcal
- Angegebene Werte bei den normalen Schmelz- und Siedetemperaturen bei normalem Atmosphärendruck (1 atm). ↵
- Bei 37,0ºC (Körpertemperatur)beträgt die Verdampfungswärme Lv für Wasser 2430 kJ/kg oder 580 kcal/kg ↵
- Bei 37,0ºC (Körpertemperatur) beträgt die Verdampfungswärme Lv für Wasser 2430 kJ/kg oder 580 kcal/kg ↵